Liaison hydrogène
La force d’attraction entre les molécules d’eau est une interaction dipolaire. Les atomes d’hydrogène sont liés à l’atome d’oxygène hautement électronégatif (qui possède également deux paires d’électrons isolées, ce qui crée une liaison très polaire). L’atome d’hydrogène partiellement positif d’une molécule est alors attiré par l’atome d’oxygène d’une molécule d’eau voisine (voir figure ci-dessous).
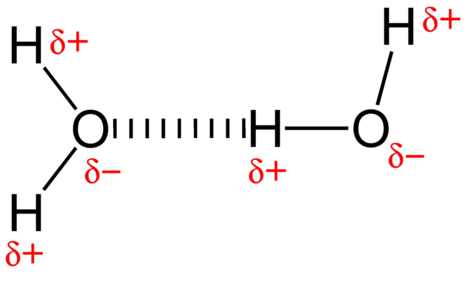
Une liaison hydrogène est une force d’attraction intermoléculaire dans laquelle un atome d’hydrogène lié de manière covalente à un petit atome hautement électronégatif est attiré par une seule paire d’électrons sur un atome d’une molécule voisine. Les liaisons hydrogène sont très fortes par rapport aux autres interactions dipolaires. La force d’une liaison hydrogène typique est d’environ \ (5 \%\) de celle d’une liaison covalente.
La liaison hydrogène se produit uniquement dans les molécules où l’hydrogène est lié de manière covalente à l’un des trois éléments: le fluor, l’oxygène ou l’azote. Ces trois éléments sont tellement électronégatifs qu’ils retirent la majorité de la densité électronique dans la liaison covalente avec l’hydrogène, laissant l’atome \(\ce{H}\) très déficient en électrons. L’atome \(\ce{H}\) agit presque comme un proton nu, le laissant très attiré par les électrons de paires isolées sur un atome proche.
La liaison hydrogène qui se produit dans l’eau conduit à des propriétés inhabituelles, mais très importantes. La plupart des composés moléculaires ayant une masse similaire à l’eau sont des gaz à température ambiante. En raison des fortes liaisons hydrogène, les molécules d’eau peuvent rester condensées à l’état liquide. La figure ci-dessous montre comment la forme courbée et deux atomes d’hydrogène par molécule permettent à chaque molécule d’eau de se lier d’hydrogène à deux autres molécules.
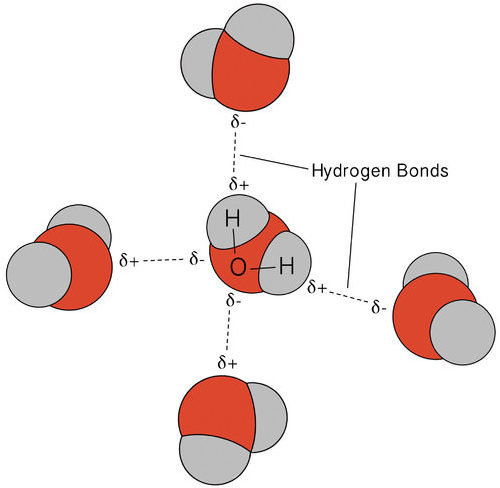
À l’état liquide, les liaisons hydrogène de l’eau peuvent se rompre et se reformer lorsque les molécules s’écoulent d’un endroit à un autre. Lorsque l’eau est refroidie, les molécules commencent à ralentir. Finalement, lorsque l’eau est gelée en glace, les liaisons hydrogène deviennent permanentes et forment un réseau très spécifique (voir figure ci-dessous).
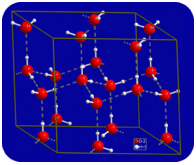
La forme courbée des molécules entraîne des lacunes dans le réseau de liaison hydrogène de la glace. La glace a la propriété très inhabituelle que son état solide est moins dense que son état liquide. La glace flotte dans l’eau. Pratiquement toutes les autres substances sont plus denses à l’état solide qu’à l’état liquide. Les liaisons hydrogène jouent un rôle biologique très important dans les structures physiques des protéines et des acides nucléiques.
