Enlaces de hidrógeno
La fuerza de atracción entre las moléculas de agua es una interacción dipolar. Los átomos de hidrógeno están unidos al átomo de oxígeno altamente electronegativo (que también posee dos pares de electrones, formando un enlace muy polar). El átomo de hidrógeno parcialmente positivo de una molécula es atraído por el átomo de oxígeno de una molécula de agua cercana (ver la figura a continuación).
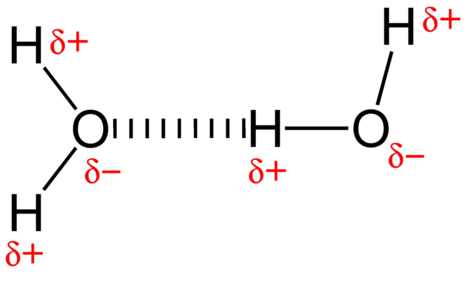
Un enlace de hidrógeno es una fuerza de atracción intermolecular en la que un átomo de hidrógeno unido covalentemente a un pequeño átomo altamente electronegativo es atraído por un par solitario de electrones en un átomo en una molécula vecina. Los enlaces de hidrógeno son muy fuertes en comparación con otras interacciones dipolares. La fuerza de un enlace de hidrógeno típico es aproximadamente \(5\%\) de la de un enlace covalente.
El enlace de hidrógeno ocurre solo en moléculas donde el hidrógeno está unido covalentemente a uno de tres elementos: flúor, oxígeno o nitrógeno. Estos tres elementos son tan electronegativos que retiran la mayor parte de la densidad electrónica en el enlace covalente con el hidrógeno, dejando al átomo \(\ce{H}\) muy deficiente en electrones. El átomo \(\ce{H}\) casi actúa como un protón desnudo, dejándolo muy atraído por electrones de pares solitarios en un átomo cercano.
El enlace de hidrógeno que se produce en el agua conduce a algunas propiedades inusuales, pero muy importantes. La mayoría de los compuestos moleculares que tienen una masa similar al agua son gases a temperatura ambiente. Debido a los fuertes enlaces de hidrógeno, las moléculas de agua pueden permanecer condensadas en estado líquido. La siguiente figura muestra cómo la forma doblada y dos átomos de hidrógeno por molécula permiten que cada molécula de agua pueda unirse a otras dos moléculas de hidrógeno.
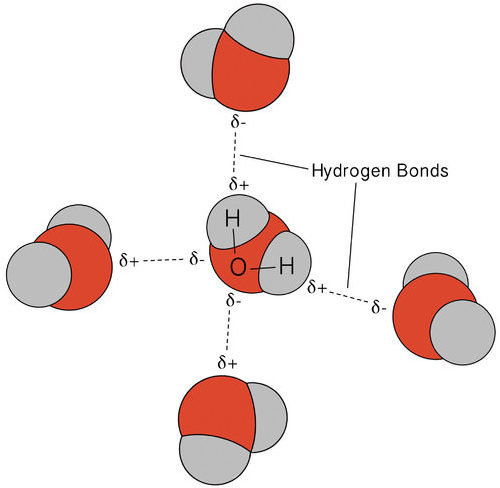
En el estado líquido, los enlaces de hidrógeno del agua pueden romperse y reformarse a medida que las moléculas fluyen de un lugar a otro. Cuando el agua se enfría, las moléculas comienzan a ralentizarse. Eventualmente, cuando el agua se congela hasta convertirse en hielo, los enlaces de hidrógeno se vuelven permanentes y forman una red muy específica (ver la figura a continuación).
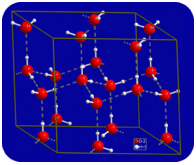
La forma doblada de las moléculas conduce a huecos en la red de enlace de hidrógeno del hielo. El hielo tiene la propiedad muy inusual de que su estado sólido es menos denso que su estado líquido. El hielo flota en el agua. Prácticamente todas las demás sustancias son más densas en estado sólido que en estado líquido. Los enlaces de hidrógeno desempeñan un papel biológico muy importante en las estructuras físicas de las proteínas y los ácidos nucleicos.
