vätebindning
den attraktiva kraften mellan vattenmolekyler är en dipolinteraktion. Väteatomerna är bundna till den mycket elektronegativa syreatomen (som också har två ensamma paruppsättningar elektroner, vilket ger en mycket polär bindning). Den delvis positiva väteatomen i en molekyl lockas sedan till syreatomen i en närliggande vattenmolekyl (se figur nedan).
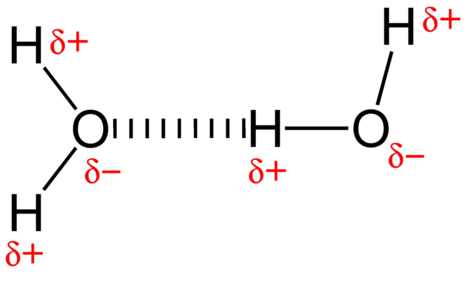
en vätebindning är en intermolekylär attraktiv kraft där en väteatom som är kovalent bunden till en liten, mycket elektronegativ atom lockas till ett ensamt elektronpar på en atom i en angränsande molekyl. Vätebindningar är mycket starka jämfört med andra dipolinteraktioner. Styrkan hos en typisk vätebindning är ungefär \(5\%\) av den för en kovalent bindning.vätebindning sker endast i molekyler där väte är kovalent bunden till ett av tre element: fluor, syre eller kväve. Dessa tre element är så elektronegativa att de drar tillbaka majoriteten av elektrondensiteten i den kovalenta bindningen med väte och lämnar atomen \(\ce{H}\) mycket elektronbrist. Atomen\ (\ce{H}\) fungerar nästan som en bar proton, vilket gör att den är mycket lockad till ensamma parelektroner på en närliggande atom.
vätebindningen som uppstår i vatten leder till några ovanliga men mycket viktiga egenskaper. De flesta molekylära föreningar som har en massa som liknar vatten är gaser vid rumstemperatur. På grund av de starka vätebindningarna kan vattenmolekyler förbli kondenserade i flytande tillstånd. Figuren nedan visar hur den böjda formen och två väteatomer per molekyl gör att varje vattenmolekyl kan vätebindas till två andra molekyler.
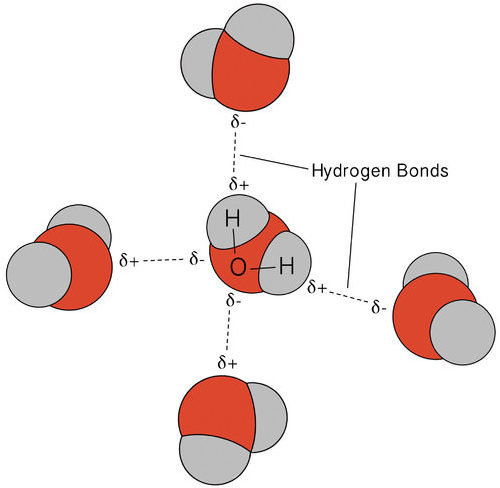
i flytande tillstånd kan vätebindningarna av vatten bryta och reformera när molekylerna flyter från en plats till en annan. När vatten kyls börjar molekylerna sakta ner. Så småningom, när vatten fryses till IS, blir vätebindningarna permanenta och bildar ett mycket specifikt nätverk (se figur nedan).
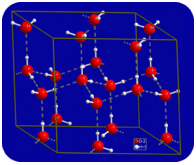
molekylernas böjda form leder till luckor i vätebindningsnätet för is. IS har den mycket ovanliga egenskapen att dess fasta tillstånd är mindre tätt än dess flytande tillstånd. Isen flyter i vatten. Nästan alla andra ämnen är tätare i fast tillstånd än i flytande tillstånd. Vätebindningar spelar en mycket viktig biologisk roll i de fysiska strukturerna av proteiner och nukleinsyror.
