waterstofbindingen
de aantrekkingskracht tussen watermoleculen is een dipoolinteractie. De waterstofatomen zijn gebonden aan het zeer elektronegatieve zuurstofatoom (dat ook twee eenzame paarsets elektronen bezit, wat zorgt voor een zeer polaire binding). Het gedeeltelijk positieve waterstofatoom van één molecuul wordt dan aangetrokken door het zuurstofatoom van een nabijgelegen watermolecuul (zie figuur hieronder).
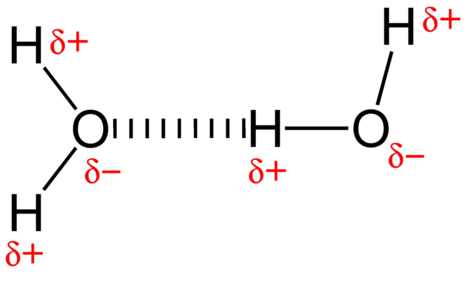
een waterstofbinding is een intermoleculaire aantrekkingskracht waarbij een waterstofatoom dat covalent gebonden is aan een klein, zeer elektronegatief atoom wordt aangetrokken door een enkel paar elektronen op een atoom in een naburig molecuul. Waterstofbindingen zijn zeer sterk in vergelijking met andere dipoolinteracties. De sterkte van een typische waterstofbinding is ongeveer \(5\%\) van die van een covalente binding.
waterstofbinding komt alleen voor in moleculen waar waterstof covalent gebonden is aan een van de drie elementen: fluor, zuurstof of stikstof. Deze drie elementen zijn zo elektronegatief dat ze het grootste deel van de elektronendichtheid in de covalente binding met waterstof terugtrekken, waardoor het \(\ce{H}\) atoom zeer elektron-deficiënt blijft. Het\ (\ce{H}\) atoom fungeert bijna als een kaal proton, waardoor het zeer aangetrokken wordt door eenzame paarelektronen op een nabijgelegen atoom.
De waterstofbinding in water leidt tot een aantal ongewone, maar zeer belangrijke eigenschappen. De meeste moleculaire verbindingen die een massa hebben die lijkt op water zijn gassen bij kamertemperatuur. Door de sterke waterstofbindingen kunnen watermoleculen gecondenseerd blijven in de vloeibare toestand. De figuur hieronder laat zien hoe de gebogen vorm en twee waterstofatomen per molecuul elk watermolecuul in staat stelt om waterstof te binden aan twee andere moleculen.
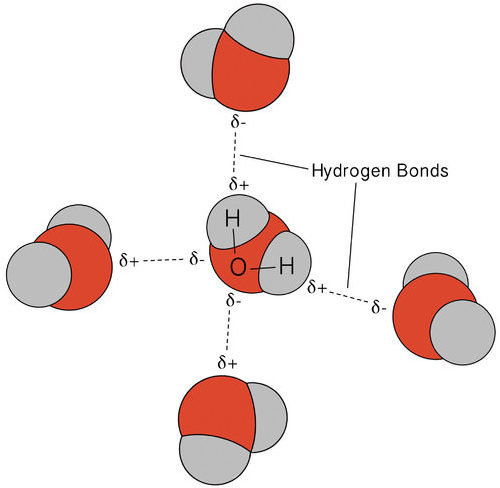
in vloeibare toestand kunnen de waterstofbindingen van water breken en zich hervormen als de moleculen van de ene plaats naar de andere stromen. Wanneer water wordt afgekoeld, beginnen de moleculen te vertragen. Uiteindelijk, wanneer water bevroren is tot ijs, worden de waterstofbruggen permanent en vormen ze een heel specifiek netwerk (zie figuur hieronder).
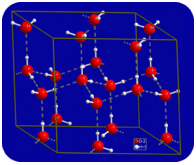
de gebogen vorm van de moleculen leidt tot hiaten in het waterstofbindingsnetwerk van ijs. Ijs heeft de zeer ongebruikelijke eigenschap dat zijn vaste toestand minder dicht is dan zijn vloeibare toestand. Ijs drijft in water. Vrijwel alle andere stoffen zijn in vaste toestand dichter dan in vloeibare toestand. Waterstofbindingen spelen een zeer belangrijke biologische rol in de fysische structuren van eiwitten en nucleïnezuren.
