wiązanie wodorowe
Siła przyciągania między cząsteczkami wody jest oddziaływaniem dipolowym. Atomy wodoru są związane z wysoce elektroujemnym atomem tlenu (który posiada również dwa pojedyncze pary zestawów elektronów, tworząc wiązanie bardzo polarne). Częściowo dodatni atom wodoru jednej cząsteczki jest następnie przyciągany do atomu tlenu pobliskiej cząsteczki wody (patrz rysunek poniżej).
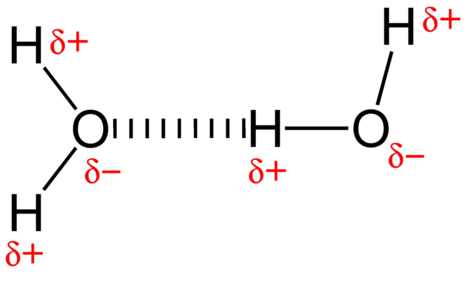
wiązanie wodorowe jest międzycząsteczkową siłą przyciągania, w której atom wodoru, który jest kowalencyjnie związany z małym, wysoce elektroujemnym atomem, jest przyciągany do Samotnej pary elektronów na atomie w sąsiedniej cząsteczce. Wiązania wodorowe są bardzo silne w porównaniu z innymi oddziaływaniami dipolowymi. Siła typowego wiązania wodorowego wynosi około \(5\%\) siły wiązania kowalencyjnego.
wiązanie wodorowe występuje tylko w cząsteczkach, w których wodór jest kowalencyjnie związany z jednym z trzech pierwiastków: fluorem, tlenem lub azotem. Te trzy pierwiastki są tak elektroujemne, że wycofują większość gęstości elektronów w wiązaniu kowalencyjnym z wodorem, pozostawiając atom \(\ce{H}\) bardzo niedobory elektronów. Atom \(\ce{H}\) prawie działa jak nagi proton, pozostawiając go bardzo przyciągany do samotnych elektronów pary na pobliskim atomie.
wiązanie wodorowe, które występuje w wodzie, prowadzi do pewnych niezwykłych, ale bardzo ważnych właściwości. Większość związków molekularnych, które mają masę podobną do wody, to gazy w temperaturze pokojowej. Ze względu na silne wiązania wodorowe cząsteczki wody są w stanie pozostać skondensowane w stanie ciekłym. Poniższy rysunek pokazuje, w jaki sposób wygięty kształt i dwa atomy wodoru na cząsteczkę umożliwiają każdej cząsteczce wody Wiązanie wodoru z dwiema innymi cząsteczkami.
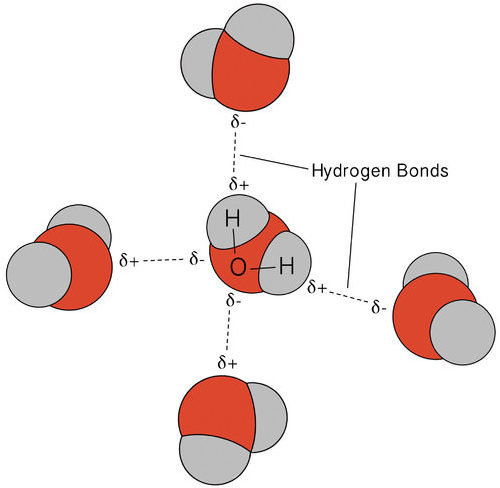
w stanie ciekłym wiązania wodorowe wody mogą pękać i reformować się, gdy cząsteczki przepływają z jednego miejsca do drugiego. Po ochłodzeniu wody cząsteczki zaczynają zwalniać. Ostatecznie, gdy woda jest zamrożona do lodu, wiązania wodorowe stają się trwałe i tworzą bardzo specyficzną sieć (patrz rysunek poniżej).
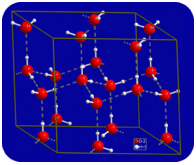
wygięty kształt cząsteczek prowadzi do przerw w sieci wiązania wodorowego lodu. Lód ma tę niezwykłą właściwość, że jego ciało stałe jest mniej gęste niż stan ciekły. Lód unosi się w wodzie. Praktycznie wszystkie inne substancje są gęstsze w stanie stałym niż w stanie ciekłym. Wiązania wodorowe odgrywają bardzo ważną rolę biologiczną w fizycznych strukturach białek i kwasów nukleinowych.
