Vodíkové vazby
přitažlivé síly mezi molekulami vody je dipól interakce. Atomy vodíku jsou vázány na silně elektronegativní atom kyslíku (který má také dva osamělé páry sady elektronů, což pro velmi polární vazba). Částečně pozitivní atom vodíku jedné molekuly je pak přitahován k atomu kyslíku blízké molekuly vody(viz obrázek níže).
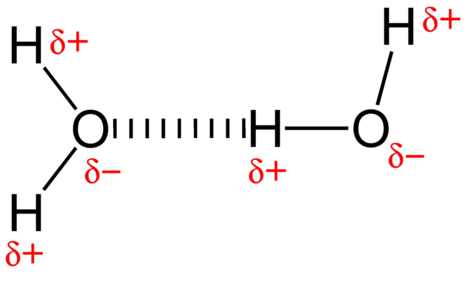
vodíková vazba je mezimolekulární přitažlivé síly, v nichž atom vodíku, který je kovalentně vázán na malé, vysoce elektronegativní atom přitahuje osamělý párů elektronů na atom v sousední molekule. Vodíkové vazby jsou velmi silné ve srovnání s jinými dipólovými interakcemi. Síla typické vodíkové vazby je asi \(5\%\) pevnosti kovalentní vazby.
Vodíková vazba se vyskytuje pouze v molekulách, kde je vodík kovalentně vázán na jeden ze tří prvků: fluor, kyslík nebo dusík. Tyto tři prvky jsou tak elektronegativní, že stáhnou většinu elektronové hustoty v kovalentní vazbu s vodíkem, takže \(\ce{H}\) atom velmi elektron-deficitní. Atom \(\ce{H}\) působí téměř jako holý proton, takže je velmi přitahován k elektronům osamělého páru na Blízkém atomu.
vodíková vazba, která se vyskytuje ve vodě, vede k některým neobvyklým, ale velmi důležitým vlastnostem. Většina molekulárních sloučenin, které mají hmotnost podobnou vodě, jsou plyny při pokojové teplotě. Díky silným vodíkovým vazbám jsou molekuly vody schopny zůstat kondenzované v kapalném stavu. Obrázek níže ukazuje, jak ohnutý tvar a dva atomy vodíku v molekule umožňuje každá molekula vody, aby mohli vodíkové vazby na další dvě molekuly.
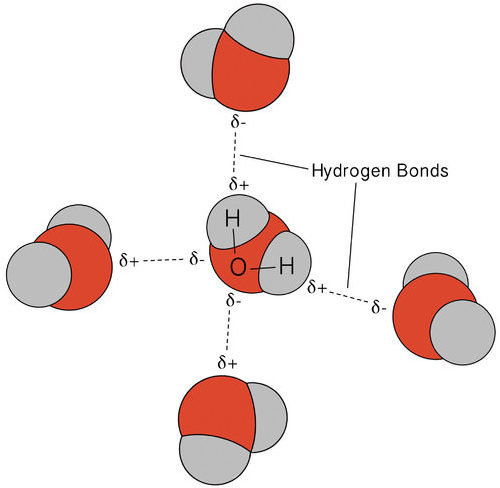
V kapalném stavu, vodíkové vazby vody může zlomit a reformy jako molekuly proudit z jednoho místa na druhé. Když se voda ochladí, molekuly se začnou zpomalovat. Nakonec, když je voda zmrzlá na led, vodíkové vazby se stávají trvalými a tvoří velmi specifickou síť (viz obrázek níže).
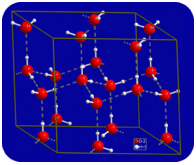
ohnutý tvar molekul vede k mezerám ve vodíkové vazby síť ice. LED má velmi neobvyklou vlastnost, že jeho pevný stav je méně hustý než jeho kapalný stav. LED se vznáší ve vodě. Prakticky všechny ostatní látky jsou v pevném stavu hustší než v kapalném stavu. Vodíkové vazby hrají velmi důležitou biologickou roli ve fyzikálních strukturách proteinů a nukleových kyselin.
