hydrogenbinding
den attraktive kraft mellem vandmolekyler er en dipolinteraktion. Hydrogenatomerne er bundet til det meget elektronegative iltatom (som også besidder to ensomme par sæt elektroner, hvilket giver en meget polær binding). Det delvist positive hydrogenatom i et molekyle tiltrækkes derefter til iltatomet i et nærliggende vandmolekyle (se figur nedenfor).
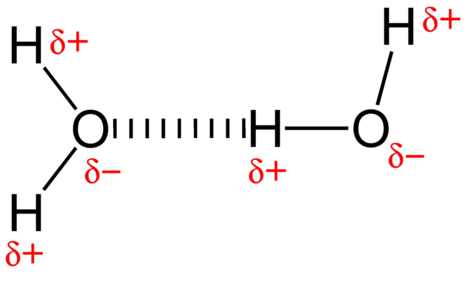
en hydrogenbinding er en intermolekylær attraktiv kraft, hvor et hydrogenatom, der er kovalent bundet til et lille, stærkt elektronegativt atom, tiltrækkes af et ensomt par elektroner på et atom i et nabomolekyle. Hydrogenbindinger er meget stærke sammenlignet med andre dipolinteraktioner. Styrken af en typisk hydrogenbinding er omkring \(5\%\) af den for en kovalent binding.hydrogenbinding forekommer kun i molekyler, hvor hydrogen er kovalent bundet til et af tre elementer: fluor, ilt eller nitrogen. Disse tre elementer er så elektronegative, at de trækker størstedelen af elektrondensiteten i den kovalente binding med hydrogen tilbage, hvilket efterlader \(\ce{H}\) atomet meget elektronmangel. Det\ (\ce{H}\) atom fungerer næsten som en bare proton, hvilket efterlader det meget tiltrukket af ensomme parelektroner på et nærliggende atom.den hydrogenbinding, der forekommer i vand, fører til nogle usædvanlige, men meget vigtige egenskaber. De fleste molekylære forbindelser, der har en masse svarende til vand, er gasser ved stuetemperatur. På grund af de stærke hydrogenbindinger er vandmolekyler i stand til at forblive kondenserede i flydende tilstand. Figuren nedenfor viser, hvordan den bøjede form og to hydrogenatomer pr.molekyle gør det muligt for hvert vandmolekyle at være i stand til hydrogenbinding til to andre molekyler.
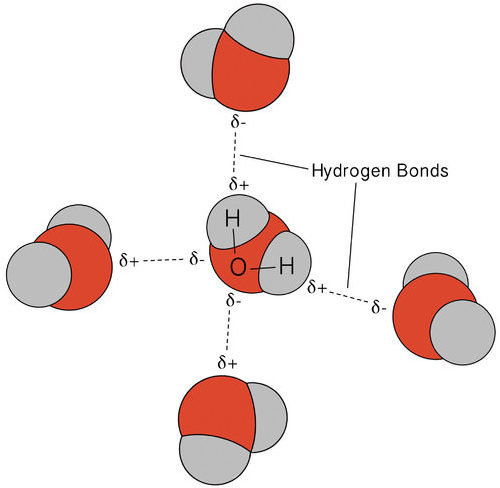
i flydende tilstand kan hydrogenbindingerne af vand bryde og reformere, når molekylerne strømmer fra et sted til et andet. Når vandet afkøles, begynder molekylerne at bremse. Til sidst, når vand fryses til is, bliver hydrogenbindingerne permanente og danner et meget specifikt netværk (se figur nedenfor).
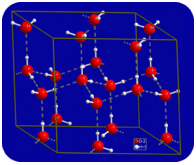
molekylernes bøjede form fører til huller i hydrogenbindingsnetværket af is. Is har den meget usædvanlige egenskab, at dens faste tilstand er mindre tæt end dens flydende tilstand. Is flyder i vand. Næsten alle andre stoffer er tættere i fast tilstand end i flydende tilstand. Hydrogenbindinger spiller en meget vigtig biologisk rolle i de fysiske strukturer af proteiner og nukleinsyrer.
