Wasserstoffbrückenbindung
Die Anziehungskraft zwischen Wassermolekülen ist eine Dipolwechselwirkung. Die Wasserstoffatome sind an das hochelektronegative Sauerstoffatom gebunden (das auch zwei einsame Elektronenpaare besitzt, was zu einer sehr polaren Bindung führt). Das teilweise positive Wasserstoffatom eines Moleküls wird dann vom Sauerstoffatom eines nahe gelegenen Wassermoleküls angezogen (siehe Abbildung unten).
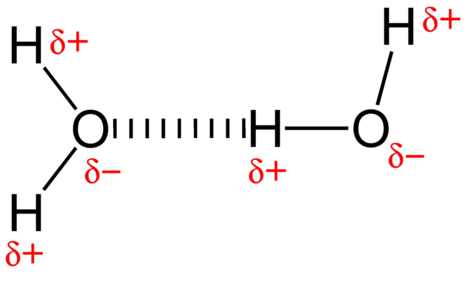
Eine Wasserstoffbindung ist eine intermolekulare Anziehungskraft, bei der ein Wasserstoffatom, das kovalent an ein kleines, hoch elektronegatives Atom gebunden ist, von einem einsamen Elektronenpaar an einem Atom in einem benachbarten Molekül angezogen wird. Wasserstoffbrückenbindungen sind im Vergleich zu anderen Dipolwechselwirkungen sehr stark. Die Stärke einer typischen Wasserstoffbindung beträgt etwa \(5\%\) der einer kovalenten Bindung.
Wasserstoffbindung tritt nur in Molekülen auf, in denen Wasserstoff kovalent an eines von drei Elementen gebunden ist: Fluor, Sauerstoff oder Stickstoff. Diese drei Elemente sind so elektronegativ, dass sie den Großteil der Elektronendichte in der kovalenten Bindung mit Wasserstoff zurückziehen, so dass das \ (\ ce {H}\) Atom sehr elektronenarm ist. Das \ (\ ce {H}\) -Atom wirkt fast wie ein bloßes Proton, so dass es sehr von einsamen Paarelektronen auf einem nahe gelegenen Atom angezogen wird.
Die Wasserstoffbindung, die in Wasser auftritt, führt zu einigen ungewöhnlichen, aber sehr wichtigen Eigenschaften. Die meisten molekularen Verbindungen, die eine wasserähnliche Masse haben, sind Gase bei Raumtemperatur. Aufgrund der starken Wasserstoffbrückenbindungen können Wassermoleküle im flüssigen Zustand kondensiert bleiben. Die folgende Abbildung zeigt, wie die gebogene Form und zwei Wasserstoffatome pro Molekül es jedem Wassermolekül ermöglichen, sich an zwei andere Moleküle mit Wasserstoff zu binden.
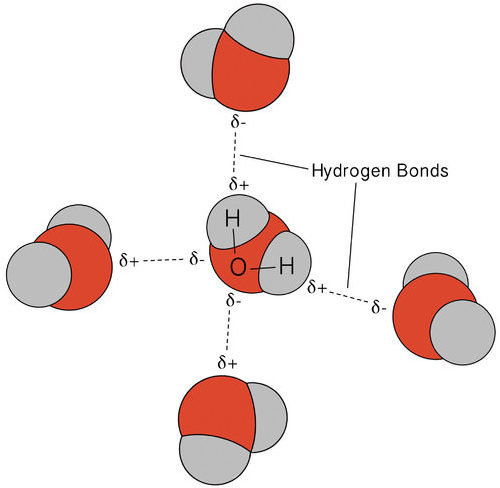
Im flüssigen Zustand können die Wasserstoffbrückenbindungen von Wasser brechen und sich reformieren, wenn die Moleküle von einem Ort zum anderen fließen. Wenn Wasser abgekühlt ist, beginnen sich die Moleküle zu verlangsamen. Wenn Wasser zu Eis gefroren wird, werden die Wasserstoffbrückenbindungen dauerhaft und bilden ein sehr spezifisches Netzwerk (siehe Abbildung unten).
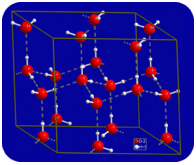
Die gebogene Form der Moleküle führt zu Lücken im Wasserstoffbindungsnetzwerk von Eis. Eis hat die sehr ungewöhnliche Eigenschaft, dass sein fester Zustand weniger dicht ist als sein flüssiger Zustand. Eis schwimmt im Wasser. Praktisch alle anderen Substanzen sind im festen Zustand dichter als im flüssigen Zustand. Wasserstoffbrückenbindungen spielen eine sehr wichtige biologische Rolle in den physikalischen Strukturen von Proteinen und Nukleinsäuren.
