Hydrogen Bonding
The attractive force between water molecules is a dipole interaction. Os átomos de hidrogênio estão ligados ao átomo de oxigênio altamente eletronegativo (que também possui dois pares de elétrons isolados, o que faz com que uma ligação muito polar). O átomo de hidrogênio parcialmente positivo de uma molécula é então atraído para o átomo de oxigênio de uma molécula de água próxima (ver figura abaixo).
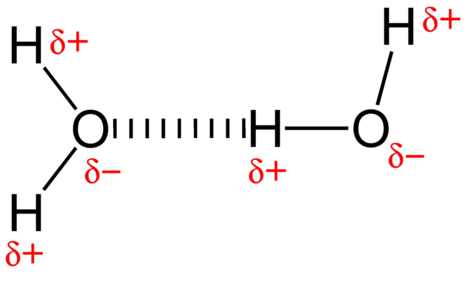
Uma ligação de hidrogênio é uma intermoleculares atrativas de força em que um átomo de hidrogênio que está ligadas ligada a um pequeno, altamente eletronegativos átomo é atraído para um solitário par de elétrons em um átomo em uma molécula vizinha. Ligações de hidrogênio são muito fortes em comparação com outras interações dipolares. A força de uma ligação típica de hidrogénio é cerca de \(5\%\) da de uma ligação covalente.
ligação ao hidrogénio ocorre apenas em moléculas onde o hidrogénio Está ligado covalentemente a um dos três elementos: flúor, oxigénio ou azoto. Estes três elementos são tão eletronegativos que retiram a maioria da densidade de elétrons na ligação covalente com hidrogênio, deixando o átomo \(\ce{H}\) muito deficiente em elétrons. O átomo \(\ce{H}\) quase age como um próton, deixando-o muito atraído por pares isolados de electrões num átomo próximo.
a ligação do hidrogénio que ocorre na água leva a algumas propriedades incomuns, mas muito importantes. A maioria dos compostos moleculares que têm uma massa semelhante à água são gases à temperatura ambiente. Devido às fortes ligações de hidrogênio, as moléculas de água são capazes de permanecer condensadas no estado líquido. A figura abaixo mostra como a forma dobrada e dois átomos de hidrogênio por molécula permite que cada molécula de água seja capaz de ligar hidrogênio a duas outras moléculas.
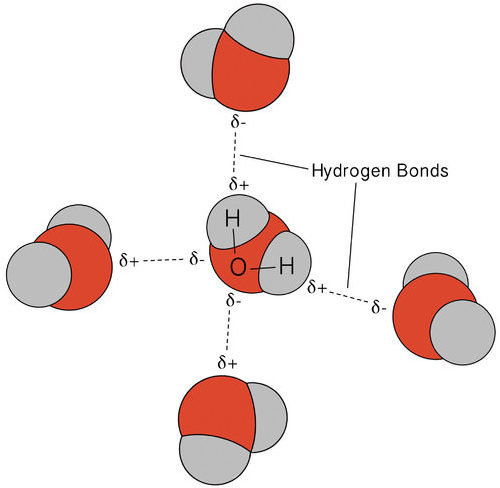
no estado líquido, as ligações de hidrogénio da água podem quebrar-se e reformar-se à medida que as moléculas fluem de um lugar para outro. Quando a água é arrefecida, as moléculas começam a abrandar. Eventualmente, quando a água é congelada ao gelo, as ligações de hidrogénio tornam-se permanentes e formam uma rede muito específica (ver figura abaixo).
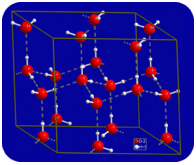
The bent shape of the molecules leads to gaps in the hydrogen bonding network of ice. O gelo tem a propriedade muito incomum de que seu estado sólido é menos denso do que seu estado líquido. O gelo flutua na água. Praticamente todas as outras substâncias são mais densas no estado sólido do que no estado líquido. As ligações de hidrogénio desempenham um papel biológico muito importante nas estruturas físicas das proteínas e dos ácidos nucleicos.
