vetysidos
vesimolekyylien välinen houkutteleva voima on dipolien vuorovaikutus. Vetyatomit ovat sitoutuneet erittäin elektronegatiiviseen happiatomiin (jolla on myös kaksi yksinäistä elektroniparijoukkoa, jolloin syntyy hyvin polaarinen sidos). Tämän jälkeen yhden molekyylin osittain positiivinen vetyatomi vetää puoleensa läheisen vesimolekyylin happiatomia (KS.kuva alla).
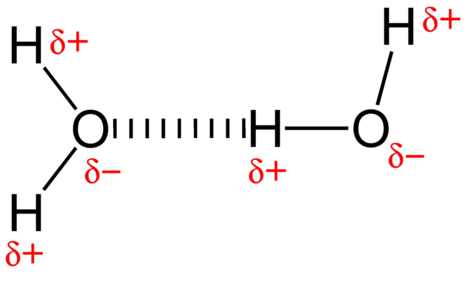
vetysidos on molekyylien välinen puoleensavetävä voima, jossa pieneen, erittäin elektronegatiiviseen atomiin kovalenttisesti sitoutunut vetyatomi vetää puoleensa viereisen molekyylin atomin yksinäistä elektroniparia. Vetysidokset ovat hyvin vahvoja verrattuna muihin dipolien vuorovaikutuksiin. Tyypillisen vetysidoksen vahvuus on noin \(5\%\) kovalenttisen sidoksen voimakkuudesta.
vetysidos tapahtuu vain molekyyleissä, joissa vety on sitoutunut kovalenttisesti johonkin kolmesta alkuaineesta: fluoriin, Happeen tai typpeen. Nämä kolme alkuainetta ovat niin elektronegatiivisia, että ne vetävät suurimman osan kovalenttisen sidoksen elektronitiheydestä vedyn kanssa, jolloin \(\ce{H}\) atomi on hyvin elektronivajainen. \(\Ce{H}\) atomi toimii lähes paljaana protonina, jolloin se vetää puoleensa läheisen atomin yksinäisiä elektroneja.
vedessä tapahtuva vetysidos johtaa joihinkin epätavallisiin, mutta erittäin tärkeisiin ominaisuuksiin. Useimmat molekyyliyhdisteet, joiden massa muistuttaa vettä, ovat huoneenlämpötilassa kaasuja. Vahvojen vetysidosten ansiosta vesimolekyylit pystyvät pysymään tiivistyneenä nestemäisessä tilassa. Alla olevassa kuvassa näkyy, miten taipunut muoto ja kaksi vetyatomia molekyyliä kohti mahdollistaa sen, että jokainen vesimolekyyli pystyy vetysidokseen kahteen muuhun molekyyliin.
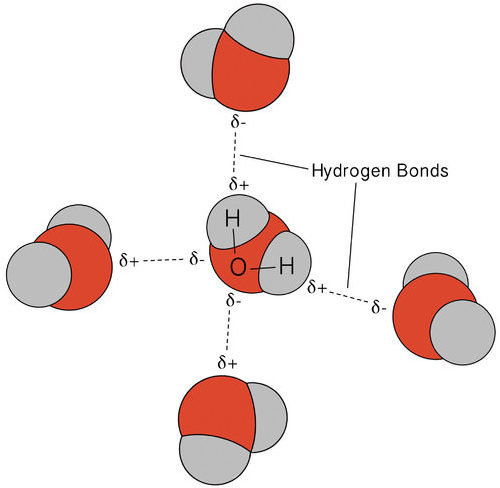
nestemäisessä tilassa veden vetysidokset voivat katketa ja uudistua molekyylien virratessa paikasta toiseen. Kun vesi jäähtyy, molekyylit alkavat hidastua. Lopulta, kun vesi jäätyy jääksi, vetysidokset muuttuvat pysyviksi ja muodostavat hyvin spesifisen verkoston (KS.kuva alla).
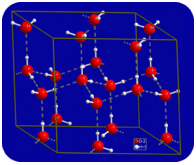
molekyylien taipunut muoto johtaa aukkoihin jään vetysidosverkossa. Jäällä on se hyvin epätavallinen ominaisuus, että sen kiinteä olomuoto on vähemmän tiheä kuin sen nestemäinen olomuoto. Jää kelluu vedessä. Käytännössä kaikki muut aineet ovat kiinteässä olomuodossa tiheämpiä kuin nestemäisessä olomuodossa. Vetysidoksilla on erittäin tärkeä biologinen rooli proteiinien ja nukleiinihappojen fysikaalisissa rakenteissa.
