Hydrogen Bonding
La forza attrattiva tra le molecole d’acqua è un’interazione a dipolo. Gli atomi di idrogeno sono legati all’atomo di ossigeno altamente elettronegativo (che possiede anche due coppie di elettroni solitari, creando un legame molto polare). L’atomo di idrogeno parzialmente positivo di una molecola viene quindi attratto dall’atomo di ossigeno di una molecola d’acqua vicina (vedi figura sotto).
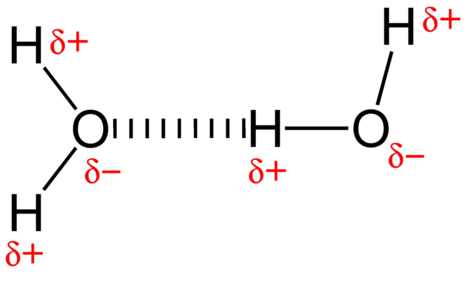
Un legame idrogeno è una forza attrattiva intermolecolare in cui un atomo di idrogeno che è legato covalentemente a un piccolo atomo altamente elettronegativo è attratto da una coppia solitaria di elettroni su un atomo in una molecola vicina. I legami idrogeno sono molto forti rispetto ad altre interazioni di dipolo. La forza di un tipico legame idrogeno è circa \(5\%\) di quella di un legame covalente.
Il legame dell’idrogeno si verifica solo nelle molecole in cui l’idrogeno è legato covalentemente a uno dei tre elementi: fluoro, ossigeno o azoto. Questi tre elementi sono così elettronegativi che ritirano la maggior parte della densità elettronica nel legame covalente con l’idrogeno, lasciando l’atomo \(\ce{H}\) molto carente di elettroni. L’atomo\ (\ce{H}\) agisce quasi come un protone nudo, lasciandolo molto attratto dagli elettroni della coppia solitaria su un atomo vicino.
Il legame di idrogeno che si verifica in acqua porta ad alcune proprietà insolite, ma molto importanti. La maggior parte dei composti molecolari che hanno una massa simile all’acqua sono gas a temperatura ambiente. A causa dei forti legami idrogeno, le molecole d’acqua sono in grado di rimanere condensate allo stato liquido. La figura seguente mostra come la forma piegata e due atomi di idrogeno per molecola consente a ciascuna molecola d’acqua di essere in grado di legare l’idrogeno ad altre due molecole.
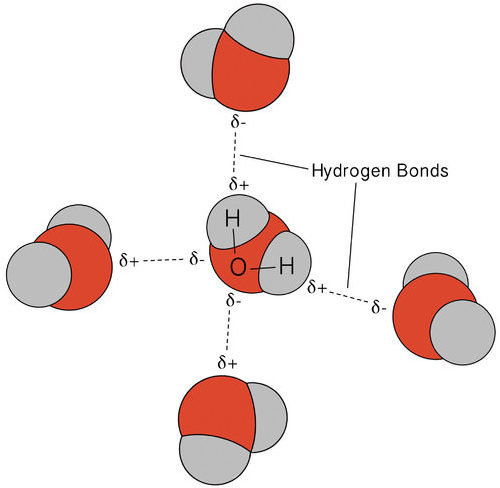
Allo stato liquido, i legami idrogeno dell’acqua possono rompersi e riformarsi mentre le molecole fluiscono da un luogo all’altro. Quando l’acqua viene raffreddata, le molecole iniziano a rallentare. Alla fine, quando l’acqua viene congelata in ghiaccio, i legami idrogeno diventano permanenti e formano una rete molto specifica (vedi figura sotto).
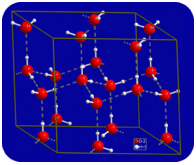
La forma piegata delle molecole porta a lacune nella rete di legame dell’idrogeno del ghiaccio. Il ghiaccio ha la proprietà molto insolita che il suo stato solido è meno denso del suo stato liquido. Il ghiaccio galleggia nell’acqua. Praticamente tutte le altre sostanze sono più dense allo stato solido che allo stato liquido. I legami idrogeno svolgono un ruolo biologico molto importante nelle strutture fisiche delle proteine e degli acidi nucleici.
