Hydrogenbinding
den attraktive kraften mellom vannmolekyler er en dipolinteraksjon. Hydrogenatomene er bundet til det svært elektronegative oksygenatomet (som også har to ensomme par sett med elektroner, noe som gir en veldig polar binding). Det delvis positive hydrogenatomet i ett molekyl blir så tiltrukket av oksygenatomet i et nærliggende vannmolekyl (se figur nedenfor).
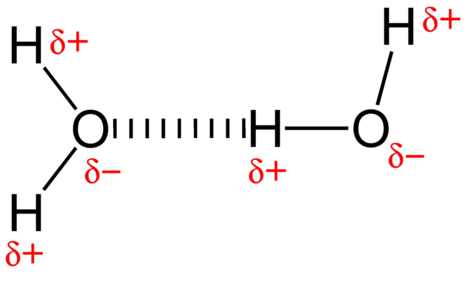
en hydrogenbinding er en intermolekylær attraktiv kraft der et hydrogenatom som er kovalent bundet til et lite, svært elektronegativt atom, tiltrekkes av et lone par elektroner på et atom i et nærliggende molekyl. Hydrogenbindinger er svært sterke sammenlignet med andre dipolinteraksjoner. Styrken til en typisk hydrogenbinding er omtrent \(5\%\) av den for en kovalent binding.hydrogenbinding forekommer bare i molekyler der hydrogen er kovalent bundet til ett av tre elementer: fluor, oksygen eller nitrogen. Disse tre elementene er så elektronegative at de trekker størstedelen av elektrontettheten i den kovalente bindingen med hydrogen, og forlater \(\ce{H}\) atom veldig elektron-mangelfull. \ (\Ce{H}\) atom fungerer nesten som et bare proton, og etterlater det veldig tiltrukket av ensomme parelektroner på et nærliggende atom.hydrogenbindingen som oppstår i vann fører til noen uvanlige, men svært viktige egenskaper. De fleste molekylære forbindelser som har en masse som ligner på vann, er gasser ved romtemperatur. På grunn av de sterke hydrogenbindingene kan vannmolekyler holde seg kondensert i flytende tilstand. Figuren nedenfor viser hvordan den bøyde formen og to hydrogenatomer per molekyl gjør at hvert vannmolekyl kan hydrogenbindes til to andre molekyler.
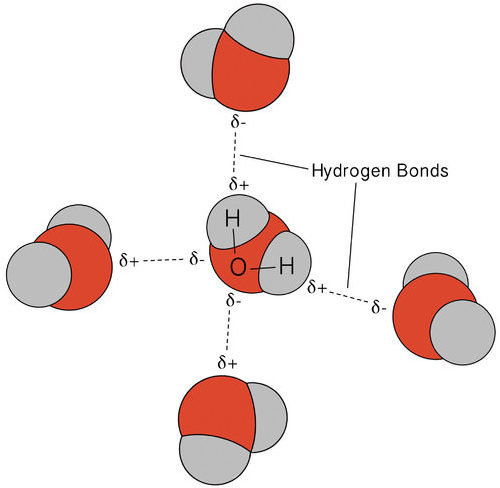
i flytende tilstand kan hydrogenbindingene av vann bryte og reformere ettersom molekylene strømmer fra ett sted til et annet. Når vannet avkjøles, begynner molekylene å senke. Til slutt, når vann er frosset til is, blir hydrogenbindingene permanente og danner et veldig spesifikt nettverk (se figur nedenfor).
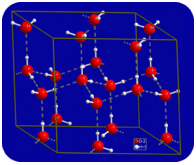
den bøyde formen av molekylene fører til hull i hydrogenbindingsnettverket av is. Is har den svært uvanlige egenskapen at dens faste tilstand er mindre tett enn dens flytende tilstand. Isen flyter i vannet. Nesten alle andre stoffer er tettere i fast tilstand enn i flytende tilstand. Hydrogenbindinger spiller en svært viktig biologisk rolle i de fysiske strukturer av proteiner og nukleinsyrer.
