legături de hidrogen
forța de atracție dintre moleculele de apă este o interacțiune dipol. Atomii de hidrogen sunt legați de atomul de oxigen extrem de electronegativ (care posedă, de asemenea, două perechi de electroni singuri, ceea ce face o legătură foarte polară). Atomul de hidrogen parțial pozitiv al unei molecule este apoi atras de atomul de oxigen al unei molecule de apă din apropiere (vezi figura de mai jos).
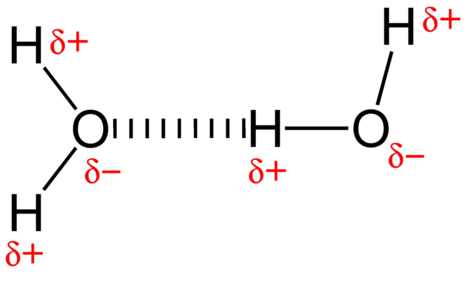
o legătură de hidrogen este o forță de atracție intermoleculară în care un atom de hidrogen care este legat covalent de un atom mic, foarte electronegativ este atras de o pereche singură de electroni pe un atom dintr-o moleculă vecină. Legăturile de hidrogen sunt foarte puternice în comparație cu alte interacțiuni dipol. Puterea unei legături tipice de hidrogen este de aproximativ \(5\%\) din cea a unei legături covalente.
legarea hidrogenului are loc numai în molecule în care hidrogenul este legat covalent de unul dintre cele trei elemente: fluor, oxigen sau azot. Aceste trei elemente sunt atât de electronegative încât retrag majoritatea densității electronilor în legătura covalentă cu hidrogenul, lăsând atomul \(\ce{H}\) foarte deficitar de electroni. Atomul \ (\ce{H}\) acționează aproape ca un proton gol, lăsându-l foarte atras de electronii pereche singuri pe un atom din apropiere.
legătura de hidrogen care apare în apă duce la unele proprietăți neobișnuite, dar foarte importante. Majoritatea compușilor moleculari care au o masă similară cu apa sunt gaze la temperatura camerei. Datorită legăturilor puternice de hidrogen, moleculele de apă sunt capabile să rămână condensate în stare lichidă. Figura de mai jos arată modul în care forma îndoită și doi atomi de hidrogen pe moleculă permit fiecărei molecule de apă să poată lega hidrogenul de alte două molecule.
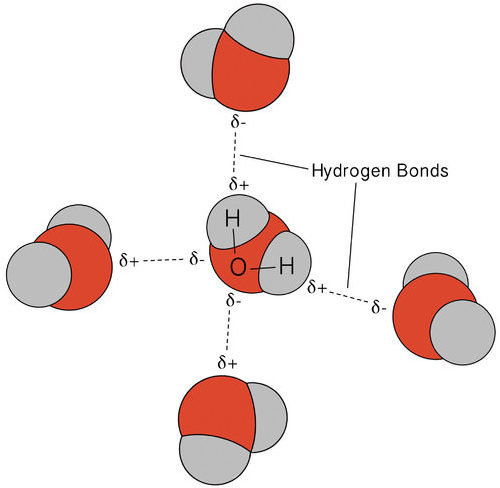
în stare lichidă, legăturile de hidrogen ale apei se pot rupe și reforma pe măsură ce moleculele curg dintr-un loc în altul. Când apa este răcită, moleculele încep să încetinească. În cele din urmă, când apa este înghețată la gheață, legăturile de hidrogen devin permanente și formează o rețea foarte specifică (vezi figura de mai jos).
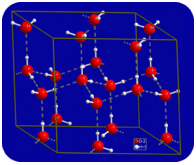
forma îndoită a moleculelor duce la goluri în rețeaua de legare a hidrogenului de gheață. Gheața are proprietatea foarte neobișnuită că starea sa solidă este mai puțin densă decât starea sa lichidă. Gheața plutește în apă. Practic toate celelalte substanțe sunt mai dense în stare solidă decât în stare lichidă. Legăturile de hidrogen joacă un rol biologic foarte important în structurile fizice ale proteinelor și acizilor nucleici.
