hidrogénkötés
a vízmolekulák közötti vonzó erő egy dipól kölcsönhatás. A hidrogénatomok kötődnek az erősen elektronegatív oxigénatomhoz (amely két magányos elektronpárral is rendelkezik, ami nagyon poláris kötést eredményez). Az egyik molekula részlegesen pozitív hidrogénatomját ezután vonzza a közeli vízmolekula oxigénatomja (lásd az alábbi ábrát).
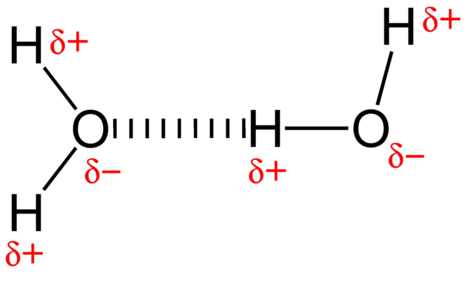
a hidrogénkötés egy intermolekuláris vonzó erő, amelyben a hidrogénatom, amely kovalensen kötődik egy kis, erősen elektronegatív atomhoz, egy szomszédos molekula atomján lévő magányos elektronpárhoz vonzódik. A hidrogénkötések nagyon erősek a többi dipól kölcsönhatáshoz képest. Egy tipikus hidrogénkötés erőssége körülbelül \(5\%\) a kovalens kötésé.
hidrogénkötés csak olyan molekulákban fordul elő, ahol a hidrogén kovalensen kötődik a három elem egyikéhez: fluor, oxigén vagy nitrogén. Ez a három elem annyira elektronegatív, hogy a kovalens kötésben az elektronsűrűség nagy részét kivonják hidrogénnel, így a \(\ce{H}\) atom nagyon elektronhiányos marad. A\ (\ce{H}\) atom szinte csupasz protonként működik, így nagyon vonzza a közeli atom magányos elektronpárja.
a vízben előforduló hidrogénkötés szokatlan, de nagyon fontos tulajdonságokhoz vezet. A legtöbb molekuláris vegyület, amelynek tömege hasonló a vízhez, szobahőmérsékleten gáz. Az erős hidrogénkötések miatt a vízmolekulák folyékony állapotban kondenzálódhatnak. Az alábbi ábra azt mutatja, hogy a hajlított forma és a molekulánként két hidrogénatom lehetővé teszi, hogy minden vízmolekula hidrogénkötést tudjon kötni két másik molekulával.
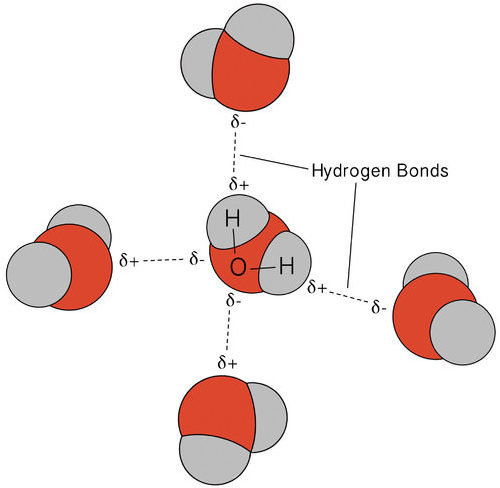
folyékony állapotban a víz hidrogénkötései megszakadhatnak és megreformálódhatnak, amikor a molekulák egyik helyről a másikra áramlanak. Amikor a víz lehűl, a molekulák lassulni kezdenek. Végül, amikor a víz jéggé fagy, a hidrogénkötések állandóvá válnak, és nagyon specifikus hálózatot alkotnak (lásd az alábbi ábrát).
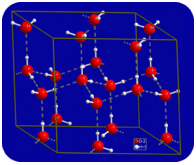
a molekulák hajlított alakja résekhez vezet a jég hidrogénkötő hálózatában. A jégnek az a nagyon szokatlan tulajdonsága, hogy szilárd állapota kevésbé sűrű, mint folyékony állapota. Jég úszik a vízben. Gyakorlatilag minden más anyag sűrűbb szilárd állapotban, mint folyékony állapotban. A hidrogénkötések nagyon fontos biológiai szerepet játszanak a fehérjék és a nukleinsavak fizikai szerkezetében.
