水素結合
水分子間の引力は双極子相互作用である。 水素原子は非常に電気陰性の酸素原子に結合している(これはまた、非常に極性結合のために作る電子の二つの孤立したペアセットを持っている)。 1つの分子の部分的に肯定的な水素原子は近くの水分子の酸素原子にそれから引き付けられます(図を下で見て下さい)。P>
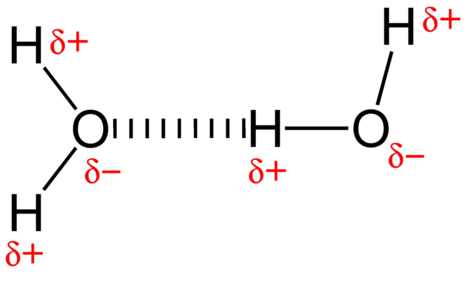
水素結合は、小さな、高度に電気陰性原子に共有結合している水素原子が隣接する分子内の原子上の孤立電子対に引 水素結合は他の双極子相互作用と比較して非常に強い。 典型的な水素結合の強さは、共有結合の強さの約\(5\%\)である。水素結合は、水素がフッ素、酸素、または窒素の三つの元素のいずれかに共有結合している分子でのみ起こります。
水素結合は、水素がフッ素、酸素、または窒素の三つの元素のいずれかに共有結合している分子でのみ起こります。 これらの3つの元素は非常に電気陰性であるため、水素との共有結合における電子密度の大部分を撤回し、\(\ce{H}\)原子は非常に電子不足しています。 \(\Ce{H}\)原子はほぼ裸の陽子として作用し、近くの原子上の孤立電子対電子に非常に引き寄せられます。
水の中で起こる水素結合は、いくつかの珍しい、しかし非常に重要な特性につながります。
水の中で起こる水素結合は、いくつかの珍しい、しかし 水に類似した質量を有するほとんどの分子化合物は、室温でのガスである。 強い水素結合のために、水分子は液体状態で凝縮したままでいることができます。 下の図は、曲がった形状と分子あたりの二つの水素原子が、各水分子が他の二つの分子に水素結合することができるようにする方法を示しています。
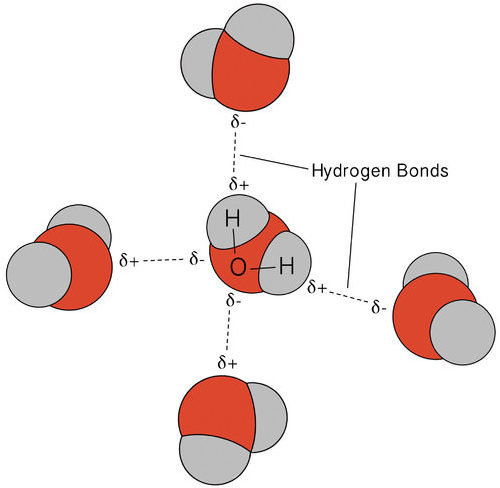
液体状態では、水の水素結合が壊れ、分子がある場所から別の場所に流れるように改革することができます。 水が冷却されると、分子は減速し始める。 最終的に、水が氷に凍結されると、水素結合は永久的になり、非常に特定のネットワークを形成します(下の図を参照)。P>
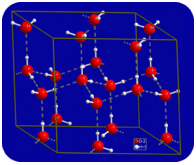
分子の曲がった形状は、氷の水素結合ネットワークのギャップにつながります。 氷は、その固体状態がその液体状態よりも密度が低いという非常に珍しい性質を有する。 氷は水に浮かぶ。 事実上、他のすべての物質は、固体状態では液体状態よりも密度が高い。 水素結合は、タンパク質や核酸の物理的構造において非常に重要な生物学的役割を果たしています。
