formula empirică a unui compus vă spune că cel mai mic raport de număr întreg dintre elementele care alcătuiesc compusul menționat este.
Acest lucru înseamnă că vă puteți gândi la formula empirică ca fiind un fel de bloc de construcție pentru moleculă.
privind formula empirică pentru compusul dvs., # ” CH ” _2 „O”#, știți că aveți nevoie de
- un atom de carbon
- doi atomi de hidrogen
- un atom de oxigen
pentru a începe construirea acestei molecule. Treaba ta acum este de a determina cât de multe dintre aceste blocuri sunt necesare pentru a obține formula moleculară a compusului.
observați că cunoașteți masa molară a compusului. Masa molară vă spune care este masa totală a unui mol al compusului.
aceasta înseamnă că, dacă vă dați seama de masa molară a unui bloc de construcție, puteți utiliza masa molară totală a moleculei pentru a determina de câte blocuri de clădiri aveți nevoie.
pentru a obține masa molară a formulei empirice, utilizați masele molare ale fiecărui atom pe care îl conține
#overbrace(1 xx „12.011 g/mol”)^(culoare(albastru)(„un mol de C”)) + overbrace(2 xx „1.00794 g/mol”)^(culoare(verde)(„doi moli de H”))) + overbrace(1 XX „15.9994 g / mol”)^(culoare(roșu) („un mol de o”)) = „30.03 g/mol”#
deci, un bloc de construcție are o masă molară de #”30,03 g/mol”#, iar masa molară a moleculei este #”180,2 g / mol”#. Aceasta înseamnă că aveți
# 30.03 culoare(Roșu)(anulare(culoare(Negru)(„g/mol”))) * culoare(Albastru)(n) = 180.2 culoare(Roșu)(anulare(culoare(Negru)(„g/mol”)))#
#culoare(Albastru)(n) = 180.2/30.03 = 6.0007 ~~ 6#
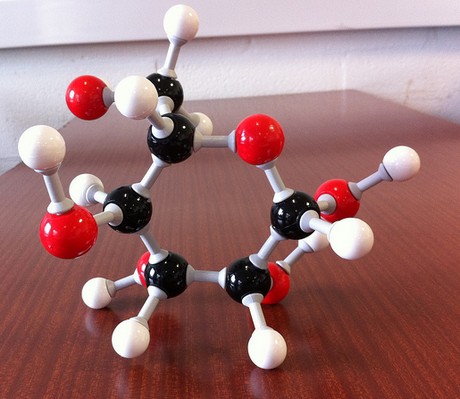
The molecular formula of the compound will thus be
#(„CH”_2″O”)_color(blue)(6) implies „C”_6″H”_12″O”_6 -># glucose