empirický vzorec sloučeniny vám říká nejmenší poměr celého čísla mezi prvky, které tvoří uvedenou sloučeninu.
to znamená, že můžete uvažovat o empirickém vzorci jako o jakémsi stavebním bloku molekuly.
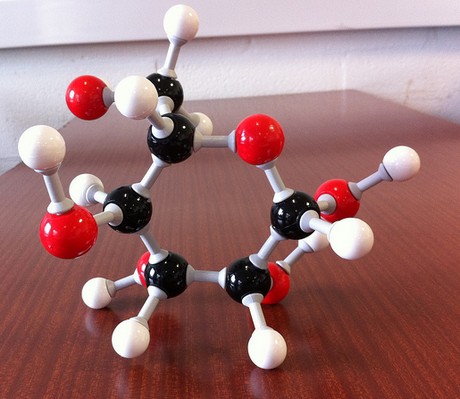
při Pohledu na empirický vzorec sloučeniny, #“CH“_2″O“#, víte, že potřebujete
- jeden atom uhlíku
- dva atomy vodíku,
- jeden atom kyslíku
aby bylo možné začít budování této molekuly. Vaším úkolem je nyní určit, kolik z těchto stavebních bloků je zapotřebí k získání molekulárního vzorce sloučeniny.
Všimněte si, že znáte molární hmotnost sloučeniny. Molární hmotnost vám řekne, jaká je celková hmotnost jednoho molu sloučeniny.
to znamená, že pokud zjistíte molární hmotnost stavebního bloku, můžete pomocí celkové molární hmotnosti molekuly určit, kolik bloků budov potřebujete.
získat molární hmotnost empirický vzorec, pomocí molární hmotnosti každý atom obsahuje
#overbrace(1 xx „výše 12.011 g/mol“)^(barva(modrá)(„jeden mol C“)) + overbrace(2 xx „1.00794 g/mol“)^(color(zelená)(„dva moly H“)) + overbrace(1 xx „15.9994 g/mol“)^(barva(červená)(„jeden mol O“)) = „30.03 g/mol“#
Tak, jeden stavební blok má molární hmotnost #“30.03 g/mol“#, a molární hmotnost molekuly je #“180.2 g/mol“#. To znamená, že máte
# 30.03 barva(červená)(zrušit(barva(černá)(„g/mol“))) * barevné(modrá)(n) = 180.2 barva(červená)(zrušit(barva(černá)(„g/mol“)))#
#barva(modrá)(n) = 180.2/30.03 = 6.0007 ~~ 6#
The molecular formula of the compound will thus be
#(„CH“_2″O“)_color(blue)(6) implies „C“_6″H“_12″O“_6 -># glucose