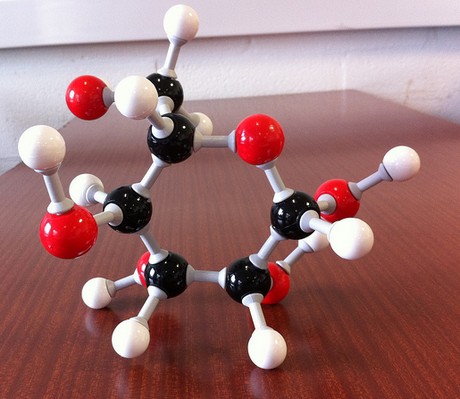
a fórmula empírica de um composto diz que a menor razão de número inteiro entre os elementos que compõem esse composto é.
isto significa que você pode pensar sobre a fórmula empírica como sendo uma espécie de bloco de construção para a molécula.
Olhando para a fórmula empírica para o seu composto, #”CH”_2″O”#, você sabe que você precisa
- um átomo de carbono
- dois átomos de hidrogênio
- um átomo de oxigênio
para iniciar a construção desta molécula. O seu trabalho agora é determinar quantos destes blocos de construção são necessários para obter a fórmula molecular do composto.
Notice that you know the molar mass of the compound. A massa molar diz-lhe Qual é a massa total de um mole do composto.isto significa que se você descobrir a massa molar de um bloco de construção, você pode usar a massa molar total da molécula para determinar quantos blocos de edifícios você precisa.
Para obter a massa molar da fórmula empírica, use as massas molares de cada átomo contém
#overbrace(1 xx “12.011 g/mol”)^(cor(azul)(“um mol de C”)) + overbrace(2 xx “1.00794 g/mol”)^(cor(verde)(“dois moles de H”)) + overbrace(1 xx “15.9994 g/mol”)^(cor(vermelho)(“uma mole de R”)) = “30.03 g/mol,”#
Então, um bloco de construção tem uma massa molar de #”30.03 g/mol”#, e a massa molar da molécula é #”180.2 g/mol”#. Isso significa que você tem
# 30.03 cor(vermelho)(cancelar(de cor(preto)(“g/mol”))) * cor(azul)(n) = 180.2 cor(vermelho)(cancelar(de cor(preto)(“g/mol”)))#
#cor(azul)(n) = 180.2/30.03 = 6.0007 ~~ 6#
The molecular formula of the compound will thus be
#(“CH”_2″O”)_color(blue)(6) implies “C”_6″H”_12″O”_6 -># glucose