wzór empiryczny związku mówi, że najmniejszy stosunek liczby całkowitej między elementami składowymi tego związku jest.
oznacza to, że możesz myśleć o empirycznym wzorze jako o czymś w rodzaju budulca dla cząsteczki.
patrząc na wzór empiryczny dla twojego związku, #”CH”_2″O”#, wiesz, że potrzebujesz
- jeden atom węgla
- dwa atomy wodoru
- jeden atom tlenu
aby rozpocząć budowę tej cząsteczki. Twoim zadaniem jest teraz określenie, ile z tych budulców jest potrzebnych do uzyskania wzoru cząsteczkowego związku.
zauważ, że znasz masę molową związku. Masa molowa mówi, jaka jest całkowita masa jednego mola związku.
oznacza to, że jeśli obliczysz masę molową budulca, możesz użyć całkowitej masy molowej cząsteczki, aby określić, ile bloków budynków potrzebujesz.
aby uzyskać masę molową wzoru empirycznego, użyj mas molowych każdego atomu, który zawiera
#overbrace(1 xx „12,011 g/mol”)^(kolor(niebieski)(„jeden mol C”)) + overbrace(2 xx „1,00794 g/mol”)^(kolor(zielony)(„dwa Mole H”)) + overbrace(1 XX „15,9994 g/mol”)^(Kolor(Czerwony)(„jeden mol o”)) = „30.03 g/mol”#
tak więc, jeden budulec ma masę molową #”30,03 g/mol”#, A Masa molowa cząsteczki wynosi #”180,2 g / mol”#. Oznacza to, że masz
# 30.03 color(red)(cancel(color(black)(„g/mol”)) * color(blue) (n) = 180.2 color(red) (cancel(color(black) („g/mol”))#
#color(blue) (n) = 180.2/30.03 = 6.0007 ~~ 6#
The molecular formula of the compound will thus be
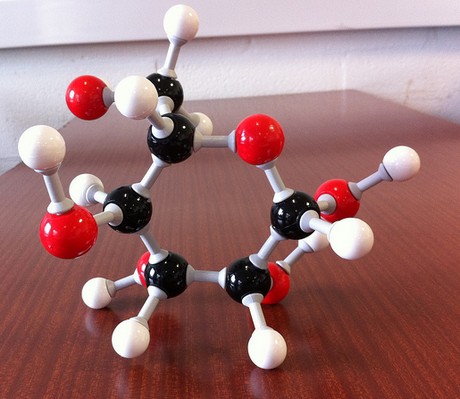
#(„CH”_2″O”)_color(blue)(6) implies „C”_6″H”_12″O”_6 -># glucose