Le protocole COC ™ in Breast Cancer
Ce document est un résumé de la justification et de certaines des preuves scientifiques actuelles qui soutiennent l’utilisation des médicaments du protocole COC aux côtés des traitements standard de soins pour le cancer du sein. Nous comprenons que le cancer est une maladie très personnelle et que chaque patient doit relever un ensemble unique de défis. Pour plus d’informations sur votre situation personnelle, veuillez contacter la clinique d’oncologie Care au 800-392-1353 aux États-Unis, ou visitez le site Web à https://careoncology.com.
Si vous débutez en oncologie de soins, veuillez noter ce qui suit:
- Vous n’avez pas besoin de voyager. Vous pouvez rencontrer notre équipe d’oncologues et d’infirmières en oncologie grâce à une vidéo sécurisée pour un soutien continu.
- Les médicaments du protocole d’appoint Care Oncology sont expédiés directement à votre domicile depuis nos pharmacies partenaires américaines et peuvent être utilisés parallèlement à votre traitement de soins standard.
- Nous sommes incroyablement fiers d’annoncer que nous avons réussi le processus de validation extrêmement rigoureux de l’Institut de validation de l’analyse des données, des revendications de résultats et du calcul de la valeur. Nous avons travaillé dur pour en arriver là. Très tôt, nous avons reconnu l’énorme valeur d’un programme de médicaments réutilisés offert de manière responsable aux patients atteints de cancer, mais il n’était pas offert à grande échelle. Il y a quatre ans, nous avons entrepris de changer cela en sachant que c’était un marathon, pas un sprint.
Le protocole COC et le cancer du sein : Points clés
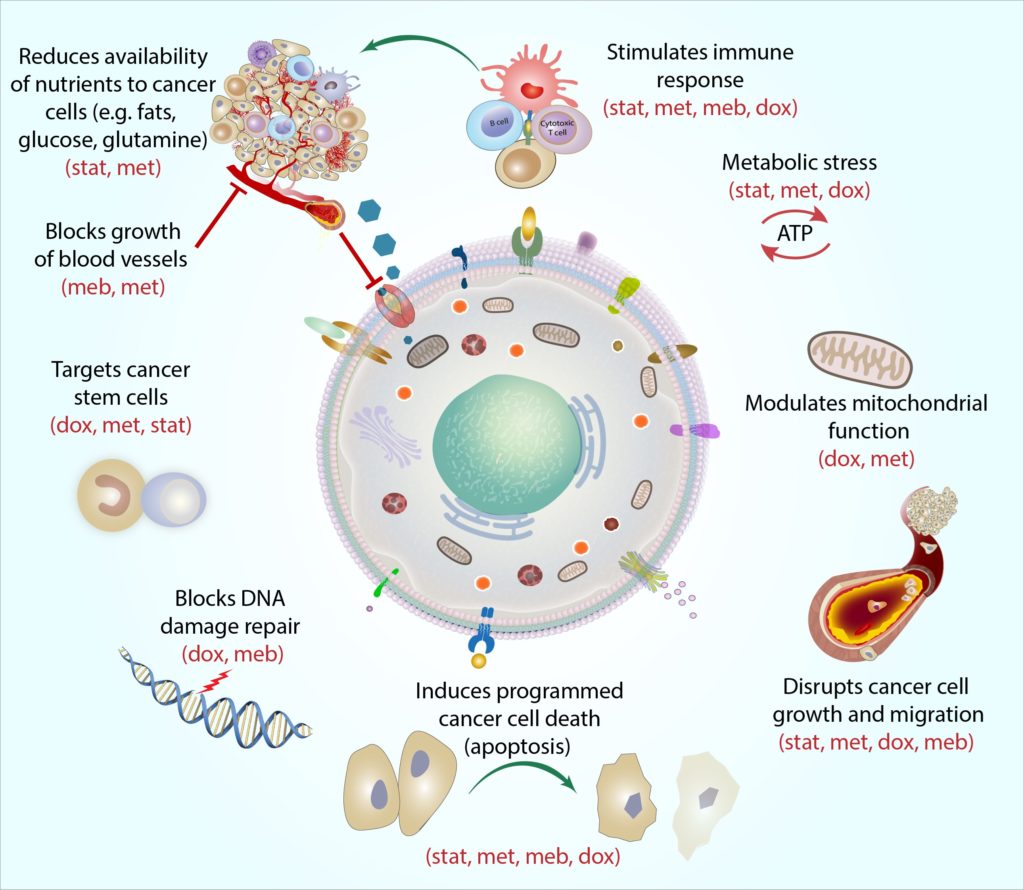
- Le protocole COC Le COCProtocol est une combinaison de quatre médicaments couramment prescrits (atorvastatine, metformine, mébendazole et doxycycline) susceptibles de cibler le cancer du sein et d’aider à améliorer l’efficacité des thérapies anticancéreuses standard.
- Un certain nombre d’études observationnelles ont établi un lien entre l’utilisation de la metformine ou des statines et l’amélioration des résultats chez les patientes atteintes d’un cancer du sein.
- Des études en laboratoire sur des cellules cancéreuses du sein cultivées dans des boîtes montrent que la metformine et les statines peuvent directement cibler et endommager les cellules cancéreuses du sein – les affaiblissant et les rendant plus vulnérables aux traitements standard.
- Les résultats d’essais cliniques de petite « fenêtre d’opportunité » chez des patientes atteintes d’un cancer du sein opérationnel montrent généralement que la prise de metformine ou de statine avant la chirurgie peut entraîner des modifications potentiellement positives des marqueurs moléculaires du cancer, y compris ceux qui régulent la croissance et la division des cellules cancéreuses du sein. D’autres essais visant à déterminer si la metformine ou les statines peuvent affecter la réponse à la maladie sont en cours.
- La Doxycycline peut bloquer la croissance des cellules souches du cancer du sein HER2 positives et triple négatives incubées dans des boîtes en laboratoire et a aidé à améliorer les changements liés à la résistance induits par la chimiothérapie standard paclitaxel.
- La Doxycycline vient d’atteindre des essais cliniques précoces chez des patientes atteintes d’un cancer du sein. Les résultats de la première petite étude montrent que les patientes atteintes d’un cancer du sein à un stade précoce qui ont pris de la doxycycline pendant seulement 14 jours avant la chirurgie ont réduit les niveaux de marqueurs moléculaires de la présence de cellules souches cancéreuses d’environ 40% en moyenne. Des effets bénéfiques ont été notés pour tous les patients traités sauf un (8/9).
- Le mébendazolepeut ralentir la croissance et la division des cellules cancéreuses du sein cultivées en laboratoire, y compris les cellules cancéreuses du sein qui sont plus résistantes à la chimiothérapie. Plusdes études humaines sont nécessaires.
Le protocole COC et le cancer du sein: Preuves publiées
Le protocole TheCOC est une combinaison de quatre médicaments couramment prescrits, chacun présentant des preuves d’une activité anticancéreuse basée sur le métabolisme et des profils de sécurité bien compris. Ces médicaments sont: la metformine, l’atorvastatine, la doxycycline et le mébendazole. Certaines des études qui soutiennent l’utilisation du protocole theCOC comme traitement d’appoint aux côtés des traitements standard actuels du cancer du sein sont présentées ci-dessous. Ces données proviennent principalement d’études en laboratoire, d’études épidémiologiques de grande envergure (qui examinent les liens entre la prise de médicaments et les résultats du cancer du sein chez des groupes d’individus) et d’essais cliniques de début de cycle.
Vous remarquerez peut-être que bon nombre des études ci-dessous se concentrent uniquement sur les protocoles de COC individuels. Nous sommes les premiers à concevoir une thérapie d’appoint qui combine quatre. Nous croyons que la combinaison de ces médicaments permettra d’obtenir les meilleurs résultats, et notre propre programme de recherche, appelé MÉTRIQUES, produit déjà plus de preuves nécessaires pour le démontrer. Vous pouvez en savoir plus sur les raisons pour lesquelles nous croyons que ces médicaments fonctionnent si bien ensemble pour aider à cibler le cancer, et sur le programme de mesure lui-même, dans d’autres sections ci-dessous.
Metformine et cancer du sein
L’utilisation de la metformine liée aux avantages potentiels du cancer du sein
De nombreuses études observationnelles fournissent maintenant des preuves à l’appui de l’utilisation de la metformine dans le cancer du sein. La metformine est autorisée à traiter le diabète de type 2, et des études observationnelles menées auprès de groupes de patientes diabétiques tendent à montrer que celles qui prennent de la metformine ont de meilleures chances d’obtenir un meilleur résultat si elles développent un cancer du sein (Aksoy et al., 2013; El-Benhawy et El-Sheredy, 2014; Sonnenblick et al., 2017).L’utilisation de la metformine a été liée à une amélioration de la survie chez les patientes atteintes d’un cancer du sein (Kim et al., 2015; Xuet al., 2015), une réponse améliorée au traitement du cancer du sein (Jiralerspong et al., 2009), et moins de risques de propagation du cancer du sein et de lapse (Chen et al., 2017; Jacob et coll., 2016).
Il est évident qu’une partie des effets bénéfiques de la metformine trouvés dans ces études est due à la capacité de la metformine à améliorer le diabète et / ou le poids d’une patiente en réduisant les niveaux de glucose, ce qui peut aider à réduire le risque de développer un cancer du sein, et améliorer la santé et la capacité d’une patiente à lutter contre le cancer du sein si elle en a (Hatoum et McGowan, 2015). Mais les études de laboratoire montrent également que la metformine estfaire plus que cela. En fait, la metformine peut agir activement directement contre les cellules cancéreuses du sein, réduisant leur capacité à absorber et à utiliser de l’énergie et bloquant leur capacité à croître, à se propager, à survivre et à rechuter (Alimova et al., 2009; Hadad et coll., 2014; Orecchioni et coll., 2015).
Différents types de cancer du sein nécessitent différents traitements. Le Trastuzumab, par exemple, est spécifiquement utilisé pour traiter le cancer du sein positif au récepteur du facteur de croissance épidermique humain 2 (HER2). Le tamoxifène est efficace contre le cancer du sein positif au récepteur des œstrogènes (ER). Fait important, les études sur les cellules cancéreuses en laboratoire démontrent que la metformine a une activité anticancéreuse contre de nombreux types de cellules cancéreuses du sein, y compris ER positif (Giles et al., 2018), HER2 positif (Chen et al., 2013), et des sous-types potentiellement plus difficiles à traiter tels que les cellules cancéreuses à triple négatif (Deng et al., 2012; Vazquez-Martin et coll., 2011; Wahdan-Alaswad et al., 2014).Cela signifie que la metformine a le potentiel de fonctionner efficacement aux côtés des traitements standard pour le cancer du sein, quel que soit le sous-type de cancer.
Metformintargets cellules souches du cancer du sein
Il a également été démontré que la Metformine cible les cellules souches du cancer du sein (Bao et al., 2014; Cufiet al., 2012; Hirsch et coll., 2009).Cette activité contre les cellules souches du cancer du sein, ainsi que sa capacité à cibler différents sous-types de cancer du sein, aident à expliquer pourquoi les études de labo montrent qu’il peut fonctionner en combinaison avec un certain nombre de traitements standard, y compris le trastuzumab (Cufi et al., 2012), le tamoxifène (Ma et al., 2014), et des agents de chimiothérapie standard (Iliopoulos et al.,2011). Des études sur des animaux et des cellules montrent que la metformine aide à améliorer l’efficacité des traitements standard (Bradford et Khan, 2013; Liu et al., 2012; Zhang et coll., 2014) et retarde également la rechute des cancers traités avec ces thérapies (Iliopoulos et al.,2011).
En outre, des études en laboratoire montrent également que la metformine peut également aider à empêcher les cellules du cancer du sein de devenir résistantes à la chimiothérapie et à améliorer la sensibilité des cellules cancéreuses déjà résistantes au traitement (Davies et al., 2017).
La metformine Améliore les marqueurs du cancer du sein dans des études cliniques précoces
Compte tenu de la grande quantité de données à l’appui de la metformine dans le cancer du sein générées par des études d’observation et de laboratoire, divers essais cliniques sur la metformine dans le cancer du sein sont en cours (Camacho et al., 2015).Dans l’ensemble, les analyses collectives des résultats de ces essais à un stade précoce (méta-analyse) commencent à suggérer un effet généralement positif lorsquela métformine est ajoutée aux traitements anticancéreux standard (Rahmani et al., 2019; Zhang et coll., 2019b).
Un certain nombre d’essais « fenêtre d’opportunité » cherchent à déterminer si la prise de metforminfor environ deux semaines avant la chirurgie peut aider à améliorer les marqueurs moléculaires de la maladie chez les patientes atteintes d’un cancer du sein à un stade précoce opérable. Les résultats de ces études suggèrent généralement que la prise de metformine peut entraîner des modifications potentiellement positives des marqueurs moléculaires du cancer, y compris ceux qui régulent la croissance et la division des cellules cancéreuses du sein (Bonanni et al., 2012; Cazzaniga et coll., 2013; Hadad et coll., 2011; Kalinsky et coll., 2014; Niraula etal., 2012), ainsi que potentiellement améliorer la régulation des hormones et d’autres facteurs chez certains patients (Kalinsky et al., 2014; Niraula et coll., 2012). Ces études aident maintenant les scientifiques à comprendre exactement comment et quand la metformine pourrait aider les patientes atteintes d’un cancer du sein (Bonanni etal., 2012; DeCensi et coll., 2014, 2015; Rahmani et coll., 2019).
Les essais « néoadjuvants » de Phase2 sont généralement des essais plus longs et plus complexes qui examinent la metformine parallèlement à des traitements standard pour traiter différents types de cancer du sein. L’objectif de ces essais est d’établir si la métformine contribue réellement à améliorer l’efficacité des traitements standard, suggèrent les études aslab (Kim et al., 2014). Dansune étude récente (l’étude METTEN) (Martin-Castillo etal., 2018), chez les femmes ayant un cancer du sein à un stade précoce HER2 positif, un plus grand nombre de patientes prenant de la metformine ont bien répondu à la chimiothérapie / au traitement ciblé (65,5%) par rapport aux patientes ne prenant pas de metformine (58,6%). Cette différence n’était pas statistiquement significative; ce qui signifie que ce résultat pouvait être atteint par hasard. Cependant, les essais de phase 2 sont généralement sous-alimentés pour atteindre une signification statistique de cette manière, et les chercheurs ont appelé à une progression vers des essais de phase 3 plus importants qui peuvent être correctement conçus pour déterminer à quel point cet effet est réel (Martin-Castillo etal., 2018). Des résultats potentiellement encourageants d’autres tests de phase 2, comme celui chez des personnes en surpoids atteintes d’un cancer du sein métastatique, ont également été rapportés (Yam et al.,2019). Il convient également de noter que, comme prévu, pas tousles essais sur le cancer de la métformine ont rapporté des résultats positifs. Par exemple, d’autres essais de phase 2 ont montré que la metformine avec un traitement standard n’avait pas de réelle différence par rapport au traitement standard seul dans certaines circonstances (Mark et al., 2019; Nanni et coll., 2019). Nous croyons que la métformine sera la plus efficace dans tous les contextes lorsqu’elle est administrée en association avec d’autres médicaments anti-métaboliques.
De plus grandes études sont nécessaires pour aider à résoudre ces problèmes, et un essai de phase 3 est maintenant en cours pour étudier la metformine dans le cancer du sein. Bien que l’essai ne soit pas censé être terminé avant 2020, les premiers résultats des 6 premiers mois de l’essai ont montré que les patientes qui ont commencé à prendre de la metformine immédiatement après l’achèvement de la chirurgie et des cycles de chimiothérapie standard avaient des changements favorables dans un marqueur moléculaire du cancer du sein (Dowling et al., 2018), et des facteurs métaboliques améliorés (Goodwin et al., 2015).
Les statines et le cancer du sein
Des études d’observation lient les statines à de meilleurs résultats pour le cancer du sein
Les statines sont généralement administrées pour aider à gérer les maladies cardiovasculaires. Cependant, des études d’observation sur de grands groupes de personnes prenant des statines ont également révélé que les personnes atteintes d’un cancer du sein qui prennent des statines peuvent également avoir réduit le risque de récurrence de leur cancer après le traitement, par rapport aux patientes qui ne prennent pas de statines (Ahern et al., 2014; Manthravadi et coll., 2016). Par exemple, lors d’une étude sur près de 2000 survivantes d’un cancer du sein, celles qui ont commencé à prendre des douleurs dans les trois ans suivant le diagnostic avaient moins de chances de voir leur cancer revenir (Kwan et al., 2008). Dans une autre étude, seulement 6 mois d’utilisation de statines après le diagnostic ont été liés à des taux améliorés de rechute (Chae et al., 2011).
Il est important de noter que l’effet bénéfique des statines dans ces études et d’autres études était plus fortement lié à des statines lipophiles plus liposolubles (comme l’atorvastatine). Dans certaines études en laboratoire, il a également été démontré que les statines lipophiles avaient des effets supérieurs anti‑cancéreux au niveau cellulaire par rapport aux statines moins liposolubles (Liu et al., 2017).
Des études d’observation établissent également un lien entre l’utilisation de statines et une meilleure réponse de la maladie au traitement et à la survie chez les patientes atteintes d’un cancer du sein, même chez les patientes présentant des types de cancer du sein qui peuvent être plus agressifs (Manthravadi et al., 2016; Murtola et coll., 2014; Zhong et coll., 2015). Par exemple, dans une étude menée chez des patientes atteintes d’un cancer inflammatoire du sein, les patientes prenant de l’atorvastatine pendant qu’elles étaient traitées pour un cancer avaient une période de temps plus longue avant que leur maladie ne progresse, comparativement à celles qui ne prenaient pas de statine (Brewer et al., 2013).
Statinstarget des cellules cancéreuses du sein
Les statines, en particulier les statines lipophiles liposolubles comme l’atorvastatine, réduisent la croissance et la division des cellules cancéreuses du sein et augmentent la mort des cellules cancéreuses du sein dans les études de laboratoire
Association allemande du diabète », « page »: « 47-48 », « volume »: « 111 », « issue »: « 1 », « source »: « PubMed », « résumé »: « L’effet de cinq statines l’atorvastatine, la fluvastatine, la lovastatine, la pravastatine et la simvastatine ont été étudiées sur la prolifération de la lignée cellulaire du cancer du sein humain MCF-7. Toutes les statines, à l’exception de la pravastatine, ont pu inhiber la prolifération cellulaire jusqu’à 90% à une concentration de 50 micro M. Entre les statines efficaces, aucune différence significative n’a été observée indiquant un effet spécifique à la classe. Ces données suggèrent que les statines peuvent avoir une importance clinique dans la prévention primaire du cancer du sein humain au-delà de leur effet hypocholestérolémiant. Cependant, une preuve clinique doit être attendue avant de tirer d’autres conclusions. », « DOI »: « 10.1055/s-2003-37501 », « ISSN »: « 0947-7349 », « note »: « PMID: 12605351 », « journalAbbreviation »: « Exp. Clin. Endocrinol.Diabetes », »language »: »eng », « author »:, « issued »: {« date-parts »:]}}}], « schema »: »https://github.com/citation-style-language/schema/raw/master/csl-citation.json »} (Alarcon Martinez etal., 2018; Mück et coll., 2004; Seeger et coll., 2003).Des études montrent également que les statines peuvent potentiellement bloquer le caractère invasif des cellules du cancer du sein en laboratoire, suggérant qu’elles peuvent également aider à ralentir la propagation du cancer dans d’autres parties du corps (Kanugula et al., 2014; Wolfe et coll., 2015). Dans un modèle murin de cancer du sein métastatique, le statintraitement a retardé la croissance du cancer qui s’était déjà propagé jusqu’à 80%, avec une activité bénéfique notée dans la semaine suivant le début du traitement (Vintonenko et al.,2012).
D’autres études montrent également que les statines peuvent aider à sensibiliser les cellules cancéreuses du sein aux traitements de radiothérapie et de chimiothérapie standard (Kozar et al., 2004; Van Wyhe et coll., 2017). Une étude a révélé que la simvastatine pourrait sensibiliser les cellules cancéreuses du sein à triple négatif ou inflammatoires à la radiothérapie en laboratoire. La même étude a ensuite observé chez une population de patientsque les femmes atteintes d’un cancer du sein inflammatoire qui prenaient des statines pendant leur traitement avaient moins de chances que leur cancer revienne dans les 3 ans (Lacerda et al., 2014).
De même que la metformine, les statines peuvent produire ces effets anticancéreux sur différents types de cancer du sein, y compris le cancer du sein ER positif, HER2 positif et triple négatif. En fait, certaines études de laboratoire montrent que les statines sont particulièrement efficaces contre les cellules cancéreuses du sein à triple négatif (Campbell et al., 2006; Yao et coll., 2017).
Des essais cliniques sur les statines dans le cancer du sein sont en cours
Des essais cliniques à quelques stades montrent maintenant des résultats très positifs en termes de statines dans le cancer du sein. Des essais de « fenêtre d’opportunité » de phase précoce ont examiné si les statines précoces et préopératoires peuvent aider à améliorer les marqueurs moléculaires de la maladie chez les patients atteints d’une maladie opérable. Jusqu’à présent, ces études ont montré des profils moléculaires améliorés du cancer chez les patients traités par statine, suggérant que l’atorvastatine et d’autres statines dans ce contexte pourraient avoir des effets bénéfiques sur la croissance et la division des cellules cancéreuses et la mort cellulaire, même chez les femmes atteintes de tumeurs plus agressives de haut grade (Bjarnadottir et al., 2013, 2015; Feldt et coll., 2015; Garwood et coll., 2010).
Sur la base de ces résultats prometteurs, un certain nombre d’études de phase 2 portant sur des statines jointives pour divers types de cancer du sein, y compris le cancer du sein triple négatif, sont en cours. Ces études devraient aiderétablir comment les statines peuvent aider les patientes atteintes d’un cancer du sein.
Le mébendazole et le cancer du sein
Intérêt pour le mébendazolecomme un traitement anticancéreux potentiel est principalement basé sur des études mécanistiques prometteuses et des rapports convaincants d’études de cas chez des patients atteints de cancer (Nygren et Larsson, 2014; Pantziarka et al., 2014).
On pense que le mébendazole tue en partie les cellules cancéreuses en perturbant des structures spéciales à l’intérieur de la cellule, appelées microtubules (Pantziarka et al.,2014). Il fonctionne de manière similaire à la vincristine, médicament d’achémothérapie actuellement utilisé pour le traitement de certains types de cancer, y compris le cancer du sein à un stade avancé (De Witt et al., 2017).
Des études sur des cellules cancéreuses du sein cultivées en laboratoire montrent que le mébendazole et les médicaments apparentés de la même classe (appelés benzimidazoles) peuvent ralentir la croissance et la division de plusieurs types différents de cellules cancéreuses du sein, y compris des cellules résistantes à la chimiothérapie (Coyne et al., 2013; Hou et coll., 2015; Mukhopadhyay et coll., 2002). Dans une étude, le mébendazole a considérablement réduit la survie des cellules cancéreuses du sein résistantes à la chimiothérapie jusqu’à 63,1% (Coyne et al., 2013).Des études ont également démontré une activité anticancéreuse robuste des benzimidazoles contre le cancer du sein triple négatif (Hou et al., 2015; Zhang et coll., 2015). Fait important, dans une étude, un benzimidazole était également censé cibler directement les cellules souches du cancer du sein (Hou et al., 2015).
Des preuves émergentesdans les laboratoires suggèrent également que les benzimidazoles peuvent améliorer l’activité des traitements standard du cancer du sein tels que la doxorubicine et le fluorouracile (Hou et al., 2015). Dans une étude en laboratoire, le mébendazole a augmenté l’efficacité de la radiothérapie sur les cellules cancéreuses du sein triples négatives et a empêché la résistance au traitement de se développer (Zhang et al., 2019a). En outre, une série d’études utilisant des cellules cancéreuses du sein positives ER / HER2 résistantes à la chimiothérapie cultivées en laboratoire ont constamment montré que le mébendazole réduisait non seulement la survie des cellules cancéreuses, mais qu’il contribuait également à compléter et à améliorer l’activité de formes ciblées spécialement développées de médicaments de chimiothérapie du cancer du sein épirubicine et gemcitabine (Coyne et al., 2014,2012, 2013).
Doxycycline et cancer du sein
En tant qu’antibiotique efficace, la doxycycline possède également d’autres propriétés extrêmement précieuses, notamment une activité anti-inflammatoire et anticancéreuse. Cela donne à la doxycycline un potentiel thérapeutique réel dans le traitement d’une gamme d’autres maladies, y compris le cancer (Bahrami et al., 2012).
Des études en laboratoire et des études sur des animaux ont montré depuis longtemps que la doxycycline peut bloquer la croissance, la division et le mouvement des cellules du cancer du sein (Duivenvoorden et al., 2002; Fife et Sledge, 1995, 1998).Des études plus récentes montrent également que la doxycycline peut empêcher les cellules cancéreuses de réparer leur ADN lorsqu’il est endommagé, par exemple, par la chimiothérapie (Peiris-Pagès et al.,2015). En effet, des études en laboratoire montrent que la doxycycline peut aider à améliorer l’efficacité de l’activité de chimiothérapie contre les cellules cancéreuses du sein (Foroodi et al., 2009; Lamb et coll., 2015a).
Plus récemment, l’accent a été mis sur la compréhension de la façon dont la doxycycline peut bloquer la croissance des cellules souches du cancer du sein (Ozsvari et al., 2017; Zhang et coll., 2017). Une étude récente d’Avery sur des cellules cultivées en laboratoire a montré que la doxycycline peut bloquer la croissance des cellules souches du cancer du sein HER2 positives et triple négatives, et a aidé à améliorer les changements liés à la résistance induits par le paclitaxel de chimiothérapie standard (Lin et al.,2018). Dans une étude de laboratoire différente, une approche combinatoire comprenant la doxycycline a très efficacement éradiqué les cellules souches du cancer du sein (Fiorillo et al., 2019).
La Doxycycline vient d’atteindre des essais cliniques précoces chez des patientes atteintes d’un cancer du sein. Les résultats de la première petite étude, publiée en octobre 2018, montrent que les patientes atteintes d’un cancer du sein à un stade précoce qui ont pris de la doxycycline pendant seulement 14 jours avant la chirurgie ont réduit les niveaux de marqueurs moléculaires de la présence de cellules souches cancéreuses d’environ 40% en moyenne. Des effets bénéfiques ont été observés chez tous les patients traités sauf un (8/9) (Scatena et al., 2018).Des essais cliniques plus importants sont en cours.
Nos propres preuves : L’étude des MÉTRIQUES
Qu’est-ce que les MÉTRIQUES?
METRICS est notre propre programme de recherche interne. On en sait déjà beaucoup sur la sécurité etl’efficacité des médicaments du protocole COC dans le cancer. Mais il est également de notre responsabilité de reconnaître que nous n’avons pas toutes les réponses, et que nous avons encore besoin de générer des recherches cliniques de bonne qualité sur le COCProtocol chez les patients atteints de cancer, pour nous assurer que le protocole COC est aussi efficace et sûr qu’il peut l’être.
Pour nous permettre de financer cette recherche, nous avons développé un nouveau système abordable où notre étude clinique, les MÉTRIQUES, est essentiellement « financée par le patient ». Chaque patient consentant qui entre à la clinique estinscrit dans des MÉTRIQUES, et ces frais aident à financer l’étude. Il s’agit d’un nouveau modèle de recherche clinique, visant à combler les lacunes de financement et de données qui entravent actuellement la réutilisation et le développement clinique de médicaments déjà autorisés.
METRICS premiers résultats
Dans une première mesure réussie, les résultats de notre étude pilote initiale ont été récemment publiés dans la revue scientifique Frontiers in Pharmacology, revue par des pairs. Le papercan est accessible gratuitement en ligne ici.
L’étude pilote METRICS était une étude rétrospective observationnelle, ce qui signifie que nos chercheurs ont regardé en arrière et analysé les dossiers cliniques des patients pour savoir ce qui s’est passé. Ils ont collecté des données et enregistré les résultats de 95 patients atteints d’un type avancé de cancer du cerveau appelé glioblastome qui ont fréquenté la clinique d’oncologie Care et qui ont suivi le protocole COC complet aux côtés de leurs traitements standard habituels. Cette étude n’avait pas de groupe témoin, de sorte que nos chercheurs ont comparé les résultats de MÉTRIQUES avec des résultats précédemment publiés d’études antérieures chez des patientsavec le même type de cancer, et qui ont également pris des traitements standard de soins.
Les premiers résultats suggèrent que les patients qui ont assisté à notre clinique et ont suivi le protocole COC dans le cadre de leurs soins habituels étaient beaucoup plus susceptibles de survivre au moins 2 ans (64.0% des patientsdans notre étude ont survécu au moins 2 ans, comparativement à 27-29% pour les patientsinclués dans des études publiées précédemment), et ont eu tendance à avoir des temps de survie plus longs que ce à quoi on s’attendait habituellement pour les patients atteints de ce type de cancer (les patients ont survécu en moyenne 27 mois dans notre étude, comparativement à15-16 mois dans des études antérieures) (Agrawalet al., 2019).
Ces résultats sont extrêmement prometteurs, mais ils restent également préliminaires. Nous ne savons pas encore exactement comment le protocole COC peut avoir eu un impact sur les temps de survie, par exemple, ou comment d’autres facteurs tels que certaines caractéristiques des patients peuvent avoir également influencé ces résultats. Mais cette première preuve initiale est certainement encourageante, et elle nous suggère que nous allons dans la bonne direction. Notre prochaine étape prévue est de mener une étude plus vaste et bien conçue. Vous pouvez en savoir plus sur les plans de mesures futures en consultant en ligne ou en contactant la clinique.
En savoir plus sur le protocole COC
Qu’est-ce que le protocole COC ?
Le protocole COC est un schéma thérapeutique de combinaison composé de médicaments homologués, spécifiquement conçus par Care Oncology pour une utilisation en complément des traitements habituels d’un patient (c’est-à-dire standard de soins).
Les quatre médicaments inclus dans le régime du protocole COC sont: la metformine, un médicament antidiabétique commun; l’atorvastatine, un type de statine utilisé pour traiter les maladies cardiovasculaires; la doxycycline, un type d’antibiotique souvent utilisé pour traiter les infections chroniques comme l’acné; et le mébendazole, un médicament couramment utilisé pour traiter les infections parasitaires chez les enfants et les adultes.
Nous avons choisi ces quatre médicaments parmi des milliers de candidats potentiels, en particulier parce qu’ils répondent à nos critères de sélection prédéterminés. Ces critères comprennent des preuves solides d’efficacité contre le cancer, un mécanisme d’action cohérent et, surtout, un bon profil de sécurité. Ces trois principes centraux ont façonné notre approche dès le début.
La sécurité est primordiale
Le cancer est une maladie complexe avec des traitements complexes, et nous pensons que l’ajout d’autres thérapies aux traitements standard devrait être très soigneusement évalué. Pas seulement du point de vue de l’efficacité, mais aussi, ce qui est important, en termes de sécurité. C’est pourquoi toute notre approche est basée surla preuve – principalement des études scientifiques publiées, et aussi, de plus en plus, nos propres données.
De nombreux médicaments sur le marché ont au moins certaines preuves publiées soutenant leur utilisation relativement efficace dans le cancer, mais peu de ces médicaments ont le niveau de preuve de sécurité et d’efficacité requis pour le protocole COC. De grandes quantités de données détaillées existent déjà pour chacun des médicaments de protocole, recueillies à partir d’années d’utilisation dans la population générale – et cela nous a permis de prendre une longueur d’avance cruciale pendant le développement.
Nous avons minutieusement fouillé des décennies de données publiées sur chacun des médicaments du protocole theCOC, explorant comment ils fonctionnent dans différentes populations de patients (y compris les patients atteints de cancer), et sur des modèles cellulaires et animaux en laboratoire. Ces données, ainsi que notre propre expérience clinique, aident à nous assurer que nous avons une bonne compréhension de la façon dont ces médicaments se comporteront chez les patientsavec différents stades et types de cancer, à la fois en combinaison les uns avec les autres et également en combinaison avec de nombreuses autres thérapies anticancéreuses. Ces connaissances sont considérables et, d’après nos études, ce type de preuves n’est tout simplement pas encore disponible pour de nombreux autres candidats médicaments anticancéreux non homologués ‑ en particulier lorsqu’ils sont combinés.
Thérapie ananti-métabolique qui peut potentiellement cibler n’importe quel cancer
Le protocole TheCOC est conçu pour fonctionner en limitant la capacité globale des cellules cancéreuses à absorber et à utiliser (c’est-à-dire à « métaboliser ») l’énergie.
Les cellules cancéreuses ont besoin d’énormes quantités d’énergie pour survivre, et la grande majorité des cancers utilisent un processus adaptatif appelé glycolyse aérobie pour générer l’énergie excessive dont ils ont besoin (Kroemer andPouyssegur, 2008). Chacun des médicaments du protocole peut cibler les divers processus métaboliques moléculaires impliqués dans l’aérobicglycolyse et les processus environnants, ce qui peut aider à réduire le taux métabolique global de la cellule cancéreuse (Jang et al.,2013).
Nous pensons que les médicaments à base de COCProtocol peuvent fonctionner en combinaison pour restreindre de manière cohérente l’apport et l’utilisation d’énergie, tout en empêchant simultanément les cellules cancéreuses de s’adapter et d’utiliser d’autres voies pour absorber l’énergie (Jagust et al.,2019). Par conséquent, les cellules cancéreuses deviennent de plus en plus affaiblies et moins capables d’absorber et d’utiliser les nutriments (p. ex. tels que le glucose et les acides aminés essentiels glutamine et arginine) dont ils ont besoin de leur environnement (Andrzejewskiet al., 2018; Liu et coll., 2016).Cela rend globalement plus difficile la survie, la croissance et la propagation des cellules cancéreuses dans le corps. Peu à peu, les cellules affaiblies (y compris les cellules plus résilientes et précédemment résistantes au traitement) deviennent plus vulnérables aux attaques d’autres thérapies anticancéreuses qui tuent les cellules telles que la radiothérapie, la chimiothérapie, l’hormonothérapie et les thérapies ciblées (Bradford andKhan, 2013; Chen et al., 2012; Lacerda et coll., 2014; Lamb et coll., 2015a; Pantziarka et coll., 2014).
En ciblant les mécanismes métaboliques adaptés qui sont communs à la plupart des cancers (mais pas habituellement aux cellules saines), nous pensons que le protocole COC peut être efficace et sélectif pour pratiquement n’importe quel cancer, quel que soit le type, le stade ou la localisation spécifique du cancer. Les études épidémiologiques et de laboratoire publiées soutiennent de plus en plus la gamme potentiellement large de cette thérapie (Chae et al., 2015, 2016; Iliopoulos et coll., 2011; Lamb et coll., 2015b; Pantziarka et coll.,2014).
Cohérence mécaniste en action – le pouvoir de la combinaison
Le véritable pouvoir du protocole theCOC réside dans la combinaison spécifique des médicaments que nous utilisons. Nous avons développé le protocole non seulement comme un régime de quatre traitements individuels chacun avec une activité anticancéreuse, mais aussi pour fonctionner comme un seul traitement combiné – avec le potentiel de produire de puissants effets synergiques (Mokhtari et al., 2017).
Chaque médicament du protocole COC cible le métabolisme des cellules cancéreuses de manière distincte et complémentaire, et nous avons appelé cette action « cohérence mécaniste ». En termes simples, la cohérence mécaniste décrit comment chaque médicament peut attaquer la cellule cancéreuse sous un angle différent. Par exemple, les cellules souches cancéreuses sont un type de cellule cancéreuse particulièrement résiliente, et chaque médicament cible ces cellules d’une manière différente: la metformine cible les « batteries » de la cellule (appelées mitochondries) en rendant très difficile pour les mitochondries d’exécuter les réactions moléculaires dont elles ont besoin pour produire de l’énergie, la doxycycline bloque la cellule-dnamachine que les mitochondries doivent répliquer et réparer (Skoda et al., 2019), les statines peuvent modifier l’expression des gènes des cellules souches cancéreuses, rendant les cellules plus sensibles aux autres thérapies anticancéreuses (Kodach et al., 2011), andmebendazole peut interrompre de nombreux processus moléculaires impliqués dans la division cellulaire pour aider à bloquer la croissance des cellules souches cancéreuses (Hothi et al., 2012; Hou et coll., 2015).
En combinant les quatre agents ensemble, le protocole COC peut frapper les cellules souches cancéreuses (et d’autres cellules cancéreuses) sur plusieurs « points faibles », et comme un coup de poing un-deux, cela laisse les cellules moins capables d’esquiver et de récupérer.
Les études de laboratoire commencent à mettre en évidence l’efficacité de cette approche utilisant des combinaisons de médicaments COCprotocol. Dans une étude mécaniste, la combinaison de statine et de metformine a considérablement diminué la croissance des cellules cancéreuses de la prostate plus que l’agent seul (Wang et al., 2017). Les études d’observation ont également signalé des effets potentiellement « synergiques » de ces médicaments contre divers cancers (Babcook et al., 2014; Danzig et coll., 2015; Lehman et coll., 2012; Nimako et coll., 2017). Un essai clinique portant sur la metformine et la doxycycline dans le cancer du sein est maintenant en cours (NCT02874430), et notre propre programme de recherche, METRICS, commence également à produire des données prometteuses.
Une thérapie d’appoint à long terme
Le protocole TheCOC est principalement conçu pour être une thérapie « d’appoint » à long terme, pour aider à optimiser les traitements standard. Cependant, comme le traitement métabolique par le COCProtocol est destiné à durer longtemps, les patients peuvent également prendre le protocole comme régime d’entretien après la fin du traitement standard ou pendant les pauses du traitement standard et dans le cadre d’une stratégie à long terme pour atténuer le risque de récidive ou de métastases. Pour cette raison, il convient également de noter quechacun des médicaments du protocole COC a également signalé des mécanismes bénéfiques d’action dans le cancer qui ne dépendent pas de la co-administration de thérapies standard, et qui peuvent aider indépendamment à réduire le risque de rechute et de propagation métastatique.
Le modèle de soins en oncologie
Surveillance médicale active de chaque patient
Bien que les médicaments COCProtocol soient utilisés en toute sécurité dans la population générale depuis de nombreuses années, chaque patient qui vient chez nous est unique. C’est pourquoi chaque patient qui assiste à la Clinique d’oncologie de Soins est placé sous la garde directe de cliniciens ayant des connaissances spécialisées dans la prescription des médicaments du Protocole COC dans le contexte du cancer. Nos cliniciens évaluent individuellement les avantages et les risques potentiels liés à la prise du protocole COC avec chaque patient. Ils ne recommanderont le protocole COC aux patients que s’ils estiment qu’il sera sûr et utile de le faire. Chaque prescription de protocole COC est adaptée aux besoins du patient, et les doses et les schémas thérapeutiques sont soigneusement examinés et ajustés en fonction de la progression du patient.
Il est donc essentiel que les patients ne suivent le protocole COC que tout en étant surveillés attentivement dans notre clinique pendant la durée de leur traitement.
*********************************************************************************
Avis important
Objet de cet article
Cet article est un aperçu de certaines des publications scientifiques et médicales concernant les médicaments qui composent l’Oncologie de soins brevetée Protocol. On a pris soin de sélectionner les articles pertinents soutenant l’utilisation hors étiquette de ces médicaments en milieu clinique pour le traitement d’appoint du cancer. Cet article ne prétend pas être un examen exhaustif de toutes les données probantes et ne rend pas compte de tous les effets secondaires potentiels d’un tel traitement.
Cet article est à titre indicatif et ne constitue PAS un conseil médical. Les médicaments dont il est question ici sont disponibles sur ordonnance seulement et ne doivent pas être pris sans consultation avec votre médecin ou un autre professionnel de la santé. Les médecins oncologues de Care discuteront avec vous de l’adéquation de ces médicaments et assureront la liaison avec votre médecin ou votre oncologue pour discuter de leur adéquation pour vous.
Vous NE devez PAS vous fier aux informations contenues dans cet article comme une alternative aux conseils médicaux de votre médecin ou d’un autre professionnel de la santé. Si vous avez des questions spécifiques sur des questions médicales, vous devriez consulter votre médecin ou un autre professionnel de la santé. Si vous pensez souffrir d’une affection médicale, vous devez consulter immédiatement un médecin. Vous ne devez jamais tarder à demander un avis médical, ne pas tenir compte des conseils médicaux, oucontinuer un traitement médical en raison des informations contenues dans cet article.
Copyright
Les droits d’auteur de cet article appartiennent à Health Clinics LLC et à ses concédants de licence.
Brevet
Le protocole Care Oncology (« COC ») est protégé par le brevet américain US9622982B2 et pardivers brevets internationaux supplémentaires.
*********************************************************************************
Agrawal, S., Vamadevan, P., Mazibuko, N., Bannister, R., Swery, R., Wilson, S., andEdwards, S. (2019). Une Nouvelle Méthode de Génération de Preuves Éthiques et Efficaces pour l’Utilisation de Médicaments Non homologués en Oncologie (Étude de Cas sur le Glioblastome). Devant.Pharmacol. 10.
Ahern, T.P., Lash, T.L., Damkier, P., Christiansen, P.M. et Cronin-Fenton, D.P. (2014). Statines et pronostic du cancer du sein: preuves et opportunités. Lancette Oncol. 15, e461-468.
Aksoy, S., Sendur, M.A.N., et Altundag, K. (2013).Caractéristiques démographiques et clinico-pathologiques chez les patients présentant un cancer du sein invasif recevant de la metformine. Med. Oncol. Le Bois du Nord. Engl. 30, 590.
Alarcon Martinez, T., Zeybek, N.d., et Müftüoğlu, S. (2018). Evaluation des Effets cytotoxiques et Autophagiques de l’Atorvastatine sur les cellules cancéreuses du sein MCCF-7. Rechigne. Med. J. 35, 256-262.
Alimova, I.N., Liu, B., Fan, Z., Edgerton, S.M., Dillon, T., Lind, S.e., et Thor, A.D. (2009). La metformine inhibe la croissance des cellules cancéreuses du sein, la formation de colonies et induit l’arrêt du cycle cellulaire in vitro. CellCycle 8, 909-915.
Andrzejewski, S., Siegel, P. M., et St-Pierre, J. (2018). Profils Métaboliques Associés À L’Efficacité de La Metformine dans le Cancer. Devant.Endocrinol. 9.
Babcook, M.A., Shukla, S., Fu, P., Vazquez, E.J., Puchowicz, M.A., Molter, J.P., Oak, C.Z., MacLennan, G.T., Flask, C.A., Lindner, D.J., et al. (2014). Combinaison synergique de Simvastatine et de MetforminecHémothérapie pour le cancer de la Prostate résistant à la Castration Métastatique osseuse. Mol.Cancer Ther. 13, 2288–2302.
Bahrami, F., Morris, D.L., et Pourgholami, M.H. (2012). Tétracyclines: médicaments au potentiel thérapeutique énorme. Mini Rev.Med.Chem. 12, 44–52.
Bao, B., Azmi, A.S., Ali, S., Zaiem, F., et Sarkar, F.H. (2014). La metformine peut fonctionner comme agent anticancéreux via le ciblage des cellules cancéreuses: la signification biologique potentielle des MIARN associés à la tumeur dans les cancers du sein et du pancréas. Ann. Transl. Med. 2.
Bjarnadottir, O., Romero, Q., Bendahl, P.-O., Jirström, K., Rydén, L., Loman, N., Uhlén, M., Johannesson, H., Rose, C., Grabau, D., etal. (2013). Cibler l’HMG-COA réductase avec des statines dans un essai sur le cancer du sein opportunément. Traitement du cancer du Sein. 138, 499–508.
Bjarnadottir, O., Kimbung, S., Johansson, I., Veerla, S., Jönsson, M., Bendahl, P.-O., Grabau, D., Hedenfalk, I. et Borgquist, S. (2015). Changements transcriptionnels globaux à la suite d’un traitement à la statine chez le cancer du sein. Clin. Cancer Rés. Éteint. J. Le matin. Assoc. Cancer Res. 21, 3402-3411.
Bonanni, B., Puntoni, M., Cazzaniga, M., Pruneri, G., Serrano, D., Guerrieri-Gonzaga, A., Gennari, A., Trabacca, M.S., Galimberti, V., Veronesi, P., et al. (2012). Effet double de la metformine sur la prolifération du cancer du sein dans un essai préchirurgical randomisé. J. Clin. Oncol. Hors. J. Le matin.Soc. Clin. Oncol. 30, 2593–2600.
Bradford, S.A., et Khan, A. (2013). La chimiothérapie individualisante utilisant le Médicament Antidiabétique, la Metformine, comme adjuvant: Une étude exploratoire. J. Cancer Sci. Là. 5.
Brewer, T.M., Masuda, H., Liu, D.D., Shen, Y., Liu, P., Iwamoto, T., Kai, K., Barnett, C.M., Woodward, W.A., Reuben, J.M., et coll.(2013). Utilisation de statines dans le cancer du sein inflammatoire primaire: une étude de cohorte. Fr.J. Cancer 109, 318-324.
Camacho, L., Dasgupta, A. et Jiralerspong, S. (2015). Metformine dans le cancer du sein – un mystère en évolution. Cancer du sein Res. RCB 17, 88.
Campbell, M.J., Esserman, L.J., Zhou, Y., Cordonnier, M., Lobo, M., Borman, E., Baehner, F., Kumar, A.S., Adduci, K., Marx, C., et al. (2006). Prévention de la croissance du cancer du sein par les statines. Cancer Res. 66,8707-8714.
Cazzaniga, M., DeCensi, A., Pruneri, G., Puntoni, M., Bottiglieri, L., Varricchio, C., Guerrieri-Gonzaga, A., Gentilini, O.D., Pagani, G., Dell’Orto, P., et al. (2013). L’effet de la metformine sur l’apoptosedans un essai préchirurgical du cancer du sein. Fr. J. Cancer 109, 2792-2797.
Chae, Y.K., Valsecchi, M.E., Kim, J., Bianchi, A.L., Khemasuwan, D., Desai, A., et Testeur, W. (2011). Risque réduit de cancer du Mammairerecurrence chez les patientes utilisant des inhibiteurs de l’ECA, des ARA et / ou des statines. Cancer. 29, 585–593.
Chae, Y.K., Yousaf, M., Malecek, M.-K., Carneiro, B., Chandra, S., Kaplan, J., Kalyan, A., Sassano, A., Platanias, L.C. et Giles, F. (2015). Statines comme traitement anticancéreux; Pouvons-nous traduire les données précliniques et épidémiologiques en bénéfices cliniques? Discov. Med. 20, 413–427.
Chae, Y.K., Arya, A., Malecek, M.-K., Shin, D.S., Carneiro, B., Chandra, S., Kaplan, J., Kalyan, A., Altman, J.K., Platanias, L., et al. (2016). Réutilisation de la metformine pour le traitement du cancer: études cliniques actuelles. Oncotarget 7, 40767-40780.
Chen, J., Lan, T., Hou, J., Zhang, J., An, Y., Tie, L., Pan, Y., Liu, J. et Li, X. (2012). L’atorvastatine sensibilise les carcinomes pulmonaires à petites cellules humaines à la carboplatine via la suppression de l’activation de l’AKT et la régulation à la hausse de TIMP-1. Int. J. Biochem. Biol cellulaire. 44, 759–769.
Chen, L., Chubak, J., Boudreau, D.M., Barlow, W.E., Weiss, N.S. et Li, C.I. (2017). Traitements du diabète et Risques de résultats du cancer du sein adverses chez les patientes atteintes d’un cancer du sein à un stade précoce: A SEER – MedicareAnalysis. Cancer Res. 77, 6033-6041.
Chen, T., Liang, Y., Feng, D., Tao, L., Qi, K., Zhang, H., Wang, H., Lin, Q. et Kong, H. (2013). La metformine inhibe la proliférationet favorise l’apoptose des cellules cancéreuses du sein HER2 positives en régulant à la baisse SP90. J. ARRÊTE. J. Balk. Union Oncol. 18, 51–56.
Coyne, C., Jones, T. et Bear, R. (2014).Cytotoxicité anti-néoplasique de la Gemcitabine – (C4-amide) – Combinaison induelle avec l’Épirubicine – (C3-amide) – contre l’Adénocarcinome mammaire résistant à la chimiothérapie (SKBr-3) et l’effet complémentaire du Mébendazole. J. Cancer Rés. Ther. Oncol. 2.
Coyne, C.P., Jones, T. et Bear, R. (2012). Influence d’Inhibiteurs Alternatifs de la Tubuline sur la Puissance de l’Aépirubicine – Immunochimiothérapeutique Synthétisée avec un Intermédiaire Ultra-Activé par la Lumière Violette. Clin de cancer. Oncol. 1, 49–80.
Coyne, C.P., Jones, T. et Bear, R. (2013).Gemcitabine-(C4-amide)- Anti-Neoplastic Cytotoxicity in DualCombination with Mebendazole against Chemotherapeutic-Resistant MammaryAdenocarcinoma. J. Clin. Exp. Oncol. 2.
Cufi, S., Corominas-Faja, B., Vazquez-Martin, A.,Oliveras-Ferraros, C., Dorca, J., Bosch-Barrera, J., Martin-Castillo, B., andMenendez, J.A. (2012). Metformin-induced preferential killing of breast cancerinitiating CD44+CD24-/low cells is sufficient to overcome primary resistance totrastuzumab in HER2+ human breast cancer xenografts. Oncotarget 3, 395–398.
Danzig, M.R., Kotamarti, S., Ghandour, R.A., Rothberg, M.B., Dubow, B.P., Benson, M.C., Badani, K.K. et McKiernan, J.M. (2015).Synergie entre la metformine et les statines dans la modification du risque de récidive biochimique suite à une prostatectomie radicale chez les hommes diabétiques. ProstateCancer Prostatique Dis. 18, 63–68.
Davies, G., Lobanova, L., Dawicki, W., Groot, G., Gordon, J.R., Bowen, M., Harkness, T. et Arnason, T. (2017). La metformine Inhibe le développement et favorise la résensibilisation du cancer du sein résistant aux traitements. PLoS UN 12.
De Witt, M., Gamble, A., Hanson, D., Markowitz, D., Powell, C., Al Dimassi, S., Atlas, M., Boockvar, J., Ruggieri, R. et Symons, M. (2017). Réutilisation du mébendazole en remplacement de la Vincristine pour le traitement des tumeurs cérébrales. Mol. Med. 23, 50–56.
DeCensi, A., Puntoni, M., Gandini, S., Guerrieri-Gonzaga, A., Johansson, H.A., Cazzaniga, M., Pruneri, G., Serrano, D., Schwab, M., Hofmann, U., et al. (2014). Effets différentiels de la prolifération du cancer du sein à la metformine selon les marqueurs de la résistance à l’insuline et du sous-type tumoral dans un essai préchirurgical randomisé. Traitement du cancer du Sein. 148,81–90.
DeCensi, A., Puntoni, M., Guerrieri-Gonzaga, A., Cazzaniga, M., Serrano, D., Lazzeroni, M., Vingiani, A., Gentilini, O., Petrera, M., Viale, G., et al. (2015). Effect of Metformin on Breast DuctalCarcinoma In Situ Proliferation in a Randomized Presurgical Trial. Cancer Précédent.Rés. Phila. Pa 8, 888-894.
Deng, X.-S., Wang, S., Deng, A., Liu, B., Edgerton, S.M., Lind, S.e., Wahdan-Alaswad, R. et Thor, A.D. (2012). La metformine cible Stat3 pour inhiber la croissance cellulaire et induire l’apoptose chez les allaiteurs à triple négatif. Cycle cellulaire Georget. Tex 11, 367-376.
Dowling, R.J., Parulekar, W.R., Gelmon, K.A., Shepherd, L.E., Virk, S., Ennis, M., Mao, F., Ligibel, J.A., Hershman, D.L., Rastogi, P., et al. (2018). CA15-3/MUC1 dans le CCTG MA-32 (NCT01101438): ECR de phaseIII de l’effet de la metformine par rapport au placebo sur la survie générale et sans maladie invasive dans le cancer du sein à un stade précoce (C.-B.). J. Clin. Oncol.
Duivenvoorden, W.C.M., Popović, S.V., Lhoták, S., Seidlitz, E., Hirte, H.W., Tozer, R.G. et Singh, G. (2002). La doxycycline diminue la charge tumorale dans un modèle de métastase osseuse du cancer du sein humain. Cancer Rés. 62,1588–1591.
El-Benhawy, S.A., et El-Sheredy, H.G. (2014).Metformine et survie chez les patientes diabétiques atteintes d’un cancer du sein. J. Égypte.Association de Santé publique 89, 148–153.
Feldt, M., Bjarnadottir, O., Kimbung, S., Jirström, K., Bendahl, P.-O., Veerla, S., Grabau, D., Hedenfalk, I. et Borgquist, S. (2015). Effets anti-prolifératifs induits par les statines via la cycline D1 et la p27 dans un essai sur le cancer du sein à portée de main. J. Transl. Med. 13, 133.
Fife, R.S., et Sledge, G.W. (1995). Effets de la doxycycline sur la croissance in vitro, la migration et l’activité de la gélatinase des cellules du cancer du sein. J. Lab. Clin. Med. 125, 407–411.
Fife, R.S., et Sledge, G.W. (1998). Effets de la doxycycline sur les cellules cancéreuses in vitro et in vivo. Adv. Dent. Rés. 12, 94 à 96.
Fiorillo, M., Tóth, F., Sotgia, F. et Lisanti, Député (2019). Doxycycline, Azithromycine et vitamine C (DAV): une combinaison puissante de thérapie pour cibler les mitochondries et éradiquer les cellules souches cancéreuses (CSC).Vieillissement 11, 2202-2216.
Foroodi, F., Duivenvoorden, W.C. et Singh, G. (2009). Interactions de la doxycycline avec des agents chimiothérapeutiques dans les cellules de l’adénocarcinome du sein humain MDA-MB-231. Anticancéreux. Médicaments 20, 115-122.
Garwood, E.R., Kumar, A.S., Baehner, F.L., Moore, D.H., Au, A., Hylton, N., Flowers, C.I., Garber, J., Lesnikoski, B.-A., Hwang, E.S., et al. (2010). La fluvastatine réduit la prolifération et augmenteapoptose chez les femmes à haut gradecancer du sein. Traitement du cancer du Sein. 119, 137–144.
Giles, E.D., Jindal, S., Wellberg, E.A., Schedin, T., Anderson, S.M., Thor, A.D., Edwards, D.P., MacLean, P.s., et Schedin, P. (2018). La metformine inhibe l’expression de l’aromatase stromale et la progression tumorale dans un modèle de rongeur du cancer du sein ménopausique. Cancer du sein Res. RCB 20.
Goodwin, P.J., Parulekar, W.R., Gelmon, K.A., Shepherd, L.E., Ligibel, J.A., Hershman, D.L., Rastogi, P., Mayer, I.A., Hobday, T.J., Lemieux, J., et coll. (2015). Effet de la metformine vs placebo sur les facteurs etmétaboliques dans la MA CTG de l’INCC.32. J. Natl. Cancer Inst. 107.
Hadad, S., Iwamoto, T., Jordan, L., Purdie, C., Bray, S., Baker, L., Jellema, G., Deharo, S., Hardie, D.G., Pusztai, L., et al.(2011). Evidence for biological effects of metformin in operable breast cancer: a pre-operative, window-of-opportunity, randomized trial. Traitement du cancer du Sein. 128, 783–794.
Hadad, S.M., Hardie, D.G., Appleyard, V., Etthompson, A.M. (2014). Effets de la metformine sur la prolifération cellulaire du cancer du sein, la voie AMPK et le cycle cellulaire. Clin. Transl. Oncol. Hors.Publ. Fed. Span. Oncol. Soc. Natl. Cancer Inst. Méx. 16, 746–752.
Hatoum, D., et McGowan, E.M. (2015). Avancées récentesdans l’utilisation de la metformine: le traitement du diabète peut-il prévenir le cancer du sein? BioMédRes. Int. 2015, 548436.
Hirsch, H.A., Iliopoulos, D., Tsichlis, P.N., andStruhl, K. (2009). La Metformine Cible Sélectivement les Cellules Souches Cancéreuses et agit avec la Chimiothérapie pour Bloquer la Croissance Tumorale et Prolonger la rémission. Cancers. 69, 7507–7511.
Hothi, P., Martins, T.J., Chen, L., Deleyrolle, L., Yoon, J.-G., Reynolds, B. et Foltz, G. (2012). Produits chimiques à haut débit Les écrans Identifient le Disulfirame comme un inhibiteur des Cellules souches du glioblastome humain.Oncotarget 3, 1124-1136.
Hou, Z.-J., Luo, X., Zhang, W., Peng, F., Cui, B., Wu, S.-J., Zheng, F.-M., Xu, J., Xu, L.-Z., Long, Z.-J., et al. (2015).Le flubendazole, anthelminthique approuvé par la FDA, cible les cellules souches du cancer du sein.Oncotarget 6, 6326-6340.
Iliopoulos, D., Hirsch, H.A., et Struhl, K. (2011).La metformine diminue la dose de chimiothérapie pour prolonger la rémission tumorale dans les xénogreffes mutuelles impliquant plusieurs types de cellules cancéreuses. Cancer Res. 71,3196-3201.
Jacob, L., Kostev, K., Rathmann, W. et Kalder, M. (2016). Impact de la metformine sur les métastases chez les patientes atteintes d’un cancer du sein etdiabète de type 2. J. Complications du diabète 30, 1056-1059.
Jagust, P., de Luxán-Delgado, B., Parejo-Alonso, B., et Sancho, P. (2019). Stratégies Thérapeutiques Basées Sur Le Métabolisme Ciblant Les cellules cancéreuses. Devant. Pharmacol. 10.
Jang, M., Kim, S.s. et Lee, J. (2013). Métabolisme cellulaire cancéreux: implications pour les cibles thérapeutiques. Exp. Mol. Med. 45, e45.
Jiralerspong, S., Palla, S.L., Giordano, S.H., Meric-Bernstam, F., Liedtke, C., Barnett, C.M., Hsu, L., Hung, M.-C., Hortobagyi, G.N. et Gonzalez-Angulo, A.m. (2009). Metformine et Pathologiquesréponses complètes à la Chimiothérapie Néoadjuvante chez les Patients Diabétiques Atteints de cancer du sein. J. Clin. Oncol. 27, 3297–3302.
Kalinsky, K., Crew, K.D., Refice, S., Xiao, T., Wang, A., Feldman, S.m., Taback, B., Ahmad, A., Cremers, S., Hibshoosh, H., et al.(2014). Essai préopératoire de la metformine chez des patients en surpoids et obèses aveccancer du sein nouvellement diagnostiqué. Investir dans le cancer. 32, 150–157.
Kanugula, A.K., Gollavilli, P.N., Vasamsetti, S.B., Karnewar, S., Gopoju, R., UmmAnni, R. et Kotamraju, S. (2014). L’inhibition par les statines de la prolifération et de l’invasion du cancer du sein implique une atténuation du transport du fer: intermédiarité de l’oxyde nitrique et des mécanismes de défense antioxydants. FEBS J. 281, 3719-3738.
Kim, H.J., Kwon, H., Lee, J.W., Kim, H.J., Lee, S.B., Park, H.S., Sohn, G., Lee, Y., Koh, B.S., Yu, J.H., et al. (2015). La metformine augmente la survie chez les patientes atteintes de diabète atteintes d’un cancer du sein HER2 positif aux récepteurs hormonaux. Cancer du sein Res. RCB 17, 64.
Kim, J., Lim, W., Kim, E.-K., Kim, M.-K., Paik, N.-S., Jeong, S.-S., Yoon, J.-H., Park, C.H., Ahn, S.H., Kim, L.S., et al. (2014).Essai randomisé de phase II de metformine néoadjuvante plus létrozole contre placeboplus létrozole pour le cancer du sein postménopausal positif au récepteur des œstrogènes (METEOR). Cancer BMC 14, 170.
Kodach, L.L., Jacobs, R.J., Voorneveld, P.W., Wildenberg, M.E., Verspaget, H.W., van Wezel, T., Morreau, H., Hommes, D.W., Peppelenbosch, M.P., van den Brink, G.R., et coll. (2011). Les statines augmentent la hémosensibilité des cellules cancéreuses colorectales induisant une reprogrammation épigénétique et une réduction de la « tige » des cellules cancéreuses colorectales via la voie des protéines morphogénétiques osseuses. Gut 60, 1544-1553.
Kozar, K., Kaminski, R., Legat, M., Kopec, M., Nowis, D., Skierski, J., Koronkiewicz, M., Jakóbisiak, M. et Golab, J. (2004).La cérivastatine présente une activité antitumorale accrue contre les lignées cellulaires du cancer du sein humain lorsqu’elle est utilisée en association avec la doxorubicine ou le cisplatine. Int.J. Oncol.
Kroemer, G., et Pouysségur, J. (2008). Le métabolisme cellulaire tumoral : Le Talon d’Achille du cancer. Cellule cancéreuse 13, 472-482.
Kwan, M.L., Habel, L.A., Flick, E.D., Quesenberry, C.P. et Caan, B. (2008). Utilisation de statines post-diagnostic et apparition du cancer du sein dans une étude de cohorte prospective de cancers du sein à un stade précoce. Traitement du cancer du Sein. 109, 573–579.
Lacerda, L., Reddy, J.P., Liu, D., Larson, R., Li, L., Masuda, H., Brewer, T., Debeb, B.G., Xu, W., Hortobágyi, G.N., et al. (2014).La simvastatine radiosensibilise les cellules du cancer du sein différenciées et de type tige et est associée à un meilleur contrôle local chez les patientes atteintes de cancer du sein inflammatoire traitées par radiothérapie post-mastectomie. Cellules Souches Transl. Med.3, 849–856.
Lamb, R., Fiorillo, M., Chadwick, A., Ozsvari, B., Reeves, K.J., Smith, D.L., Clarke, R.B., Howell, S.J., Cappello, A.R., Martinez-Outschoorn, U.E., et al. (2015a). La doxycycline régule l’ADN-PK et radiosensibilise les cellules initiatrices de tumeurs: Implications pour une thérapie de radiothérapie plus efficace. Oncotarget 6, 14005-14025.
Lamb, R., Ozsvari, B., Lisanti, C.L., Tanowitz, H.B., Howell, A., Martinez-Outschoorn, U.E., Sotgia, F., et Lisanti, Député (2015b).Les antibiotiques qui ciblent les mitochondries éradiquent efficacement les cellules souches cancéreuses, sur plusieurs types de tumeurs: Traiter le cancer comme une maladie infectieuse.Oncotarget 6, 4569-4584.
Lehman, D.M., Lorenzo, C., Hernandez, J. et Wang, C. (2012). Utilisation de statines comme Modérateur de l’Effet de la Metformine sur le Risque de cancer de la prostate Chez les Patients Diabétiques de type 2. Soins du diabète 35, 1002-1007.
Lin, C., Lo, M., Moody, R., Stevers, N., Tinsley, S. et Sun, D. (2018). La doxycycline cible les cellules du cancer du sein positives à l’aldéhyde déshydrogénase. Oncol. Il s’agit de l’un des plus grands noms de la littérature chinoise. La relation entre les statines et le pronostic du cancer du sein varie selon le type de statine et le temps d’exposition: une méta-analyse. Traitement du cancer du Sein. 164,1–11.
Liu, H., Scholz, C., Zang, C., Schefe, J.H., Habbel, P., Regierer, A.-C., Schulz, C.-O., Possinger, K. et Eucker, J. (2012).La metformine et l’inhibiteur de mTOR everolimus (RAD001) sensibilisent les cellules du cancer du sein à l’effet cytotoxique des médicaments chimiothérapeutiques in vitro. AnticancérEux. 32, 1627–1637.
Liu, X., Romero, I.L., Litchfield, L.M., Lengyel, E. et Locasale, J.W. (2016). La metformine cible le métabolisme central du carbone et vérifie les besoins mitochondriaux dans les cancers humains. Métab cellulaire. 24, 728–739.
Ma, J., Guo, Y., Chen, S., Zhong, C., Xue, Y., Zhang, Y., Lai, X., Wei, Y., Yu, S., Zhang, J., et al. (2014). Amélioration de la metformine inhibition de la croissance tumorale médiée par le amoxifène dans un carcinome mammaire ER positif. BMCCancer 14, 172.
Manthravadi, S., Shrestha, A., et Madhusudhana, S. (2016). Impact of statin use on cancer recurrence and mortality in breastcancer: A systematic review and meta-analysis. Int. J. Cancer 139, 1281-1288.
Mark, M., Klingbiel, D., Mey, U., Winterhalder, R., Rothermundt, C., Gillessen, S., von Moos, R., Pollak, M., Manetsch, G., Strebel, R., et al. (2019). Impact de l’addition de Metformine à l’Abiratérone Chez Les Patients Atteints d’Un Cancer de la Prostate Résistant à La Castration méTastatique Présentant Une progression de la maladie Tout En Recevant Un Traitement à L’Abiratérone (MetAb-Pro): Étude pilote de Phase 2. Clin. Génitourine. Cancer 17, e323–e328.
Martin-Castillo, B., Pernas, S., Dorca, J., A.S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., et al. (2018). Un essai de phase 2 de metformine non adjuvante en association avec le trastuzumab et une chimiothérapie chez des femmes atteintes d’un cancer du sein HER2-positif précoce: l’étude METTEN. Oncotarget 9.35687-35704.Mokhtari, R. B., Homayouni, T. S., Baloutch, N., Morgatskaya, E., Kumar, S., Das, B. et Yeger, H. (2017). Thérapie combinée luttant contre le cancer. Oncotarget 8, 38022-38043.Il s’agit de la première édition de la série.Effet inhibiteur des statines sur la prolifération du cancer du sein humain cells.Int . J. Clin. Pharmacol. Là. 42, 695–700.
Mukhopadhyay, T., Sasaki, J., Ramesh, R. et Roth, J.A. (2002). Le mébendazole Provoque un Effet Antitumoral Puissant sur les cellules cancéreuses Humaines in Vitro et in Vivo. Clin. Cancer Res. 8, 2963-2969.
Murtola, T.J., Visvanathan, K., Artama, M., Vainio, H. et Pukkala, E. (2014). Utilisation de statines et survie au cancer du sein: une étude à l’échelle nationale réalisée en Finlande. PloS One 9, e110231.
Nanni, O., Amadori, D., De Censi, A., Rocca, A., Freschi, A., Bologne, A., Gianni, L., Rosetti, F., Amaducci, L., Cavanna, L., et coll. (2019). Metformine plus chimiothérapie contre chimiothérapie seule dans le traitement de première intention du cancer du sein métastatique HER2-négatif. L’essai clinique de phase 2 mymérandomisé. Traitement du cancer du Sein. 174, 433–442.
Nimako, G.K., Wintrob, Z.A.P., Sulik, D.A., Donato, J.L., et Ceacareanu, A.C. (2017). Avantages synergiques des tumeurs malignes gastro-intestinales à la statine et à la Metforminine. J. Pharm. Pract. 30, 185–194.
Niraula, S., Dowling, R.J.O., Ennis, M., Chang, M.C., Done, S.J., Hood, N., Escallon, J., Leong, W.L., McCready, D.R., Reedijk, M., et coll. (2012). Metformine dans le cancer du sein précoce: une fenêtre prospective d’étude néoadjuvante d’opportunité. Traitement du cancer du Sein. 135, 821–830.
Nygren, P., et Larsson, R. (2014). Repositionnement du médicament du banc au chevet du patient: Rémission de la tumeur par l’antihelminthique mébendazoléine réfractaire au cancer du côlon métastatique. Acta Oncol. 53, 427–428.
Orecchioni, S., Reggiani, F., Talarico, G., Mancuso, P., Calleri, A., Gregato, G., Labanca, V., Noonan, D.M., Dallaglio, K., Albini, A., et al. (2015). Les biguanides metformine et phenformine inhibent l’angiogenèse, la croissance locale et métastatique du cancer du sein en ciblant à la fois les cellules néoplasiques et microenvironnementales. Int. J. Cancer 136, E534-544.
Ozsvari, B., Sotgia, F., et Lisanti, député (2017). Une nouvelle approche indépendante des mutations de la thérapie du cancer: Inhiber le RAS oncogène et le MYC, en ciblant la biogenèse mitochondriale. Vieillissement 9, 2098-2116.
Pantziarka, P., Bouche, G., Meheus, L., Sukhatme, V., et Sukhatme, V.P. (2014). Réutilisation des médicaments en oncologie —ReDO) – mébendazole commeun agent anticancéreux. Sciences de l’environnement et de la médecine 8.
Peiris-Pagès, M., Sotgia, F., et Lisanti, Député (2015). La doxycycline et le ciblage thérapeutique de la réponse aux dommages de l’ADN dans les cellules cancéreuses: ancien médicament, nouveau but. Oncoscience 2, 696-699.
Rahmani, J., Manzari, N., Thompson, J., Gudi, S.K., Chhabra, M., Naik, G., Moussavi, S.M., Varkaneh, H.K., Clark, C. et Zhang, Y. (2019). L’effet de la metformine sur les biomarqueurs associés au cancer du sein devient: une revue systématique, une méta-analyse et une dose-réponse d’essais cliniques randomisés. Clin. Transl. Oncol.
Scatena, C., Roncella, M., Di Paolo, A., Aretini, P., Menicagli, M., Fanelli, G., Marini, C., Mazzanti, C.M., Ghilli, M., Sotgia, F., et al. (2018). La Doxycycline, un inhibiteur de la Biogenèse Mitochondriale, Réduit Efficacement les Cellules Souches Cancéreuses (CSCs) chez les Patientes atteintes d’un cancer du Sein Précoce: Étude Pilote AClinique. Devant. Oncol. 8.
Seeger, H., Wallwiener, D., et Mueck, A.O. (2003).Les statines peuvent inhiber la prolifération des cellules cancéreuses du sein humain in vitro. Exp.Clin. Endocrinol. Diabète Éteint. J. Ger. Soc. Endocrinol. Yourte. Diabète Assoc.111, 47–48.
Skoda, J., Borankova, K., Jansson, P.J., Huang, M.L.-H., Veselska, R. et Richardson, D.R. (2019). Ciblage pharmacologique des mitochondries dans les cellules souches cancéreuses: Un organite ancien au carrefour de nouvelles thérapies anticancéreuses. Pharmacol. Rés. 139, 298 à 313.
Sonnenblick, A., Agbor-Tarh, D., Bradbury, I., DiCosimo, S., Azim, H.A., Fumagalli, D., Sarp, S., Wolff, A.C., Andersson, M., Kroep, J., et al. (2017). Impact de l’utilisation du Diabète, de l’Insuline et de la Metformine sur la sortie des Patientes Atteintes d’Un Cancer du Sein Primaire du Récepteur du Facteur de Croissance Épidermique Humain 2–Positif: Analyse de l’Essai Randomisé ALTTO de Phase III. J.Clin. Oncol. 35, 1421–1429.
Van Wyhe, R.D., Rahal, O.M., et Woodward, W.A. (2017). Effet des statines sur la récurrence et la mortalité du cancer du sein: une revue.Le Cancer du Sein Cible Ther. 9, 559–565.
Vazquez-Martin, A., Oliveras-Ferraros, C., Cufí, S., Del Barco, S., Martin-Castillo, B., Lopez-Bonet, E., et Menendez, J.A. (2011).Le médicament antidiabétique metformine supprime la protéine associée aux métastases D24 dans les cellules cancéreuses du sein MDA-MB-468 à triple négatif. Oncol. Rép. 25,135–140.
Vintonenko, N., Jais, J.-P., Kassis, N., Abdelkarim, M., Perret, G.-Y., Lecouvey, M., Crepin, M. et Di Benedetto, M. (2012).Analyse du transcriptome et activité in vivo de la fluvastatine par rapport à l’acide zolédronique dans un modèle de métastase du cancer du sein murin. Mol. Pharmacol. 82, 521–528.
Wahdan-Alaswad, R.S., Cochrane, D.R., Spoelstra, N.-É., Howe, E.N., Edgerton, S.M., Anderson, S.M., Thor, A.D. et Richer, J.K. (2014). La mise à mort induite par la metformine des cellules cancéreuses du sein à triple négatif est favorisée par la réduction de la synthase d’acide gras via le miARN-193b.Horm. Cancer 5,374-389.
Wang, Z.-S., Huang, H.-R., Zhang, L.-Y., Kim, S., He, Y., Li, D.-L., Farischon, C., Zhang, K., Zheng, X., Du, Z.-Y., et al. (2017).Etude mécaniste des Effets inhibiteurs de l’inCombinaison de la Metformine et de l’Atorvastatine sur les cellules cancéreuses de la Prostate in Vitro et in Vivo. Biol. PHARM. Taureau.40, 1247–1254.
Wolfe, A.R., Debeb, B.G., Lacerda, L., Larson, R., Bambhroliya, A., Huang, X., Bertucci, F., Finetti, P., Birnbaum, D., Van Laere, S., et al. (2015). La simvastatine prévient le cancer du sein triple négatifmétastase dans les modèles précliniques grâce à la régulation du cancer du sein FOXO3a. Traiter. 154, 495–508.
Xu, H., Chen, K., Jia, X., Tian, Y., Dai, Y., Li, D., Xie, J., Tao, M., et Mao, Y. (2015). L’Utilisation De La Metformine Est Associée À MieuxsUrvivale des Patientes Atteintes D’Un Cancer Du Sein Atteintes De Diabète: Une Méta-Analyse. Théoncologue 20, 1236-1244.
Yam, C., Esteva, F.J., Patel, M.M., Raghavendra, A.S., Ueno, N.T., Moulder, S.L., Hess, K.R., Shroff, G.S., Hodge, S., Koenig, K.H., et al. (2019). Efficacité et innocuité de l’association de la metformine, de l’évérolimus et de l’exémestane chez les patientes ménopausées obèses et en surpoids atteintes d’un cancer du sein métastatique, positif aux récepteurs hormonaux et HER2-négatif: une étude de phase II.Investir. Nouveaux médicaments 37, 345-351.
Yao, H., He, G., Yan, S., Chen, C., Song, L., Rosol, T.J., et Deng, X. (2017). Cancer du sein triple négatif: y a-t-il un traitementà l’horizon? Oncotarget 8, 1913-1924.
Zhang, L., Guo, M., Li, J., Zheng, Y., Zhang, S., Xie, T., et Liu, B. (2015). Découverte basée sur la biologie des systèmes d’un potentiel Atg4Bagonist (Flubendazole) qui induit l’autophagie dans le cancer du sein. Mol. Biosystème.11, 2860–2866.
Zhang, L., Xu, L., Zhang, F. et Vlashi, E. (2017).La doxycycline inhibe le phénotype des cellules souches cancéreuses et la transition épithéliale-mésenchymateuse dans le cancer du sein. Cycle cellulaire Georget. Tex16, 737-745.
Zhang, L., Bochkur Dratver, M., Yazal, T., Dong, K., Nguyen, A., Yu, G., Dao, A., Bochkur Dratver, M., Duhachek-Muggy, S., Bhat, K., et al. (2019a). Le mébendazole Potentialise la radiothérapie dans le cancer du Sein Triple négatif. Int. J. Radiat. Oncol. Biol. Phys. 103, 195–207.
Zhang, Y., Storr, S.J., Johnson, K., Green, A.R., Rakha, E.A., Ellis, I.O., Morgan, D.A.L. et Martin, S.G. (2014). Implication de la metformine et de l’AMPK dans la radioréponse et le pronostic du cancer du sein de type versusbasal luminal traité par radiothérapie. Oncotarget 5, 12936-12949.
Zhang, Z.-J., Yuan, J., Bi, Y., Wang, C. et Liu, Y.(2019b). L’effet de la metformine sur les biomarqueurs et les survivances du cancer du sein – une revue systématique et une méta-analyse d’essais cliniques randomisés. Pharmacol.Rés. 141, 551 à 555.
Zhong, S., Zhang, X., Chen, L., Ma, T., Tang, J., andZhao, J. (2015). Statin use and mortality in cancer patients: Systematic review and meta-analysis of observational studies. Traitement du cancer. Rév. 41, 554-567.
