The COC Protocol™ in Breast Cancer
Dit document is een samenvatting van de grondgedachte en enkele van de huidige wetenschappelijke gegevens die het gebruik van de COC Protocol medicijnen naast standaard-of-care behandelingen voor borstkanker ondersteunen. We begrijpen dat kanker een zeer persoonlijke aandoening is, en elke patiënt heeft een unieke reeks uitdagingen. Neem voor meer informatie over uw persoonlijke situatie contact op met de Care Oncology Clinic op 800-392-1353 in de Verenigde Staten, of bezoek de website onder https://careoncology.com.
Als u voor het eerst oncologie verzorgt, let dan op het volgende:
- u hoeft niet te reizen. U kunt een ontmoeting met ons team van oncologen en oncologie verpleegkundigen via beveiligde video voor voortdurende ondersteuning.
- De care Oncology adjunct protocol medicijnen worden rechtstreeks naar uw huis verzonden vanuit onze Amerikaanse Partnerapotheken en kunnen worden gebruikt naast uw standaard van zorg behandeling.
- we zijn ontzettend trots om aan te kondigen dat we geslaagd zijn voor het uiterst rigoureuze validatieproces van data-analyse, outcome claims en waardeberekening van het Validation Institute. We hebben hard gewerkt om tot dit punt te komen. Al vroeg beseften we de enorme waarde van een op verantwoorde wijze geleverd programma van hergebruikte medicijnen aangeboden aan kankerpatiënten, maar het werd niet op grote schaal aangeboden. Vier jaar geleden wilden we dit veranderen, wetende dat het een marathon was, geen sprint.
De COC-Protocol en borstkanker: de Belangrijkste punten
- De COCProtocol is een combinatie van vier veel voorgeschreven medicijnen(atorvastatine, metformine, mebendazole, en doxycycline) met de potentiële totarget borstkanker en helpen bij het verbeteren van de doeltreffendheid van de standaard anticancertherapies.
- in een aantal observationele studies is het gebruik van metformine of statine gekoppeld om de resultaten bij patiënten met borstkanker te verbeteren.
- laboratoriumonderzoeken naar borstkankercellen die in gerechten worden gekweekt, tonen aan dat metformine en statines direct borstkankercellen kunnen richten en beschadigen – ze verzwakken en hen kwetsbaarder maken voor standaardbehandelingen.
- Resultaten van kleine’ opportuniteit ‘ klinische onderzoeken bij patiënten met operabreastkanker tonen over het algemeen aan dat het gebruik van metformine of statine voorafgaand aan de operatie kan leiden tot potentieel positieve veranderingen in moleculaire markers van kanker, waaronder die welke de groei en deling van borstkanker reguleren. Er worden nog meer onderzoeken uitgevoerd om na te gaan of metformine of statines de reactie op de ziekte kunnen beïnvloeden.
- Doxycycline kan de groei blokkeren van zowel HER2-positieve als triple-negatieve stemcellen van borstkanker, geïncubeerd in gerechten in het lab, en hielp bij het verbeteren van resistentiegerelateerde veranderingen geïnduceerd door de standaard chemotherapie paclitaxel.
- Doxycycline heeft net vroege klinische onderzoeken bij borstkankerpatiënten bereikt. De resultaten van de eerste kleine studie tonen aan dat patiënten met borstkanker in een vroeg stadium die slechts 14 dagen vóór de operatie doxycycline gebruikten, gemiddeld ongeveer 40% minder moleculaire markers voor de aanwezigheid van kankerstamcellen hadden. Bij alle behandelde patiënten op één na werden gunstige effecten waargenomen (8/9).
- Mebendazol kan de groei en verdeling van in het lab geteelde borstkanker cellen vertragen, waaronder borstkanker cellen die resistenter zijn tegen chemotherapie. Er zijn meer menselijke studies nodig.
het COC-Protocol en borstkanker: Gepubliceerd bewijs
Het COC-Protocol is een combinatieregime van vier vaak voorgeschreven geneesmiddelen,elk met bewijs van metabolisch gebaseerde antikankeractiviteit en een goed onderbouwd veiligheidsprofiel. Deze medicijnen zijn: metformine, atorvastatine, doxycycline en Mebendazol. Enkele studies die het gebruik van het COC-Protocol als aanvullende therapie naast huidige standaardbehandelingen voor borstkanker ondersteunen, worden hieronder gepresenteerd. Dit bewijs komt voornamelijk uit laboratoriumstudies, grote epidemiologische studies (die het verband tussen het nemen van medicijnen en de resultaten van borstkanker in groepen van individuen onderzoeken), en earlystage klinische studies.
u kunt merken dat veel van de onderstaande studies alleen gericht zijn op individuele COC-Protocolmedicaties. Wij zijn de eersten die een aanvullende therapie ontwerpen die allfour combineert. We geloven dat het combineren van deze medicijnen de grootste resultaten zal opleveren, en ons eigen onderzoeksprogramma, genaamd METRICS, produceert al meer van het bewijs dat nodig is om dit aan te tonen. U kunt meer lezen over waarom wij geloven dat deze medicijnen zo goed samenwerken om kanker te helpen bestrijden, en over het meetprogramma zelf, in verdere secties hieronder.
metformine en borstkanker
Metforminegebruik in verband met mogelijke voordelen voor borstkanker
veel observatiestudies leveren nu bewijs ter ondersteuning van het gebruik van metformine bij borstkanker. Metformine is gelicenseerd voor de behandeling van type 2-diabetes, en observatiestudies in groepen patiënten met diabetes hebben de neiging aan te tonen dat degenen die metformine nemen betere kansen hebben op een verbeterd resultaat als ze borstkanker ontwikkelen (Aksoy et al., 2013;El-Benhawy and El-Sheredy, 2014; Sonnenblick et al., 2017).Het gebruik van metformine is in verband gebracht met een verbeterde overleving bij patiënten met borstkanker (Kim et al., 2015; Xuet al., 2015), verbeterde respons op de behandeling van borstkanker (Jiralerspong et al ., 2009), en minder kans op het verspreiden van borstkanker andrelapse (Chen et al., 2017;Jacob et al., 2016).
Het is waarschijnlijk dat een deel van het gunstige effect van metformine dat in deze studies wordt gevonden, te wijten is aan het vermogen van metformine om de diabetes en/of het gewicht van een patiënt te verbeteren door glucosespiegels te verlagen, wat kan helpen het risico op het ontwikkelen van borstkanker te verminderen,en de gezondheid van een patiënt te verbeteren en borstkanker aan te pakken als ze dat wel hebben (Hatoum and McGowan, 2015). Maar laboratoriumstudies tonen ook aan dat metformine meer doet dan dit. In feite kan metformine actief direct werken tegen borstkanker, waardoor hun vermogen om energie op te nemen en te gebruiken wordt verminderd en hun vermogen om te groeien, te verspreiden, te overleven en terug te vallen wordt geblokkeerd (Alimova et al., 2009; Hadad et al., 2014; Orecchioni et al., 2015).
verschillende soorten borstkanker vereisen verschillende behandelingen. Trastuzumab, bijvoorbeeld, wordt specifiek gebruikt voor de behandeling van humane epidermale groeifactor receptor 2 (HER2)Positieve borstkanker. Tamoxifen is effectief tegen oestrogeenreceptor (ER)Positieve borstkanker. Belangrijk is dat kankercelstudies in het lab aantonen dat metformine antikankeractiviteit heeft tegen veel verschillende borstkankerceltypes, waaronder ER-positief (Giles et al., 2018), HER2 positief (Chen et al., 2013), en potentieel moeilijker te behandelen subtypes zoals triple-negatieve kankercellen (Deng et al., 2012; Vazquez-Martin et al., 2011; Wahdan-Alaswad et al., 2014).Dit betekent dat metformine effectief kan werken naast standaardbehandeling voor borstkanker, ongeacht het subtype kanker.
Metforminedoelstellingenstamcellen van borstkanker
Metformineis ook aangetoond dat het gericht is op stamcellen van borstkanker (Bao et al., 2014; Cufiet al., 2012; Hirsch et al., 2009).Deze activiteit tegen borstkanker stamcellen, samen met zijn vermogen om verschillende subtypes van borstkanker te targeten, helpen verklaren waarom laboratoriumstudies hoe het kan werken in combinatie met een aantal standaardbehandelingen, waaronder trastuzumab (Cufi et al.,2012), tamoxifen (Ma et al., 2014), enstandard chemotherapie agenten (Iliopoulos et al.,2011). Dier – en celstudies tonen aan dat metformine beide helpt om de effectiviteit van standaardbehandelingen te verbeteren (Bradford and Khan, 2013; Liu et al., 2012; Zhang et al., 2014) en ook vertragingen terugval van kanker die zijn behandeld met deze therapieën (Iliopoulos et al.,2011).
daarnaast tonen laboratoriumstudies ook aan dat metformine ook kan helpen voorkomen dat borstkankercellen resistent worden tegen chemotherapie en de gevoeligheid van reeds resistente kankercellen voor behandeling kan verbeteren (Davies et al., 2017).
Metformineverbetert markers van borstkanker in vroege klinische studies
als gevolg van de grote hoeveelheid ondersteunende gegevens voor metformine in borstkankergegenereerd door observationele en laboratoriumstudies, zijn er nu verschillende klinische onderzoeken gaande naar metformine bij borstkanker (Camacho et al., 2015).Over het geheel genomen beginnen collectieve analyses van de resultaten van deze vroege studies(meta-analyse) een algemeen positief effect te suggereren wanneer metformin wordt toegevoegd aan standaard kankertherapieën (Rahmani etal., 2019; Zhang et al., 2019b).
in een aantal ‘window of opportunity’ – onderzoeken wordt onderzocht of inname van metformine gedurende ongeveer twee weken voorafgaand aan de operatie kan helpen om moleculaire merkers van de ziekte te verbeteren bij patiënten met operabele borstkanker in een vroeg stadium. De resultaten van deze studies wijzen er over het algemeen op dat het gebruik van metformine kan leiden tot potentiëlepositieve veranderingen in moleculaire markers van kanker, waaronder die welke de groei en deling van kankercellen van borstkanker reguleren (Bonanni et al., 2012; Cazzaniga et al., 2013; Hadad et al., 2011; Kalinsky et al., 2014; Niraula etal., 2012), evenals potentieel het verbeteren van de regulatie vanhormonen en andere factoren voor sommige patiënten (Kalinsky et al., 2014; Niraula et al., 2012). Deze studies helpen wetenschappers nu precies te begrijpen hoe en wanneer metformine patiënten met borstkanker zou kunnen helpen (Bonanni etal., 2012; DeCensi et al., 2014, 2015; Rahmani et al., 2019).
Fase2 ‘neoadjuvant’ – onderzoeken zijn over het algemeen langere en complexere onderzoeken waarbij metformine wordt onderzocht naast kuren met standaardbehandelingen om verschillende soorten borstkanker te behandelen. Het doel van deze studies is om vast te stellen ofmetformin echt helpt bij het verbeteren van de effectiviteit van standaard behandelingen, aslab studies suggereren (Kim et al., 2014). In één recent onderzoek (de METTEN-studie) (Martin-Castillo etal., 2018) reageerden bij vrouwen met HER2-Positieve borstkanker in een vroeg stadium meer patiënten die metformine gebruikten goed op chemotherapie/doelbehandeling (65,5%) dan patiënten die geen metformine gebruikten (58,6%). Dit verschil was statistisch niet significant, wat betekent dat dit resultaat bij toeval kon worden bereikt. Echter, Fase 2 Studies zijn over het algemeen ondervermogen voor het bereiken van statistische significantie op deze manier, en de onderzoekers riep voor progressie naar grotere fase 3 studies die goed kan worden ontworpen om te bepalen hoe echt dit effect is (Martin-Castillo etal., 2018). Potentieel bemoedigende resultaten van andere fase 2-Trials, zoals één bij personen met overgewicht met gemetastaseerde borstkankerzijn ook gemeld (Yam et al.,2019). Het is ook vermeldenswaard dat, zoals verwacht, niet allemetformin kankeronderzoeken positieve resultaten hebben gemeld. Andere fase 2-onderzoeken hebben bijvoorbeeld aangetoond dat metformine met standaardtherapie onder bepaalde omstandigheden geen reëel verschil vertoonde in vergelijking met standaardtherapie alleen (Mark et al.,2019; Nanni et al., 2019). Wij geloven datmetformin in om het even welke setting het meest effectief zal zijn wanneer gegeven in combinatie metandere anti-metabolische medicijnen.
Er zijn Groterestudies nodig om deze problemen op te lossen, en er is nu een Fase 3-onderzoek gaande om metformine bij borstkanker te onderzoeken. Hoewel het onderzoek niet tot 2020 moet worden voltooid, toonden de eerste resultaten van de eerste 6 maanden van het onderzoek aan dat patiënten die begonnen met het innemen van metformine onmiddellijk na voltooiing van de operatie en standaardchemotherapiecycli, gunstige veranderingen hadden in een moleculaire marker van borstkanker (Dowling et al., 2018), en verbeterde metabole factoren (Goodwin et al., 2015).
statines en borstkanker
observatiestudies linken statines aan betere resultaten bij borstkanker
statines worden gewoonlijk gegeven om hart-en vaatziekten te helpen beheersen. Echter observatiestudies op grote groepen mensen die statines hebben ook gevonden datindividuals met borstkanker die statines nemen kan ook verminderd risico van hun kanker terugkerende na behandeling, in vergelijking met patiënten die geen statines (Ahern et al., 2014;Manthravadi et al., 2016). Bijvoorbeeld, in onestudy in bijna 2000 overlevenden van borstkanker, degenen die begonnen takingstains binnen drie jaar na de diagnose had een verminderde kans op hun kanker terugkomen (Kwan et al., 2008). In een andere studie werd slechts 6 maanden statinegebruik na diagnose gekoppeld aan verbeterde percentages van terugval (Chae et al., 2011).
belangrijk is dat het gunstige effect van statines in deze en andere studies sterker waslinked tot meer vetoplosbare ‘lipofiele’ statines (zoals atorvastatine). In sommige laboratoriumstudies is ook aangetoond dat lipofiele statines superioranticancer effecten hebben op cellulair niveau in vergelijking met minder in vet oplosbare statines (Liu et al., 2017).
observatiestudies linken ook het gebruik van statine aan een verbeterde reactie op de behandeling en overleving bij patiënten met borstkanker, zelfs bij patiënten met borstkankertypes die agressiever kunnen zijn (Manthravadi et al., 2016; Murtola et al., 2014; Zhong et al., 2015). Bijvoorbeeld, in één studie bij patiënten met inflammatoire borstkanker, had patiënten die atorvastatine gebruikten terwijl ze voor kanker werden behandeld een langere periode voordat hun ziekte vorderde, vergeleken met patiënten die geen statine gebruikten (Brewer et al., 2013).
Statinstart borstkankercellen
statinen,in het bijzonder vetoplosbare lipofiele statinen zoals atorvastatine, verminderen de groei en verdeling van borstkankercellen en verhogen de celdood van borstkanker in laboratoriumstudies
German Diabetes Association”,”page”:”47-48″,”volume”:”111″,”issue”:”1″,”source”:”PubMed”,”abstract”:”the effect of five statines, i.e. atorvastatine fluvastatine, lovastatine, pravastatine en simvastatine werden onderzocht op de proliferatie van de humane borstkankercellijn MCF-7. Alle statines, met uitzondering van pravastatine, waren in staat de celproliferatie tot 90% te remmen bij een concentratie van 50 micro M. tussen de effectieve statines werd geen significant verschil waargenomen dat wijst op een klasse-specifiek effect. Deze gegevens suggereren dat statines klinische significantie kunnen hebben in de primaire preventie van borstkanker bij de mens buiten huncholesterolverlagend effect. Klinische bewijzen moeten echter worden afgewacht voordat verdere conclusies worden getrokken.”, “DOI”:”10.1055/s-2003-37501″, “ISSN”: “0947-7349”, “note”: “PMID: 12605351”, “journalAbbreviation”: “Exp. Clin. Endocrinol.Diabetes”,”language”: “eng”, “author”:, “issued”: {“date-parts”:]}}}], “schema”: “https://github.com/citation-style-language/schema/raw/master/csl-citation.json”} (Alarcon Martinez etal., 2018; Mück et al., 2004; Seeger et al., 2003).Studies tonen ook aan dat statines de invasiviteit van borstkankercellen in het lab kunnen blokkeren, wat suggereert dat ze ook kunnen helpen bij het vertragen van kankerverspreiding naar andere delen van het lichaam (kanugula et al., 2014;Wolfe et al., 2015). In een muismodel van gemetastaseerde borstkanker vertraagde statenbehandeling de groei van kanker die zich al had verspreid met maximaal 80%, met gunstige activiteit genoteerd binnen een week na het starten van de behandeling (Vintonenko et al.,2012).
andere studies tonen ook aan dat statines borstkankercellen kunnen sensibiliseren om radiotherapie en chemotherapie te ondergaan (Kozar et al., 2004; van Wyhe et al., 2017). Eén studie vondstimvastatine kon triple-negatieve of inflammatoire borstkankercellen sensibiliseren tot radiotherapie in het lab. Dezelfde studie ging verder om in een patientpopulatie waar te nemen dat vrouwen met inflammatoire borstkanker die statines tijdens hun behandeling hadden minder kans dat hun kanker terug te komen binnen 3 jaar (Lacerda et al., 2014).
vergelijkbaar met metformine kunnen statines deze antikankereffecten veroorzaken bij verschillende typen borstkanker, waaronder er-positieve, HER2-positieve en triple-negatieve borstkanker. In feite tonen sommige lab studies statines zijn bijzonder effectief tegen triple-negatieve borstkanker cellen (Campbell et al., 2006; Yao et al., 2017).
klinische trials die statines bij borstkanker onderzoeken zijn nu aan de gang
een klinisch onderzoek in een klein stadium toont nu robuust positieve resultaten in termen van statines bij borstkanker. Vroege fase’ window of opportunity ‘ studies hebben onderzocht of vroege, pre-chirurgische statines kunnen helpen om molecularmarkers van de ziekte bij patiënten met operabele ziekte te verbeteren. Tot nu toe tonen deze studies verbeterde moleculaire kankerprofielen bij patiënten met statinebehandeling,wat suggereert dat atorvastatine en andere statines in deze context gunstige effecten kunnen hebben op de groei en verdeling van kankercellen en celdood, zelfs bij vrouwen met hooggradige agressievere tumoren (Bjarnadottir et al., 2013, 2015; Feldt et al., 2015; Garwood et al., 2010).
Op basis van deze veelbelovende resultaten zijn er nu een aantal Fase 2-studies aan de gang waarin wordt gekeken naar de functiestatines voor een verscheidenheid aan verschillende soorten borstkanker, waaronder drievoudig-negatieve borstkanker. Deze studies moeten helpen vaststellen hoe statines patiënten met borstkanker kunnen helpen.
Mebendazol en borstkanker
interesse in Mebendazol als een mogelijke behandeling tegen kanker is meestal gebaseerd op veelbelovende mechanistischestudies en overtuigende rapporten uit casestudies bij kankerpatiënten (Nygren and Larsson,2014; Pantziarka et al., 2014).
Mebendazol wordt verondersteld kankercellen gedeeltelijk te doden door het verstoren van speciale structuren in de cel, genaamd microtubuli (Pantziarka et al.,2014). Het werkt op een vergelijkbare manier als vincristine, achemotherapiedrug die momenteel wordt gebruikt voor de behandeling van sommige soorten kanker,waaronder gevorderde borstkanker (De Witt et al., 2017).
studies over in het laboratorium geteelde borstkanker tonen aan dat Mebendazol en verwante geneesmiddelen uit dezelfde klasse (benzimidazolen genoemd) de groei en verdeling van verschillende soorten borstkanker cellen kunnen vertragen, waaronder cellen die resistent zijn tegen emotherapie (Coyne et al., 2013;Hou et al., 2015; Mukhopadhyay et al., 2002). In één studie verminderde Mebendazol de overleving van chemotherapie-resistantbreast kankercellen met maar liefst 63,1% (Coyne et al., 2013).Studies hebben ook aangetoond robuuste antikankeractiviteit van benzimidazolen tegen triple-negatieve borstkanker (Hou et al., 2015;Zhang et al., 2015). Belangrijk is dat in één studie een benzimidazole ook werd gebruikt om de stamcellen van borstkanker direct te richten (Hou et al., 2015).
opkomende Laboratoriumgebaseerde gegevens suggereren ook dat benzimidazolen de werkzaamheid van standaardbehandelingen voor borstkanker zoals doxorubicine en fluorouracil (Hou et al., 2015). In een laboratoriumstudie, Mebendazol verhoogde de effectiviteit van bestralingstherapie ontriple-negatieve borstkanker cellen, en verhinderde resistentie tegen behandelingontwikkeling (Zhang et al., 2019a). Bovendien toonde een reeks studies met behulp van chemotherapieresistente er/HER2 positieve borstkankercellen die in het lab werden gekweekt,consequent aan dat Mebendazol niet alleen de overleving van kankercellen verminderde,maar ook hielp om de activiteit van speciaal ontwikkelde gerichte vormen van borstkanker chemotherapiemedicijnen epirubicine en gemcitabine (Coyne et al., 2014,2012, 2013).
Doxycycline en borstkanker
Asidefoordat doxycycline een effectief antibioticum is, bezit het ook andere uiterst waardevolle eigenschappen, waaronder ontstekingsremmende en antikankeractiviteit. Dit geeft doxycycline echt therapeutisch potentieel bij de behandeling van een reeks andere ziekten, waaronder kanker (Bahrami et al., 2012).
laboratoriumstudies en dierstudies hebben lang aangetoond dat doxycycline de celgroei, deling en beweging van borstkankercellen kan blokkeren (Duivenvoorden et al., 2002; Fife and Sledge, 1995, 1998).Meer recente studies tonen ook aan dat doxycycline kan voorkomen dat kankercellen hun DNA herstellen wanneer het beschadigd raakt, bijvoorbeeld door chemotherapie (Peiris-Pagès et al.,2015). Inderdaad, lab studies tonen aan dat doxycycline kan helpen verbeteren van de effectiviteit van chemotherapie activiteit tegen borstkanker cellen (Foroodi et al., 2009;Lamb et al., 2015a).
het meest recent is de focus gedaald op het begrijpen van hoe doxycycline de groei van stamcellen van borstkankercellen kan blokkeren (ozsvari etal., 2017; Zhang et al., 2017). Avery recente studie op cellen gekweekt in het lab heeft aangetoond dat doxycycline de groei van zowel HER2 positieve als triple-negatieve borstkanker stemcellen kan blokkeren, en hielp om weerstand-gerelateerde veranderingen geïnduceerd door de standaardchemotherapie paclitaxel (Lin et al.,2018). In een ander laboratoriumonderzoek, een combinatorische benadering met inbegrip van doxycycline zeer effectief uitgeroeid borstkanker stamcellen (Fiorillo etal., 2019).
Doxycycline heeft net vroege klinische onderzoeken bij borstkankerpatiënten bereikt. De resultaten van de eerste kleine studie, gepubliceerd in oktober 2018, tonen aan dat patiënten met vroeg stadium borstkanker die doxycycline voor slechts 14 dagen vóór de operatie namen, de niveaus van moleculaire markers voor aanwezigheid van kankerstamcellen verminderden met een gemiddelde van ongeveer 40%. Gunstige effecten werden waargenomen bij alle behandelde patiënten op één na (8/9) (Scatena et al., 2018).Grotere klinische proeven zijn nu aan de gang.
ons eigen bewijs: de METRICS studie
Wat is METRICS?
METRICS is ons eigen in-houseresearch programma. Er is al veel bekend over de veiligheid en effectiviteit van het COC-Protocol medicijnen bij kanker. Maar het is ook onze verantwoordelijkheid om te erkennen dat we niet alle antwoorden hebben, en dat we nog steeds goed klinisch onderzoek moeten genereren naar het COCProtocol bij kankerpatiënten, om ervoor te zorgen dat het COC-Protocol zo effectief en veilig mogelijk is.
om ons in staat te stellen dit onderzoek te financieren, hebben we een nieuw, betaalbaar systeem ontwikkeld waarin onze klinische studie, METRICS, hoofdzakelijk door de patiënt wordt gefinancierd. Elke toestemmende patiënt die de kliniek binnenkomt wordt ingeschreven voor statistieken, en deze kosten helpen om de studie te financieren. Dit is een nieuw model van klinisch onderzoek, gericht op het overbruggen van de financiering en gegevens gaps die momenteel de herbestemming en verdere klinische ontwikkeling van reeds toegelaten medicijnen belemmeren.
METRICS eerste resultaten
in een eerste succesformetrics werden de resultaten van onze eerste pilotstudie onlangs gepubliceerd in het wetenschappelijk tijdschrift Frontiers in Pharmacology. Het papier kan hier gratis online worden geraadpleegd.
De METRICS pilot studie was een observationele retrospectieve studie, wat betekent dat onze onderzoekers keken terug en analyseerde patiënt klinische records om uit te vinden wat er gebeurde. Ze verzamelden gegevens en registreerden de resultaten van 95 patiënten met een gevorderd type hersenkanker, glioblastoom genaamd, die naar de zorg-Oncologiekliniek gingen en die naast hun gebruikelijke standaardbehandelingen het volledige COC-Protocol volgden. Deze studie had geen controlegroep, dus vergeleken onze onderzoekers de resultaten van METRICS met eerder gepubliceerde resultaten van eerdere studies bij patiënten met hetzelfde type kanker, en die ook standaard-of-care behandelingen namen. de eerste resultaten wijzen erop dat patiënten die onze kliniek bezochten en het COC-Protocol gebruikten als onderdeel van hun persoonlijke zorg, veel meer kans hadden om ten minste 2 jaar te overleven (64.0% van de patiënten in onze studie overleefde ten minste 2 jaar, vergeleken met 27-29% voor patiënten opgenomen in eerder gepubliceerde studies), en de neiging om langere overlevingstijden over het algemeen dan normaal zou worden verwacht voor patiënten met dit type van kanker (patiënten overleefden een gemiddelde van 27 maanden in onze studie, vergeleken met 15-16 maanden in eerdere studies)(agrawalet al., 2019).
deze resultaten zijn uiterst positief, maar zijn ook nog preliminair. We weten nog niet precies hoe het COC-Protocol bijvoorbeeld de overlevingstijden heeft beïnvloed, of hoe andere factoren, zoals bepaalde patiëntkenmerken, deze resultaten ook hebben beïnvloed. Maar dit eerste, eerste bewijs is zeker bemoedigend, en het suggereert ons dat we de goede kant op gaan. Onze volgende fase is om een grotere, goed ontworpen studie uit te voeren. U kunt meer te weten komen over toekomstige METRICS plannen door online te kijken of contact op met de kliniek.
meer over het COC-Protocol
Wat is het COC-Protocol?
het COC-Protocol is een combinatiebehandelingsschema dat bestaat uit gelicentieerde geneesmiddelen, specifiek ontworpen door Care Oncology voor aanvullend gebruik naast de gebruikelijke behandelingen van een patiënt (d.w.z. standaardzorg).
De vier geneesmiddelen die in het COC-Protocol zijn opgenomen, zijn: metformine, een zeer veelvoorkomend geneesmiddel tegen diabetes; atorvastatine, een type statine dat wordt gebruikt om cardiovasculaire aandoeningen te behandelen; doxycycline, een type antibioticum dat vaak wordt gebruikt om chronische infecties zoals acne te behandelen; en Mebendazol, een geneesmiddel dat vaak wordt gebruikt om parasietinfecties bij kinderen en volwassenen te behandelen.
We kozen deze vier onderzoeken uit duizenden potentiële kandidaten, specifiek omdat ze voldoen aan onze vooraf vastgestelde selectiecriteria. Deze criteria omvatten solide bewijs van doeltreffendheid tegen kanker, een coherent werkingsmechanisme en, in belangrijke mate, een goed veiligheidsprofiel. Deze drie centrale leerstellingen hebben onze aanpak vanaf het allereerste begin gevormd.
veiligheid is van het grootste belang
kanker is een complexe ziekte met complexe behandelingen, en wij zijn van mening dat de toevoeging van verdere therapieën naast standaardbehandelingen zeer zorgvuldig moet worden geëvalueerd. Niet alleen vanuit het oogpunt van effectiviteit, maar ook, wat belangrijk is, vanuit het oogpunt van veiligheid. Daarom is onze hele aanpak gebaseerd op bewijs – meestal gepubliceerde wetenschappelijke studies, en ook, in toenemende mate, onze eigen gegevens.
veel verschillende geneesmiddelen op de markt hebben op zijn minst enkele gepubliceerde bewijzen die hun relatief effectief gebruik bij kanker ondersteunen, maar weinig van deze geneesmiddelen hebben het niveau van bewijs van zowel veiligheid als doeltreffendheid dat vereist is voor het CVC-Protocol. Er bestaan al grote hoeveelheden gedetailleerde gegevens voor elk van de protocolmedicijnen, verzameld door jaren gebruik in de algemene bevolking – en dit hielp ons een cruciale voorsprong te geven tijdens de ontwikkeling.
we hebben zorgvuldig gezocht door tientallen jaren van gepubliceerde gegevens over elk van de CoC-Protocolmedicijnen, om te onderzoeken hoe ze werken bij verschillende patiëntenpopulaties (inclusief patiënten met kanker), en op cel-en diermodellen in het lab. Deze gegevens, samen met onze eigen klinische ervaring, helpen ervoor te zorgen dat we een goed begrip hebben van hoe deze medicijnen zich zullen gedragen bij patiënten met verschillende stadia en soorten kanker, zowel in combinatie met elkaar als ook in combinatie met tal van andere kankertherapieën. Deze kennis is zeldzaam, en uit onze studies, is dit soort bewijs gewoon nog niet beschikbaar voor vele andere off‑label geneesmiddelen tegen kanker kandidaten – vooral wanneer gegeven in combinatie.
Anantimetabole therapie die mogelijk gericht kan zijn op elke vorm van kanker
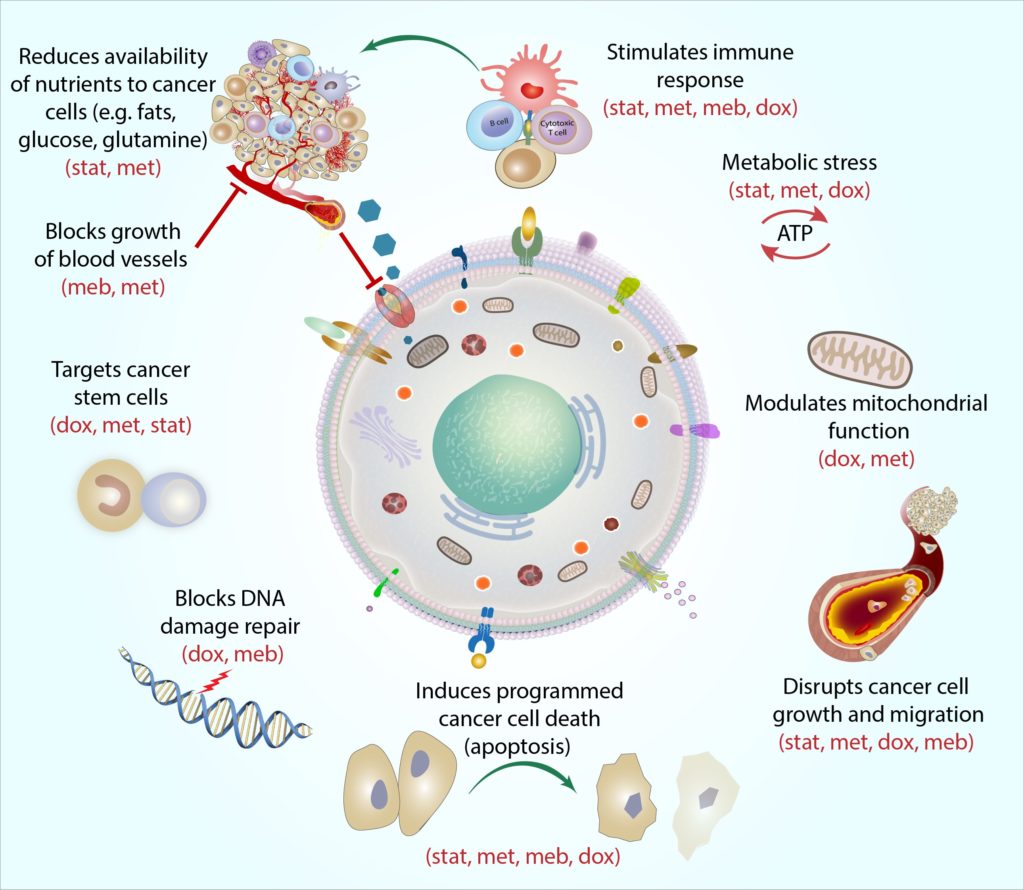
Het COC-Protocol is ontworpen om te werken door het algemene vermogen van kankercellen om energie op te nemen en te gebruiken (d.w.z. ‘metaboliseren’) te beperken.
kankercellen hebben enorme hoeveelheden energie nodig om te overleven, en de overgrote meerderheid van de kankers maakt gebruik van een adaptief proces dat aërobe glycolyse wordt genoemd om de overmatige energie te genereren die ze nodig hebben (Kroemer andPouyssegur, 2008). Elk van de medicijnen in het protocol kan zich richten op deverschillende moleculaire metabole processen betrokken bij en omringende aerobicglycolyse, en dit kan helpen verlagen van de totale stofwisseling van de kankercel (Jang et al.,2013).
wij geloven dat de Cocprotocolmedicijnen in combinatie kunnen werken om de energievoorziening en het gebruik consequent te beperken, terwijl tegelijkertijd wordt voorkomen dat kankercellen zich aanpassen en andere wegen gebruiken om energie op te nemen (Jagust et al.,2019). Als gevolg daarvan worden kankercellen steeds zwakker en minder in staat om de voedingsstoffen op te nemen en te gebruiken (bijv. zoals glucose en essentiële aminozuren glutamine en arginine) die ze nodig hebben uit hun omgeving (Andrzejewskiet al., 2018; Liu et al., 2016).Dit maakt het moeilijker algemeen voor kankercellen om te overleven, te groeien, en spreaddin het lichaam. Geleidelijk aan, de verzwakte cellen (met inbegrip van meer veerkrachtige en eerdere behandeling – resistente cellen) meer kwetsbaar voor aanval van andere cel‑doden kanker therapieën zoals radiotherapie,chemotherapie, hormonale therapie, en gerichte therapieën (Bradford andKhan, 2013; Chen et al., 2012; Lacerda et al., 2014; Lamb et al., 2015a;Pantziarka et al., 2014).
door zich te richten op de aangepaste metabole mechanismen die gebruikelijk zijn voor de meeste kankers(maar meestal niet gezonde cellen), zijn wij van mening dat het COC-Protocol effectief en selectief kan zijn voor vrijwel elke vorm van kanker,ongeacht het specifieke type, Stadium of locatie van kanker. Gepubliceerde epidemiologische en laboratoriumstudies ondersteunen steeds meer het potentieel brede scala van deze therapie (Chae et al., 2015, 2016; Iliopoulos et al., 2011; Lamb et al., 2015b; Pantziarka et al.,2014).
mechanistische samenhang in actie – de kracht van combinatie
de ware kracht van het COC-Protocol ligt in de specifieke combinatie van geneesmiddelen die we gebruiken. We ontwikkelden het protocol niet alleen als een regime van vier individuele behandelingen elk met antikankeractiviteit, maar ook om te werken als een enkele gecombineerde behandeling-met het potentieel om krachtige synergetische effecten te produceren (Mokhtari et al., 2017).
elke medicatie in het COC-Protocol richt zich op het metabolisme van kankercellen op een aparte en complementaire manier, en we hebben deze actie ‘mechanistische samenhang’genoemd. Simpel gezegd beschrijft mechanistische samenhang hoe elk medicijn de kankercel vanuit een andere hoek kan aanvallen. Zo zijn kankerstamcellen een bijzonder veerkrachtig type kankercel, en elk medicijn richt zich op deze cellen op een andere manier: metformine richt zich op de ‘batterijen’ van de cel (genoemd mitochondriën) door het erg moeilijk te maken voor mitochondriën om de moleculaire handelingen uit te voeren die ze nodig hebben om energie te produceren, blokkeert doxycycline de cel-DNAmachinery die mitochondriën nodig hebben om te repliceren en te herstellen (Skoda et al., 2019), statinscan de genuitdrukking van de kankerstamcel veranderen, die de cellen gevoeliger maken voor andere kankertherapieën (Kodach et al., 2011), andmebendazole kan talrijke moleculaire processen betrokken bij celldivision onderbreken om de celgroei van de kankerstam te helpen blokkeren (Hothi et al., 2012; Hou et al., 2015).
door alle vier stoffen samen te combineren, kan het COC-Protocol kankerstamcellen (en andere kankercellen) raken op meerdere ‘zwakke plekken’, en als een één-twee punch, laat dit de cellen minder in staat om te ontwijken en te herstellen.
laboratoriumstudies beginnen de effectiviteit van deze aanpak te benadrukken door gebruik te maken van Cocprotocolmedicatiecombinaties. In één mechanistische studie, het combineren van statinand metformine sterk verminderde de groei van prostate kankercellen meer dan ofwel agent alleen (Wang et al., 2017). Observationele studies hebben ook potentieel ‘synergetische’ effecten van deze geneesmiddelen tegen verschillende vormen van kanker (Babcook etal., 2014; Danzig et al., 2015; Lehman et al., 2012; Nimako et al., 2017). Een klinische studie waarin metformine en doxycycline bij borstkanker worden onderzocht, is nu ondergrond (NCT02874430), en ons eigen onderzoeksprogramma, METRICS, begint nu ook veelbelovende gegevens te produceren.
een langetermijn adjuvante therapie
Het COC-Protocol is primair ontworpen als een langetermijn ‘adjuvante’ therapie, om standaardbehandelingen te optimaliseren. Aangezien metabole behandeling met het COCProtocol echter bedoeld is voor een langdurige behandeling, kunnen patiënten het protocol ook gebruiken als onderhoudsregime nadat de standaardbehandeling is voltooid of tijdens onderbrekingen van de standaardbehandeling en als onderdeel van een langetermijnstrategie om het risico op recidieven of metastasen te verminderen. Om deze reden is het ook vermeldenswaard dat elk van de COC-Protocolmedicijnen ook gunstige mechanismen voor de werking van kanker heeft gemeld die niet afhankelijk zijn van de gelijktijdige toediening van standaardtherapieën, en die onafhankelijk kunnen bijdragen aan het verminderen van het risico op terugval enmetastatische verspreiding.
het Care Oncology model
actieve medische supervisie van elke patiënt
hoewel de cocprotocolmedicijnen gedurende vele jaren veilig zijn gebruikt in de algemene populatie, is elke patiënt die bij ons komt uniek. Dit is de reden waarom elke patiënt die aanwezig is bij de zorg oncologie kliniek wordt geplaatst onder de directe zorg van klinieken met specialistische kennis van het voorschrijven van het COC-Protocol medicijnen in hetcontext van kanker. Onze clinici beoordelen individueel de potentiële voordelen en risico ‘ s van het gebruik van het COC-Protocol bij elke patiënt. Zij zullen het COC-Protocol alleen aan patiënten aanbevelen wanneer zij geloven dat het veilig en voordelig is om dit te doen. Elk COC-Protocol recept is afgestemd op de behoeften van de patiënt, en doses en schema ‘ s worden zorgvuldig beoordeeld en aangepast op basis van hoe de patiënt vordert.
Het is daarom van essentieel belang dat patiënten alleen het COC-Protocol innemen terwijl ze gedurende de duur van hun behandeling zorgvuldig worden gecontroleerd in onze kliniek.
*********************************************************************************
Belangrijk
Doel van dit artikel
Thisarticle is een overzicht van een aantal van de wetenschappelijke en medische publishedliterature over de medicijnen die bestaat uit de gepatenteerde Care Oncologyprotocol. Er is zorg besteed aan het selecteren van relevante artikelen ter ondersteuning van het off-label gebruik van deze geneesmiddelen in een klinische setting voor de bijkomende behandeling van kanker. Dit artikel pretendeert niet om een uitgebreide beoordeling van al het bewijsmateriaal te zijn, noch legt het alle potentiële bijwerkingen van een dergelijke behandeling vast.
Dit artikel dient uitsluitend ter informatie en vormt geen medisch advies. De hierin besproken geneesmiddelen zijn alleen op recept verkrijgbaar en mogen niet worden ingenomen zonder overleg met uw arts of andere professionele zorgverlener. Zorg oncologie artsen zullen de geschiktheid van deze geneesmiddelen met u bespreken en zullen in overleg met uw arts of oncoloog hun geschiktheid voor u bespreken.
u moet niet vertrouwen op de informatie in dit artikel als alternatief voor medisch advies van uw arts of andere professionele zorgverlener. Als u enige specifieke vragen over een medische kwestie moet u uw arts of andere professionele zorgverlener te raadplegen. Als u denkt dat u kan lijden aan een medische aandoening moet u onmiddellijk medische hulp inroepen. U moet nooit wachten met het zoeken naar medisch advies, medisch advies negeren, of doorgaan met de medische behandeling als gevolg van de informatie in dit artikel.
Copyright
Het auteursrecht in dit artikel is eigendom van Health Clinics LLC en zijn licentiegevers.
octrooi
Het Protocol voor Zorgoncologie(“COC”) wordt beschermd door het Amerikaanse octrooi US9622982B2 en door verschillende aanvullende internationale octrooien.
*********************************************************************************
Agrawal,S., Vamadevan, P., Mazibuko, N., Bannister, R., Swery, R., Willems, S., andEdwards, S. (2019). Een nieuwe methode voor ethisch en efficiënt bewijs Generatievoor Off-Label medicatiegebruik in oncologie (een Case Study in Glioblastoma). Voorkant.Farmacol. 10.
Ahern, T. P., Lash, T. L., Damkier, P., Christiansen, P. M., and Cronin-Fenton, D. P. (2014). Statines en borstkanker prognose: bewijs en kansen. Lancet Oncol. 15, e461-468.
Aksoy, S., Sendur, M. A. N., en Altundag, K. (2013).Demografische en klinisch-pathologische kenmerken bij patiënten met invasivebreastkanker die metformine krijgen. Med. Oncol. Northwood Lond. Engl. 30, 590.
Alarcon Martinez, T., Zeybek, N. D., en Müftüoğlu, S. (2018). Evaluatie van de cytotoxische en Autofagische effecten van atorvastatine op MCF-7 borstkankercellen. Balk. Med. J. 35, 256-262.
Alimova, I. N., Liu, B., Fan, Z., Edgerton, S. M., Dillon, T., Lind, S. E., and Thor, A. D. (2009). Metformine remt de groei van kankercellen in de borst, de vorming van kolonies en induceert in vitro het stoppen van de celcyclus. Celcyclus 8, 909-915.
Andrzejewski, S., Siegel, P. M., en St-Pierre, J. (2018). Metabole profielen geassocieerd met metformine werkzaamheid bij kanker. Voorkant.Endocrinol. 9.Babcook, M. A., Shukla, S., Fu, P., Vazquez, E. J., Puchowicz, M. A., Molter, J. P., Oak, C. Z., MacLennan, G. T., Flask, C. A., Lindner, D. J., et al. (2014). Synergetische simvastatine en metformine combinatiechemotherapie voor Osseous gemetastaseerde castratie-resistente prostaatkanker. Mol.Kanker Er. 13, 2288–2302.
Bahrami, F., Morris, D. L., and Pourgholami, M. H. (2012). Tetracyclines: geneesmiddelen met een enorm therapeutisch potentieel. Mini Rev.Med.Scheikunde. 12, 44–52.
Bao, B., Azmi, A. S., Ali, S., Zaiem, F., en Sarkar, F. H. (2014). Metformine kan als anti-kankeragent via het richten van kankercellen functioneren: de potentiële biologische betekenis van tumor-geassocieerde miRNAs inbreast en alvleesklierkanker. Anne. Transl. Med. 2.
Bjarnadottir, O., Romero, Q., Bendahl, P.-O., Jirström, K., Rydén, L., Loman, N., Uhlén, M., Johannesson, H., Rose, C., Grabau, D., etal. (2013). Gericht op HMG-CoA reductase met statines in een window-of-opportunitybreast cancer trial. Breast Cancer Res.Treat. 138, 499–508.
Bjarnadottir, O., Kimbung, S., Johansson, I., Veerla, S., Jönsson, M., Bendahl, P.-O., Grabau, D., Hedenfalk, I., en Borgquist, S. (2015). Globale transcriptionele veranderingen na statine behandeling bij borstkankerpatiënten. Clin. Cancer Res.Uit. J. Am. Assoc. Cancer Res. 21, 3402-3411.
Bonanni, B., Puntoni, M., Cazzaniga, M., Pruneri, G., Serrano, D., Guerrieri-Gonzaga, A., Gennari, A., Trabacca, M. S., Galimberti, V., Veronesi, P., et al. (2012). Dubbel effect van metformine op borstkankerproliferatie in een gerandomiseerde prechirurgische studie. J. Clin. Oncol. Van. J. Am.Soc. Clin. Oncol. 30, 2593–2600.
Bradford, S. A., en Khan, A. (2013). Individualisingchemotherapy using the Anti-diabetische Drug, Metformin, as an â €  Œadjuvantã¢Â€ ¢: AnExploratory Study. J. Cancer Sci. Ther. 5.
Brewer, T. M., Masuda, H., Liu, D. D., Shen, Y., Liu, P., Iwamoto, T., Kai, K., Barnett, C. M., Woodward, W. A., Reuben, J. M., et al.(2013). Statine gebruik bij primaire inflammatoire borstkanker: een cohort studie. Br.J. Cancer 109, 318-324.
Camacho, L., Dasgupta, A., en Jiralerspong, S. (2015). Metformine bij borstkanker-een evoluerend mysterie. Breast Cancer res. BCR 17, 88.Campbell, M. J., Esserman, L. J., Zhou, Y., Shoemaker, M., Lobo, M., Borman, E., Baehner, F., Kumar, A. S., Adduci, K., Marx, C., etal. (2006). Preventie van borstkanker door statines. Cancer Res.66,8707–8714.Cazzaniga, M., DeCensi, A., Pruneri, G., Puntoni, M., Bottiglieri, L., Varricchio, C., Guerrieri-Gonzaga, A., Gentilini, O. D., Pagani, G., Dell ‘ Orto, P., et al. (2013). Het effect van metformine op apoptosis in een borstkankeronderzoek. Br. J. Cancer 109, 2792-2797.
Chae, Y. K., Valsecchi, M. E., Kim, J., Bianchi, A. L., Khemasuwan, D., Desai, A., and Tester, W. (2011). Verminderd risico op borstkanker bij patiënten die ACE-remmers, ARB ‘ s en/of statines gebruiken. Kankerinvest. 29, 585–593.
Chae, Y. K., Yousaf, M., Malecek, M.-K., Carneiro, B., Chandra, S., Kaplan, J., Kalyan, A., Sassano, A., Platanias, L. C., and Giles, F. (2015). Statines als anti-kanker therapie; Kunnen we preclinical andepidemiologische data vertalen naar klinisch voordeel? Discov. Med. 20, 413–427.
Chae, Y. K., Arya, A., Malecek, M.-K., Shin, D. S., Carneiro, B., Chandra, S., Kaplan, J., Kalyan, A., Altman, J. K., Platanias, L., et al. (2016). Herbestemming van metformine voor kankerbehandeling: huidige klinische studies. Op doel 7, 40767-40780.Chen, J., Lan, T., Hou, J., Zhang, J., An, Y., Tie, L., Pan, Y., Liu, J., and Li, X. (2012). Atorvastatine sensibiliseert humannon-kleincellige longcarcinomen voor carboplatine via onderdrukking van AKT-activatie en upregulatie van TIMP-1. Int. J. Biochem. Cel Biol. 44, 759–769.
Chen, L., Chubak, J., Boudreau, D. M., Barlow, W. E., Weiss, N. S., and Li, C. I. (2017). Diabetes behandelingen en risico ‘ s van AdverseBreast kanker uitkomsten bij vroege stadium borstkanker patiënten: een ziener-Medicareanalyse. Cancer Res. 77, 6033-6041.
Chen, T., Liang, Y., Feng, D., Tao, L., Qi, K., Zhang, H., Wang, H., Lin, Q., and Kong, H. (2013). Metformine remt de proliferatie en bevordert apoptose van HER2-positieve borstkankercellen door downregulatingHSP90. J. BUON uit. J. Balk. Union Oncol. 18, 51–56.
Coyne, C., Jones, T., And Bear, R. (2014).Anti-neoplastische cytotoxiciteit van Gemcitabine-(C4 – amide)-inDual-combinatie met epirubicine-(C3 – amide)-tegen chemotherapeutisch-resistent Borstadenocarcinoom (SKBr-3) en het complementaire Effect van Mebendazol. J. Cancer Res. Oncol. 2.
Coyne, C. P., Jones, T., and Bear, R. (2012). Influenceof alternatieve Tubulineremmers op de potentie van aepirubicine-Immunochemotherapeutische gesynthetiseerd met een Ultra VioletLight-geactiveerd intermediair. Kanker Clin. Oncol. 1, 49–80.
Coyne, C. P., Jones, T., And Bear, R. (2013).Gemcitabine-(C4-amide)- Anti-Neoplastic Cytotoxicity in DualCombination with Mebendazole against Chemotherapeutic-Resistant MammaryAdenocarcinoma. J. Clin. Exp. Oncol. 2.
Cufi, S., Corominas-Faja, B., Vazquez-Martin, A.,Oliveras-Ferraros, C., Dorca, J., Bosch-Barrera, J., Martin-Castillo, B., andMenendez, J.A. (2012). Metformin-induced preferential killing of breast cancerinitiating CD44+CD24-/low cells is sufficient to overcome primary resistance totrastuzumab in HER2+ human breast cancer xenografts. Oncotarget 3, 395–398.
Danzig, M.R., Kotamarti, S., Ghandour, R.A., Rothberg, M. B., Dubow, B. P., Benson, M. C., Badani, K. K., and McKiernan, J. M. (2015).Synergisme tussen metformine en statines bij het wijzigen van het risico op biochemisch optreden na radicale prostatectomie bij mannen met diabetes. ProstateCancer Prostatic Dis. 18, 63–68.Davies, G., Lobanova, L., Dawicki, W., Groot, G., Gordon, J. R., Bowen, M., Harkness, T., and Arnason, T. (2017). Metformine verhindert de ontwikkeling en bevordert de resensibilisatie van behandelingsresistente borstkanker. PLoS ONE 12.de Witt, M., Gamble, A., Hanson, D., Markowitz, D., Powell, C., Al Dimassi, S., Atlas, M., Boockvar, J., Ruggieri, R., and Symons, M. (2017). Herbestemming Mebendazol als vervanging voor Vincristine voor debehandeling van hersentumoren. Mol. Med. 23, 50–56.DeCensi, A., Puntoni, M., Gandini, S., Guerrieri-Gonzaga, A., Johansson, H. A., Cazzaniga, M., Pruneri, G., Serrano, D., Schwab, M., Hofmann, U., et al. (2014). Differentiële effecten van metformineop proliferatie van borstkanker volgens markers van insulineresistentie en subtype tumor in een gerandomiseerde prechirurgische studie. Breast Cancer Res.Treat. 148,81–90.DeCensi, A., Puntoni, M., Guerrieri-Gonzaga, A., Cazzaniga, M., Serrano, D., Lazzeroni, M., Vingiani, A., Gentilini, O., Petrera, M., Viale, G., et al. (2015). Effect van metformine op in Situ-proliferatie van Ductalcarcinoom in een gerandomiseerde prechirurgische studie. Kanker Eerder.Res. Phila. Pa 8, 888-894.
Deng, X.-S., Wang, S., Deng, A., Liu, B., Edgerton, S. M., Lind, S. E., Wahdan-Alaswad, R., and Thor, A. D. (2012). Metformine targetsStat3 om de celgroei te remmen en apoptose te induceren bij drievoudige-negatieve borstkankerpatiënten. Celcyclus Georget. Tex 11, 367-376.
Dowling, R. J., Parulekar, W. R., Gelmon, K. A., Shepherd, L. E., Virk, S., Ennis, M., Mao, F., Ligibel, J. A., Hershman, D. L., Rastogi, P., et al. (2018). CA15-3 / MUC1 in CCTG MA-32 (NCT01101438): een phaseIII RCT van het effect van metformine vs.placebo op invasieve ziektevrije enoverall survival in een vroeg stadium van borstkanker (BC). J. Clin. Oncol.
Duivenvoorden, W. C. M., Popović, S. V., Lhoták, S., Seidlitz, E., Hirte, H. W., Tozer, R. G., and Singh, G. (2002). Doxycycline vermindert tumorburden in een botmetastasemodel van borstkanker bij de mens. Cancer Res. 62,1588-1591.
El-Benhawy, S. A., En El-Sheredy, H. G. (2014).Metformine en overleving bij diabetespatiënten met borstkanker. J. Egypte.Volksgezondheid Assoc. 89, 148–153.Feldt, M., Bjarnadottir, O., Kimbung, S., Jirström, K., Bendahl, P.-O., Veerla, S., Grabau, D., Hedenfalk, I., en Borgquist, S. (2015). Statin-veroorzaakte anti-proliferative gevolgen via cyclin D1 en p27 in de proef van de vendow-van-kansborst kanker. J. Transl. Med. 13, 133.
Fife, R. S., and Sledge, G. W. (1995). Effecten van doxycycline op in vitro groei, migratie en gelatinase-activiteit van borstcarcinoomcellen. J. Lab. Clin. Med. 125, 407–411.
Fife, R. S., and Sledge, G. W. (1998). Effecten van doxycycline op kankercellen in vitro en in vivo. ADV. Dent. Res. 12, 94-96.
Fiorillo, M., Tóth, F., Sottia, F., en Lisanti, M. P. (2019). Doxycycline, Azithromycin en vitamine C (DAV): een krachtige combinatietherapie voor mitochondriën en het uitroeien van kankerstamcellen (CSCS).Ouder worden 11, 2202-2216.
Foroodi, F., Duivenvoorden, W. C., and Singh, G. (2009). Interacties van doxycycline met chemotherapeutische middelen in humanbreast adenocarcinoom MDA-MB-231 cellen. Tegen kanker. Drugs 20, 115-122.
Garwood, E. R., Kumar, A. S., Baehner, F. L., Moore, D. H., Au, A., Hylton, N., Flowers, C. I., Garber, J., Lesnikoski, B.-A., Hwang, E. S., et al. (2010). Fluvastatine vermindert proliferatie en verhoogt apoptose bij vrouwen met kanker met een hoge graad van borstkanker. Breast Cancer Res.Treat. 119, 137–144.
Giles, E. D., Jindal, S., Wellberg, E. A., Schedin, T., Anderson, S. M., Thor, A. D., Edwards, D. P., MacLean, P. S., and Schedin, P. (2018). Metformine remt de expressie van stromale aromatase en tumorprogressie in een knaagdiermodel van postmenopauzale borstkanker. Breast Cancer res. BCR 20.Goodwin, P. J., Parulekar, W. R., Gelmon, K. A., Shepherd, L. E., Ligibel, J. A., Hershman, D. L., Rastogi, P., Mayer, I. A., Hobday, T. J., Lemieux, J., et al. (2015). Effect van metformine versus placebo op andmetabole factoren bij NCIC CTG MA.32. J. Natl. Kanker Inst. 107.
Hadad, S., Iwamoto, T., Jordan, L., Purdie, C., Bray, S., Baker, L., Jellema, G., Deharo, S., Hardie, D. G., Pusztai, L., et al.(2011). Bewijs voor biologische effecten van metformine bij operabele borstkanker: een pre-operatieve gerandomiseerde, gerandomiseerde studie. Breast Cancer Res.Treat. 128, 783–794.
Hadad, S. M., Hardie, D. G., Appleyard, V., andThompson, A. M. (2014). Effecten van metformine op de celproliferatie van borstkanker, de AMPK-route en de celcyclus. Clin. Transl. Oncol. Van.Publ. Gevoed. Span. Oncol. Soc. Natl. Kanker Inst. Mex. 16, 746–752.
Hatoum, D., and McGowan, E. M. (2015). Recente vooruitgangin het gebruik van metformine: kan de behandeling van diabetes borstkanker voorkomen? BioMedRes. Int. 2015, 548436.
Hirsch, H. A., Iliopoulos, D., Tsichlis, P. N., andStruhl, K. (2009). Metformine richt zich selectief op kankerstamcellen en werkt samen met chemotherapie om de tumorgroei te blokkeren en remissie te verlengen. Kankercellen. 69, 7507–7511.
Hothi, P., Martins, T. J., Chen, L., Deleyrolle, L., Yoon, J.-G., Reynolds, B., and Foltz, G. (2012). Hoog-productie chemische screens identificeren Disulfiram als Inhibitor van menselijke Glioblastoma stamcellen.Op doel 3, 1124-1136.
Hou, Z.-J., Luo, X., Zhang, W., Peng, F., Cui, B., Wu, S.-J., Zheng, F.-M., Xu, J., Xu, L.-Z., Long, Z.-J., et al. (2015).Flubendazol, FDA-goedgekeurde anthelminticum, richt zich op stam-achtige cellen van borstkanker.Op doel 6, 6326-6340.
Iliopoulos, D., Hirsch, H. A., and Struhl, K. (2011).Metformine verlaagt de dosis chemotherapie voor het verlengen van tumorremissie inmouse xenografts waarbij meerdere kankerceltypen betrokken zijn. Cancer Res. 71,3196-3201.
Jacob, L., Kostev, K., Rathmann, W., en Kalder, M. (2016). Effect van metformine op metastasen bij patiënten met borstkanker en diabetes type 2. J. Diabetes Complicaties 30, 1056-1059.
Jagust, P., De Luxán-Delgado, B., Parejo-Alonso, B., en Sancho, P. (2019). Metabolisme-Gebaseerde Therapeutische Strategieën Gericht Op Kankercellen. Voorkant. Farmacol. 10.Jang, M., Kim, S. S., and Lee, J. (2013). Kankercelmetabolisme: implicaties voor therapeutische doelen. Exp. Mol. Med. 45, e45.jiralerspong, S., Palla, S. L., Giordano, S. H., Meric-Bernstam, F., Liedtke, C., Barnett, C. M., Hsu, L., Hung, M.-C., Hortobagyi, G. N., and Gonzalez-Angulo, A. M. (2009). Metformine en Pathologievolledige responsen op neoadjuvante chemotherapie bij diabetespatiënten met borstkanker. J. Clin. Oncol. 27, 3297–3302.Kalinsky, K., Crew, K. D., Refice, S., Xiao, T., Wang, A., Feldman, S. M., Taback, B., Ahmad, A., Cremers, S., Hibshoosh, H., et al.(2014). Prechirurgische studie van metformine bij patiënten met overgewicht en obesitas met nieuw gediagnosticeerde borstkanker. Kanker Investeren. 32, 150–157.
Kanugula, A. K., Gollavilli, P. N., Vasamsetti, S. B., Karnewar, S., Gopoju, R., Ummanni, R., and Kotamraju, S. (2014). Statine-inducedremming van de proliferatie van borstkanker en invasie impliceert verzwakking van het vervoer van ijzer: intermediatie van stikstofmonoxide en antioxidant verdedigingsmechanismen. FEBS J. 281, 3719-3738.Kim, H. J., Kwon, H., Lee, J. W., Kim, H. J., Lee, S. B., Park, H. S., Sohn, G., Lee, Y., Koh, B. S., Yu, J. H., et al. (2015). Metformineverhoging de overleving bij hormoonreceptorpositieve, HER2-positieve borstkankerpatiënten met diabetes. Breast Cancer res. BCR 17, 64.Kim, J., Lim, W., Kim, E.-K., Kim, M.-K., Paik, N.-S.,Jeong, S.-S., Yoon, J.-H., Park, C. H., Ahn, S. H., Kim, L. S., et al. (2014).Fase II gerandomiseerde studie van neoadjuvant metformine plus letrozol versus placeboplus letrozol voor oestrogeenreceptor positieve postmenopausale borstkanker (METEOR). BMC kanker 14, 170.Kodach, L. L., Jacobs, R. J., Voorneveld, P. W., Wildenberg, M. E., Verspaget, H. W., Van Wezel, T., Morreau, H., Hommes, D. W., Peppelenbosch, M. P., Van den Brink, G. R., et al. (2011). Statines vergroten de gevoeligheid van colorectale kankercellen die epigenetische herprogrammering en vermindering van colorectale kankercel “stamness” via de botmorfogeneticproteïne route veroorzaken. Gut 60, 1544-1553.Kozar, K., Kaminski, R., Legat, M., Kopec, M., Nowis, D., Skierski, J., Koronkiewicz, M., Jakóbisiak, M., en Golab, J. (2004).Cerivastatine vertoont een verhoogde antitumoractiviteit tegen humane borstkankercellijnen wanneer het wordt gebruikt in combinatie met doxorubicine of cisplatine. Int.J. Oncol.
Kroemer, G., and Pouyssegur, J. (2008). Tumorcelmetabolisme: kanker achilleshiel. Kankercel 13, 472-482.Kwan, M. L., Habel, L. A., Flick, E. D., Quesenberry, C. P., and Caan, B. (2008). Post-diagnose statinegebruik en borstkankeraanloop in een prospectieve cohortstudie van vroege stadium borstkankerverleners. Breast Cancer Res.Treat. 109, 573–579.Lacerda, L., Reddy, J. P., Liu, D., Larson, R., Li, L., Masuda, H., Brewer, T., Debeb, B. G., Xu, W., Hortobágyi, G. N., et al. (2014).Simvastatine radiosensibiliseert gedifferentieerde en stamachtige borstkankercellen en wordt geassocieerd met een verbeterde lokale controle bij patiënten met inflammatoire borstkankerpatiënten die worden behandeld met postmastectomie. Stamcellen Transl. Med.3, 849–856.Lamb, R., Fiorillo, M., Chadwick, A., Ozsvari, B., Reeves, K. J., Smith, D. L., Clarke, R. B., Howell, S. J., Cappello, A. R., Martinez-Outschoorn, U. E., et al. (2015a). Doxycycline down-reguleert DNA-pk en radiosensitizes tumor initiating cells: implicaties voor meer effectiveradiation therapy. Op doel 6, 14005-14025.
Lamb, R., Ozsvari, B., Lisanti, C. L., Tanowitz, H. B., Howell, A., Martinez-Outschoorn, U. E., Sottia, F., and Lisanti, M. P. (2015b).Antibiotica die mitochondria richten roeien effectief kankerstamcellen uit, over meerdere tumortypes: het behandelen van kanker als een besmettelijke ziekte.Op doel 6, 4569-4584.Lehman, D. M., Lorenzo, C., Hernandez, J., and Wang, C. (2012). Statine gebruik als Moderator van metformine Effect op het risico voor ProstateCancer bij type 2 diabetespatiënten. Diabetes Care 35, 1002-1007.
Lin, C., Lo, M., Moody, R., Stevers, N., Tinsley, S., and Sun, D. (2018). Doxycycline richt aldehyde dehydrogenase-positieve borstkankercellen. Oncol. Rep.
Liu, B., Yi, Z., Guan, X., Zeng, Y.-X., En Ma, F. (2017). De relatie tussen statines en borstkanker prognose varieert bystatine type en Blootstellingstijd: een meta-analyse. Breast Cancer Res.Treat. 164,1–11.
Liu, H., Scholz, C., Zang, C., Schefe, J. H., Habbel, P., Regierer, A.-C., Schulz, C.-O., Possinger, K., and Eucker, J. (2012).Metformine en de mTOR-remmer everolimus (RAD001) sensibiliseren borstkankercellen voor het cytotoxische effect van chemotherapeutische geneesmiddelen in vitro. AnticancerRes. 32, 1627–1637.
Liu, X., Romero, I. L., Litchfield, L. M., Lengyel, E., and Locasale, J. W. (2016). Metformine richt zich op het centrale koolstofmetabolisme en regelt mitochondriale vereisten bij menselijke kanker. Cel Metab. 24, 728–739.
Ma, J., Guo, Y., Chen, S., Zhong, C., Xue, Y., Zhang, Y., Lai, X., Wei, Y., Yu, S., Zhang, J., et al. (2014). Metformine enhancestamoxifen-gemedieerde tumorgroei remming bij ER-positief borstcarcinoom. BMCCancer 14, 172.
Manthravadi, S., Shrestha, A., and Madhusudhana, S. (2016). Impact van statine gebruik op kanker recidief en mortaliteit bij borstkanker: een systematische review en meta-analyse. Int. J. Cancer 139, 1281-1288.Mark, M., Klingbiel, D., Mey, U., Winterhalder, R., Rothermundt, C., Gillessen, S., von Moos, R., Pollak, M., Manetsch, G., Strebel, R., et al. (2019). Impact van de toevoeging van metformine aan Abirateron inmetastatische castratieresistente prostaatkankerpatiënten met ziekte die vordert tijdens behandeling met Abirateron (Metab-Pro): Fase 2 pilotstudie. Clin. Genitourin. Kanker 17, e323-e328.Martin-Castillo, B., Pernas, S., Dorca, J., A. S., A. S., A. S., A. S., A. S.,A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., et al. (2018). Een fase 2-studie vanneoadjuvante metformine in combinatie met trastuzumab en chemotherapie bij vrouwen met vroege HER2-Positieve borstkanker: de METTEN-studie. Oncotdoel 9.35687-35704.Mokhtari, R. B., Homayouni, T. S., Baluch, N., Morgatskaya, E., Kumar, S., Das, B. en Yeger, H. (2017). Combinatietherapie tegen kanker. Op doel 8, 38022-38043.Mück, A. O., Seeger, H., and Wallwiener, D. (2004).Remmend effect van statines op de proliferatie van borstkanker bij de mens cells.Int J. Clin. Farmacol. Ther. 42, 695–700.
Mukhopadhyay, T., Sasaki, J., Ramesh, R., and Roth, J. A. (2002). Mebendazol veroorzaakt een krachtig antitumoreffect op humane kankercellen, zowel in Vitro als In Vivo. Clin. Cancer Res. 8, 2963-2969.Murtola, T. J., Visvanathan, K., Artama, M., Vainio, H., and Pukkala, E. (2014). Statine use and breast cancer survival: A nationwidecohort study from Finland. PloS ONE 9, e110231.Nanni, O., Amadori, D., De Censi, A., Rocca, A., Freschi, A., Bologna, A., Gianni, L., Rosetti, F., Amaducci, L., Cavanna, L., et al. (2019). Metformine plus chemotherapie versus chemotherapie alleen bij de eerstelijnsbehandeling van HER2-negatieve gemetastaseerde borstkanker. De Mymeradomized, fase 2 klinische studie. Breast Cancer Res.Treat. 174, 433–442.
Nimako, G. K., Wintrob, Z. A. P., Sulik, D. A., Donato, J. L., en Ceacareanu, A. C. (2017). Synergistisch voordeel van statine en Metforminein gastro-intestinale maligniteiten. J. Pharm. Pract. 30, 185–194.Niraula, S., Dowling, R. J. O., Ennis, M., Chang, M. C., Done, S. J., Hood, N., Escallon, J., Leong, W. L., McCready, D. R., Reedijk, M., et al. (2012). Metformine bij vroege borstkanker: een prospectief venster van kans neoadjuvante studie. Breast Cancer Res.Treat. 135, 821–830.
Nygren, P., and Larsson, R. (2014). Geneesmiddelherpositionering van bank naar bed: Tumorvermindering door het antihelminticum mebendazolein refractair gemetastaseerd colonkanker. Acta Oncol. 53, 427–428.Orecchioni, S., Reggiani, F., Talarico, G., Mancuso, P., Calleri, A., Gregato, G., Labanca, V., Noonan, D. M., Dallaglio, K., Albini, A., et al. (2015). De biguaniden metformine en fenformine remmen deangiogenese, lokale en gemetastaseerde groei van borstkanker door zich te richten op zowel neoplastische als micro-omgevingscellen. Int. J. Cancer 136, E534-544.
Ozsvari, B., Sottia, F., and Lisanti, M. P. (2017). Een nieuwe mutatie-onafhankelijke benadering van kankertherapie: het remmen van oncogene RAS en MYC, door mitochondriale biogenese te richten. Leeftijd 9, 2098-2116.
Pantziarka, P., Bouche, G., Meheus, L., Sukhatme, V., en Sukhatme, V. P. (2014). Repurposing Drugs in oncologie—ReDO)-mebendazole asan anti-kanker agent. Ecancermedicalscience 8.
Peiris-Pagès, M., Sottia, F., en Lisanti, M. P. (2015). Doxycycline en therapeutisch richten van de DNA-schaderespons incancercellen: oude drug, nieuw doel. Oncoscience 2, 696-699.
Rahmani, J., Manzari, N., Thompson, J., Gudi, S. K., Chhabra, M., Naik, G., Mousavi, S. M., Varkaneh, H. K., Clark, C., en Zhang, Y. (2019). Het effect van metformine op biomarkers geassocieerd met borstkankerkomt tot stand: een systematische beoordeling, meta-analyse en dosisrespons van gerandomiseerde klinische onderzoeken. Clin. Transl. Oncol.
Scatena, C., Roncella, M., Di Paolo, A., Aretini, P., Menicagli, M., Fanelli, G., Marini, C., Mazzanti, C. M., Ghilli, M.,Sottia, F., et al. (2018). Doxycycline,een remmer van mitochondriale biogenese, vermindert effectief kankerstamcellen (CSCs) in vroege borstkankerpatiënten: een klinische proefstudie. Voorkant. Oncol. 8.
Seeger, H., Wallwiener, D., and Mueck, A. O. (2003).Statines kunnen proliferatie van menselijke borstkankercellen in vitro remmen. Exp.Clin. Endocrinol. Diabetes Weg. J. Ger. Soc. Endocrinol. Ger. Diabetes Assoc.111, 47–48.
Skoda, J., Borankova, K., Jansson, P. J., Huang, M. L.-H., Veselska, R., and Richardson, D. R. (2019). Farmacologische targetingvan mitochondriën in kankerstamcellen: een oude organel op het kruispunt van nieuwe anti-kanker therapieën. Farmacol. 139, 298-313.
Sonnenblick, A., Agbor-Tarh, D., Bradbury, I., DiCosimo, S., Azim, H. A., Fumagalli, D., Sarp, S., Wolff, A. C., Andersson, M., Kroep, J., et al. (2017). Impact van het gebruik van Diabetes, insuline en metformine op hetuitkomen van patiënten met humane epidermale Groeifactorreceptor 2–PositivePrimary Breast Cancer: analyse van de gerandomiseerde ALTTO Fase III-studie. J. Clin. Oncol. 35, 1421–1429.van Wyhe, R. D., Rahal, O. M., and Woodward, W. A. (2017). Effect van statines op herhaling van borstkanker en mortaliteit: een overzicht.Borstkanker Richt Zich Daar Op. 9, 559–565.Vazquez-Martin, A., Oliveras-Ferraros, C., Cufí, S., Del Barco, S., Martin-Castillo, B., Lopez-Bonet, E., and Menendez, J. A. (2011).De anti-diabetische drug metformine onderdrukt de metastase-geassocieerde proteinCD24 in MDA-MB-468 drievoudige-negatieve borstkanker cellen. Oncol. Rapport 25.135-140.Vintonenko, N., Jais, J.-P., Kassis, N., Abdelkarim, M., Perret, G.-Y., Lecouvey, M., Crepin, M., and Di Benedetto, M. (2012).Transcriptoomanalyse en in vivo activiteit van fluvastatine versus zoledronicacid in een muriene borstkanker metastasemodel. Mol. Farmacol. 82, 521–528.Wahdan-Alaswad, R. S., Cochrane, D. R., Spoelstra, N. S., Howe, E. N., Edgerton, S. M., Anderson, S. M., Thor, A. D., and Richer, J. K. (2014). Metformine-veroorzaakte het doden van triple-negatieve cellen van borstkanker ismediated door vermindering van vetzuursynthase via miRNA-193b. Horm. Kanker 5,374-389.Wang, Z.-S., Huang, H.-R., Zhang, L.-Y., Kim, S., He, Y., Li, D.-L., Farischon, C., Zhang, K., Zheng, X., Du, Z.-Y., et al. (2017).Mechanistische studie van remmende effecten van metformine en atorvastatine in combinatie met prostaatkankercellen in Vitro en in Vivo. Biol. Farmaceutisch. Stier.40, 1247–1254.Wolfe, A. R., Debeb, B. G., Lacerda, L., Larson,R., Bambhroliya, A., Huang, X., Bertucci, F., Finetti, P., Birnbaum, D., Van Laere, S., et al. (2015). Simvastatine voorkomt triple-negatieve borstkankermetastase in preklinische modellen door regulering van FOXO3a. borstkankercellen. Behandelen. 154, 495–508.
Xu, H., Chen, K., Jia, X., Tian, Y., Dai, Y., Li, D., Xie, J., Tao, M. en Mao, Y. (2015). Het gebruik van metformine wordt geassocieerd met BetterSurvival van borstkankerpatiënten met Diabetes: een Meta-analyse. Theoncoloog 20, 1236-1244.Yam, C., Esteva, F. J., Patel, M. M., Raghavendra, A. S., Ueno, N. T., Moulder, S. L., Hess, K. R., Shroff, G. S., Hodge, S., Koenig, K. H., et al. (2019). Werkzaamheid en veiligheid van de combinatie van metformine, everolimus en exemestaan bij postmenopauzale patiënten met overgewicht en obesitas met gemetastaseerde,hormoonreceptor-positieve, HER2-negatieve borstkanker: een Fase II-studie.Investeren. Nieuwe Drugs 37, 345-351.Yao, H., He, G., Yan, S., Chen, C., Song, L., Rosol, T.J., and Deng, X. (2017). Drievoudige negatieve borstkanker: is er een behandeling aan de horizon? Op doel 8, 1913-1924.
Zhang, L., Guo, M., Li, J., Zheng, Y., Zhang, S., Xie, T., and Liu, B. (2015). Op systeembiologie gebaseerde ontdekking van een potentiële Atg4Bagonist (Flubendazol) die autofagie induceert bij borstkanker. Mol. Biosyst.11, 2860–2866.
Zhang, L., Xu, L., Zhang, F., en Vlashi, E. (2017).Doxycycline remt het fenotype van de kankerstamcel en epitheliaal-naar-mesenchymale overgang bij borstkanker. Celcyclus Georget. Tex16, 737-745.
Zhang, L., Bochkur Dratver, M., Yazal, T., Dong, K., Nguyen, A., Yu, G., Dao, A., Bochkur Dratver, M., Duhachek-Muggy, S., Bhat, K., et al. (2019a). Mebendazol versterkt bestralingstherapie bij Triple-NegativeBreast kanker. Int. J. Radiat. Oncol. Biol. Phys. 103, 195–207.Zhang, Y., Storr, S. J., Johnson, K., Green, A. R., Rakha, E. A., Ellis, I. O., Morgan, D. A. L., and Martin, S. G. (2014). Betrokkenheid van metformine en AMPK bij de radiorespons en prognose van luminale versusbasale-achtige borstkanker behandeld met radiotherapie. Op doel 5, 12936-12949.Zhang, Z.-J., Yuan, J., Bi, Y., Wang, C., en Liu, Y.(2019b). Het effect van metformine op biomarkers en survivals voor borstkanker-een systematische beoordeling en meta-analyse van gerandomiseerde klinische studies. Farmacol.Res. 141, 551-555.
Zhong, S., Zhang, X., Chen, L., Ma, T., Tang, J., andZhao, J. (2015). Statinegebruik en mortaliteit bij kankerpatiënten: systematische beoordeling en meta-analyse van observationele studies. Kanker Behandelen. Rev. 41, 554-567.
