The COC Protocol™ in Breast Cancer
This document is a summary of the rationale and some of the current scientific evidence which supports the use of the COC Protocol medications alongside standard-of-care treatments for breast cancer. Entendemos que o câncer é uma condição muito pessoal, e cada paciente tem um conjunto único de desafios. Para mais informações sobre a sua situação pessoal, por favor, entre em contato com a Clínica de Oncologia Care em 800-392-1353 nos Estados Unidos, ou visite o site em https://careoncology.com.
Se é novo para tratar oncologia por favor note o seguinte:
- não precisa de viajar. Você pode se encontrar com nossa equipe de oncologistas e enfermeiros de oncologia através de vídeo seguro para suporte contínuo.os medicamentos de Protocolo adjuvante da Oncologia de cuidados são enviados directamente para a sua casa a partir das nossas farmácias parceiras dos EUA e podem ser utilizados juntamente com o seu padrão de tratamento de cuidados.estamos incrivelmente orgulhosos de anunciar que passamos o processo de validação extremamente rigoroso do Instituto de Validação de análise de dados, reivindicações de resultados e cálculo de valor. Trabalhámos arduamente para chegar a este ponto. Logo no início, reconhecemos o tremendo valor de um programa de drogas reutilizadas oferecido de forma responsável aos pacientes com câncer, no entanto, não estava sendo oferecido em escala. Há quatro anos, decidimos mudar isto sabendo que era uma maratona, não um sprint.
O COC Protocolo e câncer de mama: pontos-Chave
- O COCProtocol é uma combinação de quatro comumente prescritos medicamentos(atorvastatina, metformina, mebendazol, e doxiciclina), com potencial totarget câncer de mama e ajuda a melhorar a eficácia da norma anticancertherapies.alguns estudos observacionais associaram o uso de metformina ou estatina a ganhos improváveis em doentes com cancro da mama. os estudos laboratoriais sobre as células do cancro da mama cultivadas em pratos mostram que a metformina e o estatinscanam directamente e prejudicam as células do cancro da mama – enfraquecendo-as e tornando-as mais vulneráveis aos tratamentos padrão.os resultados de pequenos ensaios clínicos “janela de oportunidade” em doentes com cancro do leito operável mostram geralmente que tomar metformina ou estatina antes da cirurgia pode conduzir a alterações potencialmente positivas nos marcadores moleculares do cancro, incluindo as que regulam o crescimento e a divisão das células do cancro da mama. Está em curso mais trialsinvestigação se a metformina ou estatinas podem afectar a resposta à doença.
- doxiciclinecan block growth of both HER2 positive and triple-negative breast cancer stemcells incubated in dishes in the lab, and helped to improve resistance-relatedchanges induced by the standard chemisther paclitaxel. a doxiciclina acaba de chegar aos ensaios clínicos iniciais em doentes com cancro da mama. Os resultados do primeiro pequeno estudo mostram que os doentes com cancro da mama em fase precoce, que tomaram doxiciclina apenas 14 dias antes da cirurgia, reduziram os níveis de marcadores moleculares para a presença de células estaminais cancerígenas em média cerca de 40%. Observaram-se efeitos benéficos para todos os doentes tratados, com excepção de um(8/9).Mebendazolecano retarda o crescimento e a divisão das células cancerígenas da mama cultivadas no laboratório,incluindo as células cancerígenas da mama que são mais resistentes à quimioterapia. Estudos Morehuman são necessários.Protocolo COC e cancro da mama: Evidências publicadas
O Protocolo COC é um regime de combinação de quatro medicamentos comumente prescritos,cada um com evidência de atividade anticancerosa metabolicamente baseada, e perfis de segurança bem inferiores. Estes medicamentos são: metformina,atorvastatina, doxiciclina e mebendazol. Alguns dos estudos que apoiam o uso do Protocolo ococ como terapia adjuvante, juntamente com os actuais tratamentos padrão para o cancro do pulmão, são apresentados a seguir. Esta evidência provém principalmente de estudos laboratoriais, de grandes estudos epidemiológicos (que investigam as ligações entre o consumo de drogas e os resultados do cancro da mama em grupos de indivíduos) e de ensaios clínicos de triagem Auricular.
pode notar que muitos dos estudos abaixo focam apenas nas Protocolmedicações individuais COC. Nós somos os primeiros a projetar uma terapia adjunta que combina allfour. Acreditamos que a combinação destes medicamentos alcançará os maiores resultados, e nosso próprio programa de pesquisa, chamado MÉTRICS, já está produzindo mais evidências necessárias para mostrar isso. Você pode ler mais sobre a razão pela qual acreditamos que estes medicamentos funcionam tão bem juntos para ajudar a atingir o câncer, e sobre o programa temático em si, em outras seções abaixo.
metformina e cancro da mama
Metforminusa associada a potenciais benefícios para o cancro da mama
os estudos de Maniobservação fornecem agora provas de Apoio ao uso de metformina no cancro do inbreast. A metformina está licenciada para tratar a diabetes tipo 2, e estudos observacionais em grupos de doentes diabéticos tendem a mostrar que aqueles que tomam metformina têm melhores hipóteses de obter um melhor resultado se desenvolverem o cancro da mama (Aksoy et al., 2013; El-Benhawy and El-Sheredy, 2014; Sonnenblick et al., 2017).A utilização de metformina tem sido associada à melhoria da sobrevivência em doentes com cancro da mama (Kim et al., 2015; Xuet al., 2015), melhoria da resposta ao tratamento do cancro da mama (Jiralerspong et al., 2009), e menos chance de câncer de mama espalhando andrelapse (Chen et al., 2017;Jacob et al., 2016). é provável que alguns dos efeitos benéficos da metformina encontrados nestes estudos se devamà capacidade da metformina para melhorar a diabetes e/ou o peso de um doente, reduzindo os níveis deglucose, o que pode ajudar a reduzir o risco de desenvolvimento do cancro da mama,e melhorar a saúde e a capacidade do doente para combater o cancro da mama, caso o tenha (Hatoum e McGowan, 2015). Mas os estudos laboratoriais também mostram que a metformina está a fazer mais do que isto. De facto, a metformina pode trabalhar directamente contra as células cancerígenas, reduzindo a sua capacidade de absorver e utilizar energia e bloqueando a sua capacidade de crescimento, propagação, Sobrevivência e recidiva (Alimova et al., 2009; Hadad et al., 2014; Orecchioni et al., 2015). os diferentes tipos de cancro da mama requerem tratamentos diferentes. Trastuzumab, por exemplo, é especificamente utilizado no tratamento do cancro da mama positivo do receptor 2 (HER2)do factor de crescimento epidérmico humano. O tamoxifeno é eficaz contra o cancro da mama positivo do receptor do estrogénio (ER). O importante é que estudos com células cancerígenas no laboratório demonstram que a metformina tem actividade anticancerosa contra muitos tipos diferentes de células cancerígenas, incluindo ER positivo (Giles et al.,2018), HER2 positive (Chen et al., 2013), e possivelmente subtipos mais difíceis de tratar, tais como células cancerígenas Triplo-negativas (Deng et al., 2012; Vazquez-Martin et al., 2011; Wahdan-Alaswad et al., 2014).Isto significa que a metformina tem o potencial de trabalhar eficazmente a par de tratamentos normalizados para o cancro da mama, independentemente do subtipo de cancro.
Metformintargets câncer de mama células estaminais
Metforminhas também foi mostrado para o alvo do câncer de mama células estaminais (Bao et al., 2014; Cufiet al., 2012; Hirsch et al., 2009).Esta actividade contra as células estaminais do cancro da mama, juntamente com a sua capacidade de direccionar diferentes subtipos de cancro da mama, ajudam a explicar por que razão os estudos de laboratório mostram que pode trabalhar em combinação com uma série de tratamentos padrão, incluindo o trastuzumab (Cufi et al., 2012), tamoxifeno (Ma et al., 2014), andstandard chemistion agents (Iliopoulos et al.,2011). Estudos em animais e células mostram que a metformina contribui para melhorar a eficácia dos tratamentos padrão (Bradford e Khan,2013; Liu et al., 2012; Zhang et al., 2014) e atrasa igualmente a recidiva de cancros que foram tratados com estas terapias (Iliopoulos et al.,2011). além disso, estudos de laboratório também mostram que a metformina também pode ajudar a prevenir que as células cancerígenas da mama se tornem resistentes à quimioterapia e a melhorar a sensibilidade das células cancerígenas já resistentes ao tratamento (Davies et al., 2017).
o Metamorfina melhora os marcadores do cancro da mama nos estudos clínicos iniciais
como resultado da grande quantidade de dados de suporte para a metformina no cancer da mama, através de estudos observacionais e laboratoriais, estão actualmente em curso várias trialsinvestigações clínicas da metformina no cancro da mama (Camacho et al., 2015).De um modo geral, as análises colectivas dos resultados destes ensaios em fase inicial(meta-análise) começam a sugerir um efeito geralmente positivo quando a metamorfina é adicionada às terapias padrão de cancro (Rahmani etal., 2019; Zhang et al., 2019b). vários ensaios de “janela de oportunidade” estão a investigar se tomar metforminfor cerca de duas semanas antes da cirurgia pode ajudar a melhorar os marcadores moleculares da doença em doentes com cancro da mama em fase inicial operável. Os resultados destes estudos sugerem, em geral, que a administração de metformina pode conduzir a alterações potencialmente positivas nos marcadores moleculares do cancro, incluindo os que limitam regularmente o crescimento e a divisão das células cancerígenas (Bonanni et al., 2012;Cazzaniga et al., 2013; Hadad et al., 2011; Kalinsky et al., 2014; Niraula etal., 2012), bem como potencialmente melhorar a regulação dosformones e outros fatores para alguns pacientes (Kalinsky et al., 2014; Niraula et al., 2012). Estes estudos estão agora a ajudar os cientistas a compreender exactamente como e quando é que a metformina pode helppatients com cancro da mama (Bonanni etal., 2012; DeCensi et al., 2014, 2015; Rahmani et al., 2019).os ensaios “neoadjuvant” são geralmente ensaios mais longos e mais complexos que investigam a metformina, juntamente com ciclos de tratamentos padrão para tratar diferentes tipos de cancro da mama. O objectivo destes ensaios é estabelecer que a ifmetformina contribui realmente para melhorar a eficácia dos tratamentos padrão, como sugerem os estudos da aslab (Kim et al., 2014). Num estudo recente (o estudo METTEN) (Martin-Castillo etal. Em mulheres com cancro da mama HER2 positivo em fase inicial, mais doentes a tomar metformina responderam bem à quimioterapia/tratamento com alvo (65, 5%) comparativamente aos doentes que não tomaram metformina (58, 6%). Esta diferença não foi estatisticamente significativa, o que significa que este resultado poderia ter sido alcançado por acaso. No entanto, os ensaios da fase 2 estão, em geral, pouco avançados para se chegar a um significado estatístico desta forma, e os investigadores apelaram para a progressão para ensaios da fase 3 mais alargados, que podem ser adequadamente concebidos para determinar o quão real este efeito é (Martin-Castillo etal., 2018). Foram também notificados resultados potencialmente encorajadores de outras triais de Fase 2, tais como um em indivíduos com excesso de peso com cancro da mama metastático (inhames et al.,2019). Também vale a pena notar que, como esperado, nem todos os testes de câncer de metformina relataram resultados positivos. Por exemplo, outros ensaios da fase 2 revelaram que a metformina com a terapêutica padrão não apresentava diferenças reais em comparação com a terapêutica padrão isolada em determinadas circunstâncias (Mark et al.,2019; Nanni et al., 2019). Acreditamos que a motformina será mais eficaz em qualquer situação, quando administrada em combinação com outros medicamentos anti-metabólicos.são necessários estudos mais alargados para ajudar a resolver estes problemas, estando actualmente em curso um estudo de Fase 3 para investigar a metformina no cancro da mama. Embora o ensaio não esteja concluído até 2020, os resultados iniciais dos primeiros 6 meses do ensaio demonstraram que os doentes que começaram a tomar metformina imediatamente após a conclusão da cirurgia e dos ciclos de quimioterapia padrão tiveram alterações favoráveis num marcador molecular do cancro da mama (Dowling et al., 2018) e melhoraram os factores metabólicos (Goodwin et al., 2015).
estatinas e cancro da mama
estudos observacionais ligam estatinas a melhores resultados do cancro da mama
estatinas são normalmente administradas para ajudar a controlar as doenças cardiovasculares. No entanto, os estudos observatórios sobre grandes grupos de pessoas que tomam estatinas também descobriram que os indivíduos com cancro da mama que estão a tomar estatinas podem também ter reduzido o risco de cancro recorrente após o tratamento, em comparação com os doentes que não estão a tomar estatinas (Ahern et al., 2014;Manthravadi et al., 2016). Por exemplo, em quase 2000 sobreviventes de câncer de mama, aqueles que começaram a tomar posse em três anos após o diagnóstico tiveram uma chance reduzida de seu câncer de volta (Kwan et al., 2008). Num outro estudo, apenas 6 meses de uso de estatinas após o diagnóstico estavam associados a taxas de recidiva melhoradas (Chae et al., 2011).
mportante, o efeito benéfico das estatinas nestes e noutros estudos foi mais fortemente associado às estatinas “lipofílicas” lipofílicas mais solúveis em gordura (como a atorvastatina). Em estudos somelaboratórios, as estatinas lipofílicas demonstraram também ter efeitos superioranticantes a nível celular, em comparação com estatinas menos lipossolúveis (Liu et al., 2017). os estudos de observação também associam o uso de estatina à melhoria da resposta da doença ao tratamento e ao sobrevivo em doentes com cancro da mama, mesmo em doentes com cancro da mama que podem ser mais agressivos (Manthravadi et al., 2016; Murtola et al., 2014; Zhong et al., 2015). Por exemplo, num estudo realizado em doentes com cancro da mama inflamatório, a atorvastatina associada a patients durante o tratamento para o cancro teve um período de tempo mais longo antes da progressão da sua doença, em comparação com os doentes que não estavam a tomar uma estatina (Brewer et al., 2013).
Statinstarget células de câncer de mama
Estatinas,especialmente solúvel em gordura, lipofílicas estatinas como atorvastatina, reduzir growthand divisão de células de câncer de mama e aumento de células de câncer de mama morte inlaboratory estudos
alemão Diabetes Association”,”pagina”:”47-48″,”volume”:”111″,”problema”:”1″,”source”:”PubMed”,”resumo”:”Theeffect de cinco estatinas, por exemplo, atorvastatina, fluvastatina, lovastatina, pravastatinand sinvastatina foi investigado sobre a proliferação dos humanos breastcancer linha de células MCF-7. Todas as estatinas, à excepção da pravastatina, foram capazes de inibir a proliferação celular até 90% a uma concentração de 50 micro M. entre as estatinas eficazes não foi observada diferença significativa indicando efeito específico da aclass. Estes dados sugerem que as estatinas podem ter significado clínico na prevenção primária do cancro da mama em seres humanos para além do seu efeito de redução do colesterol. No entanto, a prova clínica deve ser aguardada antes da formulação de quaisquer outras conclusões.”,”DOI”:”10.1055/s-2003-37501″,”ISSN”:”0947-7349″,”nota”:”PMID:12605351″,”journalAbbreviation”:”Exp. Clin. Endocrinol.Diabetes”, “language”: “eng”, “author”:, “issued”: {“date-parts”:]}}}}}], “schema”:”https://github.com/citation-style-language/schema/raw/master/csl-citation.json”} (Alarcon Martinez etal., 2018; Mück et al., 2004; Seeger et al., 2003).Estudos também mostram que as estatinas podem potencialmente bloquear a invasividade das células do cancro da mama no laboratório, sugerindo que também podem ajudar a diminuir a propagação do cancro noutras partes do corpo (Kanugula et al., 2014;Wolfe et al., 2015). Em um modelo de rato de câncer de mama metastático,o tratamento estatal atrasou o crescimento do câncer que já havia se espalhado em até 80%, com atividade benéfica observado dentro de uma semana após o início do tratamento (Vintonenko et al.,2012). outros estudos mostram também que as estatinas podem ajudar a sensibilizar as células cancerígenas da mama para a radioterapia e tratamentos de quimioterapia (Kozar et al., 2004;Van Wyhe et al., 2017). Um estudo revelou que a sinvastatina pode sensibilizar as células do cancro da mama tripla-negativas ou inflamatórias para a radioterapia no laboratório. O mesmo estudo observava, numa população de doentes, que as mulheres com cancro da mama inflamatório que tomavam estatinas durante o tratamento tinham menos hipóteses de o cancro voltar dentro de 3 anos (Lacerda et al., 2014).semelhante à metformina, as estatinas podem produzir estes efeitos anticancerígenos em diferentes tipos de cancro do sexo oposto, incluindo o cancro ER positivo, HER2 positivo e triplo-negativo. De facto, alguns estudos de laboratório mostram que as estatinas são particularmente eficazes contra as células cancerígenas Triplo-negativas (Campbell et al., 2006; Yao et al., 2017).
neste momento estão em curso estudos clínicos clínicos clínicos que investigam estatinas no cancro da mama.
a fewearly-stage clinical trials now show robustly positive results in terms of statins in breast cancer. Os ensaios da fase inicial “janela de oportunidade” investigaram se as estatinas pré-cirúrgicas precoces podem ajudar a melhorar os molecularmarkers da doença em doentes com doença operável. Até agora essas studiesshow melhorado câncer de perfis moleculares em pacientes com estatina tratamento,sugerindo atorvastatina e outras estatinas, neste contexto, pode ter beneficialeffects no crescimento de células de câncer e divisão e morte celular, mesmo em mulheres withhigh de grau mais agressivos tumores (Bjarnadottir et al., 2013, 2015; Feldt et al., 2015; Garwood et al., 2010).com base nestes resultados promissores, estão actualmente em curso vários estudos de Fase 2 que investigam estatinasjuntivas para uma variedade de diferentes tipos de cancro da mama, incluindo o cancro da mama por exemplo negativo. Estes estudos devem ajudar a estabelecer como as estatinas podem ajudar os doentes com cancro da mama.
Mebendazol e cancro da mama
interesse em mebendazoleas um potencial tratamento anticanceroso baseia-se principalmente em estudos mecanísticos promissores e em relatórios convincentes de estudos de casos em doentes com cancro (Nygren e Larsson,2014; Pantziarka et al., 2014). pensa-se que Mebendazoleiis mata as células cancerígenas, em parte, interrompendo estruturas especiais na célula, chamadas microtúbulos (Pantziarka et al.,2014). Actua de forma semelhante à vincristina, um medicamento de acemoterapia actualmente utilizado para o tratamento de alguns tipos de cancro,incluindo o cancro da mama em fase avançada (De Witt et al., 2017). estudos sobre células de cancro da mama cultivadas no laboratório mostram que o mebendazol e medicamentos relacionados da mesma classe (denominados benzimidazóis) podem retardar o crescimento e a divisão de diferentes tipos de células de cancro da mama, incluindo células resistentes à tocemoterapia (Coyne et al., 2013; Hou et al., 2015; Mukhopadhyay et al., 2002). Inone study, mebendazol potently reduced survival of quimioterapia-resistantbreast cancer cells by as much as 63, 1% (Coyne et al., 2013).Estudos demonstraram também uma forte actividade anticancerosa do benzimidazolesagainst triple-negative breast cancer (Hou et al., 2015;Zhang et al., 2015). Importante é o facto de, Num estudo, o benzimidazol ter sido também afectado directamente às células estaminais do cancro da mama (Hou et al., 2015).
Emerginglaboratory baseada em evidência também sugere que benzimidazoles pode melhorar theactivity de padrão de câncer de mama, tratamentos, tais como a doxorrubicina andfluorouracil (Hou et al., 2015). Num estudo de laboratório, o mebendazol aumentou a eficácia da radioterapia em células do cancro da mama negativas por tripla e impediu a resistência ao desenvolvimento do tratamento (Zhang et al., 2019a). Além disso, uma série de estudos usingchemotherapy-resistente ER/HER2 positivo câncer de mama células cultivadas em laboratório,de forma consistente, mostrou que mebendazol não só reduziu a sobrevivência de células cancerosas,também ajudou a complementar e melhorar a atividade de especialmente developedtargeted formas de câncer de mama, quimioterapia epirubicin e gemcitabine (Coyne et al., 2014,2012, 2013).
Doxiciclina e câncer de mama
Asidefrom sendo um eficaz antibiótico doxiciclina, também possui outros extremelyvaluable propriedades, incluindo anti-inflamatória e atividade anticancerígena. Este medicamento proporciona doxiciclina potencial terapêutico real no tratamento de uma série de outras doenças, incluindo o cancro (Bahrami et al., 2012).
Labstudies and animal studies have long shown that doxyciclina can block breastcancer cell growth, division, and movement (Duivenvoorden et al.,2002; Fife and Sledge, 1995, 1998).Estudos mais recentes também mostram que a doxiciclina pode impedir as células cancerígenas de reconstituir o seu ADN quando este fica danificado, por exemplo, pela quimioterapia (Peiris-Pagès et al.,2015). Na verdade, estudos de laboratório mostram que a doxiciclina pode ajudar a melhorar a eficácia da actividade de Quimioterapia contra as células do cancro da mama (Foroodi et al., 2009;Lamb et al., 2015a).
ostrecentemente, o foco diminuiu na compreensão de como a doxiciclina pode bloquear o crescimento das células estaminais do cancro da mama (Ozsvari etal., 2017; Zhang et al., 2017). Um estudo recente de Avery sobre células cultivadas no laboratório mostrou que a doxiciclina pode bloquear o crescimento das células estaminais do cancro da mama, tanto positivo como triplo-negativo, e ajudou a melhorar as alterações relacionadas com a resistência induzidas pela paclitaxel (Lin et al.,2018). Num estudo de laboratório diferente, uma abordagem combinatória que inclui a doxiciclina erradicou de forma muito eficaz as células estaminais do cancro da mama (Fiorillo etal., 2019). a doxiciclina acabou de chegar aos ensaios clínicos iniciais em doentes com cancro da mama. Os resultados do primeiro pequeno estudo, publicado em outubro de 2018, mostram que os pacientes com cancro da mama em estadoprimário, que tomaram doxiciclina durante apenas 14 dias antes da cirurgia, reduziram os níveis de marcadores moleculares para a presença de células estaminais cancerígenas numa média de cerca de 40%. Observaram-se efeitos benéficos para todos os doentes tratados (8/9) (Scatena et al., 2018).Ensaios clínicos maiores estão em curso. o que são as métricas?
métricas é o nosso próprio programa in-houseresearch. Já se sabe muito sobre a segurança e eficácia dos medicamentos do protocolo COC no cancro. Mas também é nossa responsabilidade reconhecer que não temos todas as respostas, e que ainda é necessário gerar uma pesquisa clínica de boa qualidade investigando o COCProtocol em pacientes com câncer, para garantir que o protocolo COC seja tão eficaz e seguro quanto possível. para nos permitir financiar esta investigação, desenvolvemos um sistema inovador e acessível, no qual o nosso estudo clínico, as métricas, é essencialmente “financiado pelos doentes”. Todos os pacientes consentidos que entram na clínica são incluídos em métricas, e estas taxas estão ajudando a financiar o estudo. Trata-se de um novo modelo de investigação clínica, destinado a colmatar os gaps de financiamento e de dados que estão actualmente a dificultar a reorientação e o desenvolvimento clínico de medicamentos já autorizados. os resultados do nosso primeiro estudo-piloto foram recentemente publicados na revista científica Frontiers in Pharmacology, revista científica revista pelo peer. O papel pode ser acessado livremente online aqui.o estudo piloto METRICS foi um estudo retrospectivo observacional, o que significa que os nossos investigadores analisaram e analisaram os registos clínicos dos doentes para descobrir o que aconteceu. Eles coletaram dados e registraram os resultados de 95 pacientes com um tipo avançado de câncer de cérebro chamado glioblastoma que frequentaram a Clínica de Oncologia Care e adotaram o protocolo COC completo juntamente com seus tratamentos padrão habituais. Este estudo não tinha um grupo de controlo, pelo que os nossos investigadores compararam os resultados das métricas com os resultados previamente publicados de estudos anteriores em pacientes com o mesmo tipo de cancro e que também efectuaram tratamentos padrão de cuidados. os resultados iniciais sugerem que os pacientes que frequentaram a nossa clínica e tomaram o protocolo COC como parte dos seus cuidados usuais tinham muito mais probabilidades de sobreviver pelo menos 2 anos (64).0% de patientsin nosso estudo sobreviveu a pelo menos 2 anos, em comparação com os dias 27 e 29% para patientsincluded em estudos anteriormente publicados), e tendem a ter mais survivaltimes geral do que normalmente seria esperado para pacientes com este tipo de ofcancer (pacientes sobreviveram uma média de 27 meses em nosso estudo, em comparação com 15-16 meses em estudos anteriores)(Agrawalet al., 2019).estes resultados são extremelipromizantes, mas também são preliminares. Ainda não sabemos exatamente como o protocolo COC pode ter afetado os tempos de sobrevivência, por exemplo, ou como outros fatores, como certas características do paciente, também podem ter influenciado estes resultados. Mas esta primeira prova inicial é certamente encorajadora, e sugere-nos que estamos a ir na direcção certa. O nosso próximo palco planeado é realizar um estudo maior e bem concebido. Você pode descobrir mais sobre futuros planos de métricas, procurando online ou contactando a clínica.
More about the COC Protocol
What is the COC Protocol?
O Protocolo COC é um regime de tratamento de acombinação composto por medicamentos autorizados, especificamente concebido por Oncologia de cuidados para uso adjuvante, juntamente com os tratamentos usuais de um doente (ou seja, padrão-de-cuidado).
Thefour medicamentos incluídos no COC Protocolo de regime são: a metformina, avery comum anti-droga do diabetes; atorvastatina, um tipo de estatina utilizada tomanage condições cardiovasculares; doxiciclina, um tipo de antibioticoften usado para tratar infecções crônicas como a acne; e mebendazol, amedicine comumente usado para tratar infecções parasitárias em crianças e adultos. escolhemos estas quatro propostas de milhares de potenciais candidatos, especificamente porque correspondem aos nossos critérios de selecção pré-determinados. Estes critérios incluem provas sólidas de eficácia contra o cancro, um mecanismo de acção coerente e, de forma importante, um bom perfil de segurança. Estes três princípios centrais moldaram a nossa abordagem desde o início.
a segurança é primordial
Canceris uma doença complexa com tratamentos complexos, e acreditamos que a adição de outras terapias a tratamentos padrão deve ser muito cuidadosamente avaliada. Não só do ponto de vista da eficácia, mas também,o que é importante, em termos de segurança. É por isso que toda a nossa abordagem se baseia em provas – principalmente estudos científicos publicados, e também, cada vez mais, nos nossos próprios dados. muitas medicações diferentes no mercado têm, pelo menos, algumas evidências publicadas que sustentam o seu uso relativamente eficaz no cancro, mas poucas destas medicações têm o nível de evidência tanto de segurança como de eficácia exigido pelo Protocolo COC. Já existem grandes quantidades de dados detalhados para cada um dos medicamentos do protocolo, obtidos a partir de anos de uso na população em geral – e isso ajudou a nos dar um avanço crucial durante o desenvolvimento.procurámos cuidadosamente, ao longo de décadas, dados publicados sobre cada um dos medicamentos do protocolo coc, explorando a forma como funcionam em diferentes populações de pacientes (incluindo pacientes com cancro) e em modelos de células e animais no laboratório. Estes dados, juntamente com a nossa própria experiência clínica, ajudam a garantir que tenhamos uma boa compreensão de como estes medicamentos se comportarão em pacientes com diferentes fases e tipos de cancro, ambos em combinação uns com os outros e também em combinação com inúmeras outras terapias de cancro. Este conhecimento é equivalente e, a partir dos nossos estudos, este tipo de provas ainda não existe para muitos outros candidatos a medicamentos anticancerígenos não rotulados‑especialmente quando sãoinscritos. o protocolo de COC foi concebido para funcionar restringindo a capacidade global das células cancerígenas para absorver e utilizar energia (ou seja, “metabolizar”).
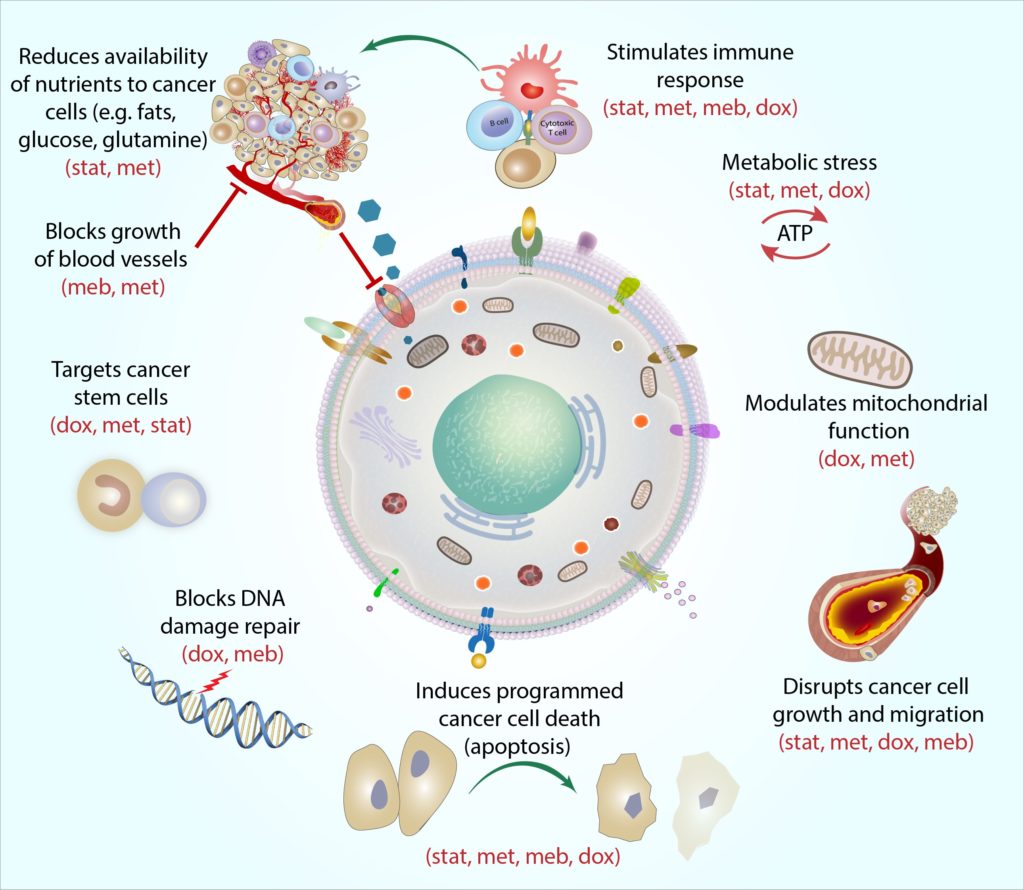
As células cancerígenas necessitam de enormes quantidades de energia para sobreviver, e a grande maioria dos cancros utiliza um processo adaptável chamado glicólise aeróbica para gerar a energia excessiva de que necessitam (Kroemer e pouyssegur, 2008). Cada um dos medicamentos no protocolo pode atingir os vários processos metabólicos moleculares envolvidos na aerobiglicólise e circundante, e isso pode ajudar a diminuir a taxa metabólica global do cancercell (Jang et al.,2013). acreditamos que os medicamentos COCProtocol podem trabalhar em combinação para restringir consistentemente o fornecimento de energia e o uso, ao mesmo tempo em que impedem as células cancerígenas de se adaptarem e utilizarem outras vias para consumir energia (Jagust et al.,2019). Como resultado, as células cancerígenas tornam-se cada vez mais fracas e menos capazes de absorver e utilizar os nutrientes (ex. tais como glicose e ácidos essentialamino glutamina e arginina) eles precisam de seus arredores (Andrzejewskiet al., 2018; Liu et al., 2016).Isso torna mais difícil para as células cancerosas sobreviver, crescer e espalhar o corpo. Gradualmente, as células enfraquecidas (incluindo células mais resistentes e anteriormente resistentes ao tratamento) tornam – se mais vulneráveis ao ataque de outras terapias cancerígenas que matam células,tais como radioterapia, quimioterapia, terapia hormonal e terapias específicas (Bradford andKhan, 2013; Chen et al., 2012; Lacerda et al., 2014; Lamb et al., 2015a;Pantziarka et al., 2014). o protocolo COC pode ser eficaz e selectivo para praticamente qualquer cancro, independentemente do tipo específico,estágio ou localização do cancro. Estudos epidemiológicos e de laboratório publicados apoiam cada vez mais o potencial amplo leque desta terapia (Chae et al.,2015, 2016; Iliopoulos et al., 2011; Lamb et al., 2015b; Pantziarka et al.,2014).a verdadeira força do Protocolo ococ reside na combinação específica de medicamentos que usamos. Desenvolvemos o protocolo não apenas como um regime de quatro tratamentos individuais cada um com actividade anticancerosa, mas também para trabalhar como um único tratamento combinado – com potencial para produzir efeitos sinérgicos poderosos (Mokhtari et al., 2017).
Eachmedication in the COC Protocol targets cancer cell metabolism in a distinct and complementary way, and we have denomined this action ‘mechanistic coherence’. Simplificando, a coerência mecanicista descreve como cada medicação pode atacar a célula cancerosa de um ângulo diferente. Por exemplo, o câncer de células-tronco são aparticularly resiliente tipo de câncer de células, e cada medicação metas thesecells de uma forma diferente: a metformina alvos da célula ‘baterias’ (calledmitochondria), tornando-a muito difícil para a mitocôndria para executar o molecularreactions de que precisam para produzir energia, doxiciclina blocos da célula-DNAmachinery de que as mitocôndrias necessidade de replicar e de reparação (Skoda et al., 2019), statinscan alterar a expressão genética de células estaminais cancerosas, tornando as células mais sensíveis a outras terapias de câncer (Kodach et al., 2011), emebendazol pode interromper numerosos processos moleculares envolvidos na divisão celular para ajudar a bloquear o crescimento de células estaminais cancerígenas (Hothi et al., 2012; Hou et al., 2015). ao combinar todos os quatro agentes, O Protocolo COC pode atingir células estaminais cancerígenas (e outras células cancerígenas) através de múltiplos “pontos fracos”, e como um soco de um a dois, isto deixa as células menos capazes de se esquivar e recuperar.
Labstudies estão começando a destacar a eficácia desta abordagem usando combinações de medicamentos COCprotocol. Num estudo mecanicista, a combinação de estatina e metformina diminuiu grandemente o crescimento das células cancerígenas da próstata, mais do que apenas o fármaco (Wang et al., 2017). Estudos observacionais também relataram efeitos potencialmente sinérgicos destas medicações contra vários cancros (Babcook etal., 2014; Danzig et al., 2015; Lehman et al., 2012; Nimako et al., 2017). O ensaio clínico que investiga a metformina e a doxiciclina no cancro da mama está agora em curso (NCT02874430), e o nosso próprio programa de investigação, o METRICS, está agora também em fase de arranque para produzir dados promissores.
uma terapia adjuvante de longo prazo
O Protocolo de COC é principalmente concebido para ser uma terapia adjuvante de longo prazo, para ajudar a otimizar os tratamentos padrão. No entanto, uma vez que o tratamento metabólico com o COCProtocol se destina a ser executado a longo prazo, os doentes podem também tomar o protocolo como regime de manutenção após o tratamento padrão ter sido concluído ou durante as interrupções do tratamento padrão e como parte de uma estratégia a longo prazo para mitigar o risco de recorrência ou metástases. Por esta razão, vale a pena notar que cada um dos medicamentos do protocolo COC também relatou mecanismos benéficos de acção no cancro, que não dependem da co-administração de terapias padrão, e que podem contribuir de forma independente para reduzir o risco de recidiva e propagação metastática.
o modelo de Oncologia de cuidados
supervisão médica activa de cada doente
embora os medicamentos COCProtocol tenham sido usados com segurança na população em geral durante muitos anos, todos os doentes que vêm até nós são únicos. É por isso que todos os pacientes que atendem à clínica de Oncologia de cuidados são colocados sob o cuidado direto da clinicacom o conhecimento especializado de prescrever os medicamentos do protocolo COC no contexto do câncer. Os nossos médicos avaliam individualmente os potenciais benefícios e riscos envolvidos na adopção do Protocolo COC com cada paciente. Só recomendarão o protocolo COC aos pacientes quando acreditarem que será seguro e benéfico fazê-lo. Cada prescrição do protocolo COC é adaptada às necessidades do doente, sendo as doses e os regimes cuidadosamente revistos e ajustados com base na forma como o doente progride. por conseguinte, é essencial que os pacientes apenas tomem o protocolo COC enquanto são cuidadosamente monitorizados na nossa clínica durante a duração do seu tratamento.
*********************************************************************************
Importante
Objetivo deste artigo
Thisarticle é uma visão geral de alguns dos médicos e científicos publishedliterature relativas a medicamentos que compõem o sistema patenteado de Cuidados Oncologyprotocol. Foi tomado o cuidado de seleccionar artigos relevantes que apoiem a utilização sem rótulo destes medicamentos num ambiente clínico para o tratamento adjuvante do cancro. Este artigo não pretende ser uma revisão exaustiva de todas as provas, nem abrange todos os potenciais efeitos secundários deste tratamento. este artigo destina-se apenas a fins informativos e não constitui aconselhamento médico. Os medicamentos aqui discutidos estão disponíveis apenas mediante receita médica e não devem ser tomados sem consultar o seu médico ou outro profissional de saúde. Cuidados de Oncologia os médicos discutirão consigo a adequação destes medicamentos e estabelecerão contacto com o seu médico ou oncologista para discutir a sua adequação para si.não pode confiar na informação contida neste artigo Como alternativa ao aconselhamento médico do seu médico ou de outro profissional de saúde. Se tiver alguma pergunta específica sobre qualquer assunto médico, deve consultar o seu médico ou outro profissional de saúde. Se pensa que pode estar a sofrer de qualquer doença, deve procurar cuidados médicos imediatos. Nunca deve demorar a procurar aconselhamento médico, ignorar aconselhamento médico, ou continuar o tratamento médico devido às informações contidas neste artigo.
Copyright
o copyright neste artigo é propriedade de clínicas de saúde LLC e seus licenciadores. o protocolo Care Oncology(“COC”) é protegido pela patente dos Estados Unidos US9622982B2 e por várias patentes internacionais adicionais.
*********************************************************************************
Agrawal,S., Vamadevan, P., Mazibuko, N., Bannister, R., Swery, R., Santos, S., andEdwards, S. (2019). A New Method for Ethical and Efficient Evidence generation for Off-Label Medication Use in Oncology (A Case Study in Glioblastoma). Frente.Farmacol. 10.
Ahern, T. P., Lash, T. L., Damkier, P.,Christiansen, P.M., e Cronin-Fenton, D. P. (2014). Estatinas e prognóstico do câncer de mama: evidência e oportunidades. Lancet Oncol. 15, e461-468.Aksoy, S., Sendur, M. A. N., and Altundag, K. (2013).Características demográficas e clínicas patológicas em doentes com cancro do invasivebreast a receber metformina. Med. Oncol. Northwood Lond. Casa. 30, 590.Alarcon Martinez, T., Zeybek, N. D., and Müftüoğlu, S. (2018). Avaliação dos efeitos citotóxicos e Autofágicos da atorvastatina nas células cancerígenas da mama onMCF-7. Recusar. Med. J. 35, 256-262.
Alimova, I. N., Liu, B., Ventoinha, Z., Edgerton, S. M.,Dillon, T., Lind, S.E., e Thor, A. D. (2009). A metformina inibe o crescimento do cancercell mamário, a formação de colónias e induz a paragem do ciclo celular in vitro. CellCycle 8, 909-915.Andrzejewski, S., Siegel, P. M., and St-Pierre, J. (2018). Perfis metabólicos associados à eficácia da metformina no cancro. Frente.Endocrinol. 9.
Babcook, M. A., Shukla, S., Fu, P., Vazquez, E. J.,Puchowicz, M. A., Molter, J. P., Carvalho, C. Z., MacLennan, G. T., Balão, C. A.,Lindner, D. J., et al. (2014). Sinvastatina sinérgica e metformina Mol.Cancro. 13, 2288–2302.
Bahrami, F., Morris, D. L.,and Pourgholami, M. H. (2012). Tetraciclinas: medicamentos com enorme potencial terapêutico. Mini Rev. Med.Chem. 12, 44–52.Bao, B., Azmi, A. S., Ali, S., Zaiem, F., And Sarkar, F. H. (2014). A metformina pode funcionar como agente antineoplásico através do alvo das células cancerígenas: o potencial significado biológico dos cancros miRNAs inbreast e pancreáticos associados ao tumor. Anao. Transl. Med. 2.Bjarnadottir, O., Romero, P., Bendahl, P.-O., Jirström,K., Rydén, L., Loman, N., Uhlén, M., Johannesson, H., Rosa, C., Grabau, D., etal. (2013). Visando a HMG-CoA reductase com estatinas num ensaio de cancro do topo da janela de oportunidade. Breast Cancer Treat. 138, 499–508.
Bjarnadottir, O., Kimbung, S., Johansson, I., Veerla,S., Jönsson, M., Bendahl, P.-O., Grabau, D., Hedenfalk, I., e Borgquist, S.(2015). Alterações Transcritionais globais após o tratamento com estatina no cancro da mama. Clin. Cancer Res. Off. J. Am. Assoc. Cancer Res. 21, 3402-3411.Bonanni, B., Puntoni, M., Cazzaniga, M., Pruneri, G.,Serrano, D., Guerrieri-Gonzaga, A., Gennari, A., Trabacca, M. S., Galimberti,V., Veronesi, P., et al. (2012). Efeito duplo da metformina na proliferação do cancro da mama num ensaio pré-cirúrgico aleatorizado. J. Clin. Oncol. Nao. J. Am.Soc. Clin. Oncol. 30, 2593–2600.Bradford, S. A., e Khan, A. (2013). Um estudo exploratório sobre a individualidade da terapia com o medicamento anti-diabético, a metformina, como um “Judeadjuvantã”: um estudo exploratório. J. Cancer Sci. Ther. 5.
Brewer, T. M., Masuda, H., Liu, D. D., Shen, Y., Liu,P., Iwamoto, T., Kai, K., Barnett, C. M., Woodward, W. A., Rúben, J. M., et al.(2013). Uso de estatina no cancro da mama inflamatório primário: um estudo de coorte. Br.J. Cancer 109, 318-324.Camacho, L., Dasgupta, A., e Jiralerspong, S.(2015). Metformina no cancro da mama – um mistério em evolução. Breast Cancer Res. BCR 17, 88.
Campbell, M. J., Esserman, L. J., Zhou, Y., Sapateiro,M., Lobo, M., Borman, E., Baehner, F., Kumar, A. S., Adduci, K. Marx, C., etal. (2006). Prevenção do crescimento do cancro da mama por estatinas. Cancer Res. 66,8707-8714.
Cazzaniga, M., DeCensi, A., Pruneri, G., Puntoni, M.,Bottiglieri, L.; Varricchio, C., Guerrieri-Gonzaga, A., Gentilini, O. D., Pagani, G., Dell’Porto, P., et al. (2013). O efeito da metformina na apoptosisina num ensaio pré-cirúrgico do cancro da mama. Br. J. Cancer 109, 2792-2797.Chae, Y. K., Valsecchi, M. E., Kim, J., Bianchi,A. L., Khemasuwan, D., Desai, A., and Tester, W. (2011). Redução do risco de CancerRecurrence mamário em doentes a utilizar inibidores da ECA, ARBs e/ou estatinas. CancerInvest. 29, 585–593.
Chae, Y. K., Yousaf, M., Malecek, M. K., Carneiro, B.,Chandra, S. Kaplan, J., Kalyan, A., Sassano, A., Platanias, L. C., e Giles,F. (2015). Estatinas como terapêutica anticancerosa; Podemos traduzir os dados pré-clínicos e epidemiológicos em benefício clínico? Discov. Med. 20, 413–427.
Chae, Y. K., Arya, A., Malecek, M. K. Shin, D. S.,Carneiro, B., Chandra, S. Kaplan, J., Kalyan, A., Altman, J. K., Platanias, L.,et al. (2016). Reprogramar a metformina para o tratamento do cancro: estudos clínicos actuais. Oncotarget 7, 40767-40780.Chen, J., Lan, T., Hou, J., Zhang, J., An, Y., Tie,L., Pan, Y., Liu, J., e Li, X. (2012). A atorvastatina sensibiliza os carcinomas pulmonares de humannon-pequenas células para a carboplatina através da supressão da activação da AKT e da regulação do TIMP-1. T. J. Bioquímica. Biol Celular. 44, 759–769.
Chen, L., Chubak, J., Boudreau, D. M., Barlow, W. E.,Weiss, N. S., e Li, C. I. (2017). Tratamento da Diabetes e Riscos de AdverseBreast Cancer Outcomes among Early-Stage Breast Cancer Patients: a SEER-MedicareAnalysis. Cancer Res. 77, 6033-6041.Chen, T., Liang, Y., Feng, D., Tao, L., Qi, K., Zhang,H., Wang, H., Lin, Q., E Kong, H. (2013). A metformina inibe a proliferação e promove a apoptose de células do cancro da mama HER2 positivas por downregulatingHSP90. J. BUON desliga. J. Balk. Union Oncol. 18, 51–56.Coyne, C., Jones, T., And Bear, R. (2014).Citotoxicidade Anti-Neoplásica da gemcitabina-(C4-amida)- inDual-combinação com Epirubicina-(C3-amida)- novamente Adenocarcinoma mamário Resistente à terapia (SKBr-3) e efeito complementar do Mebendazol. J. Cancer Res. Ther. Oncol. 2.Coyne, C. P., Jones, T., And Bear, R. (2012). Influence of Alternative Tubulin Inhibitors on the Potency of aepirubicina-Immunochemoterapeutically Synthesized with an Ultra VioletLight-Activated Intermediate. Cancro Clin. Oncol. 1, 49–80.Coyne, C. P., Jones, T., And Bear, R. (2013).Gemcitabine-(C4-amide)- Anti-Neoplastic Cytotoxicity in DualCombination with Mebendazole against Chemotherapeutic-Resistant MammaryAdenocarcinoma. J. Clin. Exp. Oncol. 2.
Cufi, S., Corominas-Faja, B., Vazquez-Martin, A.,Oliveras-Ferraros, C., Dorca, J., Bosch-Barrera, J., Martin-Castillo, B., andMenendez, J.A. (2012). Metformin-induced preferential killing of breast cancerinitiating CD44+CD24-/low cells is sufficient to overcome primary resistance totrastuzumab in HER2+ human breast cancer xenografts. Oncotarget 3, 395–398.
Danzig, M.R., Kotamarti, S., Ghandour, R.A.= = Demografia = = segundo o censo norte-americano de 2000 , a sua população era de 607 habitantes.Sinergismo entre a metformina e as estatinas na modificação do risco de recorrência bioquímica após prostatectomia radical em homens com diabetes. ProstateCancer Prostatic Diss. 18, 63–68.Davies, G., Lobanova, L., Dawicki, W., Groot,G., Gordon, J. R., Bowen, M., Harkness, T., and Arnason, T. (2017). A metforminimita o desenvolvimento e promove a ressensibilização do cancro da mama resistente ao tratamento. PLoS um 12.De Witt, M., Gamble, A., Hanson, D., Markowitz, D., Powell, C., Al Dimassi, S., Atlas, M., Bookkvar, J., Ruggieri, R., and Symons, M. (2017). Reprogramando Mebendazol como substituto da Vincristina para o tratamento de tumores cerebrais. Mol. Med. 23, 50–56.
DeCensi, A., Puntoni, M., Gandini, S.,Guerrieri-Gonzaga, A., Johansson, H. A., Cazzaniga, M., Pruneri, G., Serrano,D., Schwab, M., Hofmann, U., et al. (2014). Efeitos diferenciais da metforminona proliferação do cancro da mama de acordo com marcadores de resistência à insulina e subtipo de insulina num ensaio pré-cirúrgico aleatorizado. Breast Cancer Treat. 148,81–90.DeCensi, A., Puntoni, M., Guerrieri-Gonzaga, A.,Cazzaniga, M., Serrano, D., Lazzeroni, M., Vingiani, A., Gentilini, O.,Petrera, M., Viale, G., et al. (2015). Efeito da metformina na proliferação de DuctalCarcinoma mamário In Situ num ensaio pré-cirúrgico aleatorizado. Cancro Anterior.Res. Phila. Pa 8, 888-894.Deng, X.-S., Wang, S., Deng, A., Liu, B., Edgerton, S. M., Lind, S. E., Wahdan-Alaswad, R., and Thor, A. D. (2012). Metformina o targetsstat 3 para inibir o crescimento celular e induzir apoptose em doentes com cancro da mama triplo-negativo. Ciclo Celular Georget. Tex 11, 367-376.
Dowling, R. J., Parulekar, W. R., Gelmon, K. A.,Pastor, L. E., Virk, S., Ennis, M., Mao, F., Ligibel, J. A., Hershman, D. L.,Rodrigues, P., et al. (2018). CA15-3/MUC1 na CCTG MA-32 (NCT01101438): um phaseIII RCT do efeito da metformina vs. placebo na sobrevivência invasiva livre de doença e global no cancro da mama em Estadio precoce (BC). J. Clin. Oncol.
Duivenvoorden, W. C. M., Popović, S. V., Lhoták, S., Seidlitz,E., Hirte, H. W., Tozer, R. G., e Singh, G. (2002). A doxiciclina diminui a tumorburden num modelo de metástase óssea do cancro da mama humano. Cancer Res. 62,1588-1591.El-Benhawy, S. A., and El-Sheredy, H. G. (2014).Metformina e sobrevivência em doentes diabéticos com cancro da mama. J. Egypt.Saúde Pública Assoc. 89, 148–153.
Feldt, M., Bjarnadottir, O., Kimbung, S., Jirström,K., Bendahl, P.-O., Veerla, S., Grabau, D., Hedenfalk, I., e Borgquist, S.(2015). Efeitos anti-proliferativos induzidos pela estatina via cyclin D1 e p27 no ensaio de carcinoma da mama awindow of opportunity. J. Transl. Med. 13, 133.Fife, R. S., and Sledge, G. W. (1995). Efeitos dadoxiciclina no crescimento in vitro, migração e actividade gelatinase das células do carcinoma da mama. J. Lab. Clin. Med. 125, 407–411.Fife, R. S., and Sledge, G. W. (1998). Efeitos dadoxiciclina nas células cancerígenas in vitro e in vivo. Adv. Dent. Res. 12, 94-96.Fiorillo, M., Tóth, F., Sotgia, F., And Lisanti, M. P. (2019). Doxiciclina, Azitromicina e vitamina C (DAV) : uma potente combinationtherapy para atingir as mitocôndrias e erradicar as células estaminais cancerígenas (CSCs).Aging 11, 2202-2216.Foroodi, F., Duivenvoorden, W. C., and Singh, G. (2009). Interacções da Doxiciclina com agentes quimioterapêuticos em células MDA-MB-231 de adenocarcinoma humanbreast. Quimioterapia. Drogas 20, 115-122.Garwood, E. R., Kumar, A. S., Baehner, F. L., Moore,D. H., Au, A., Hylton, N., Flores, C. I., Garber, J., Lesnikoski, B.-R., Hwang,E. S., et al. (2010). A fluvastatina reduz a proliferação e aumenta aapoptose em mulheres com cancro de gradebreast elevado. Breast Cancer Treat. 119, 137–144.
Giles, E. D., Jindal, S., Wellberg, E. A., Schedin, T.,Almeida, S. M., Thor, A. D., Edwards, D. P., MacLean, P. S., e Schedin, P.(2018). A metformina inibe a expressão da aromatase estromal e a progressão tumoral num modelo de roedor de cancro da mama pós-menopáusico. Breast Cancer Res. BCR 20.
Goodwin, P. J., Parulekar, W. R., Gelmon, K. A.,Pastor, L. E., Ligibel, J. A., Hershman, D. L., Rodrigues, P., Mayer, I. A.,Hobday, T. J., Lemieux, J., et al. (2015). Efeito da metformina vs placebo sobre factores andmetabólicos no CNCIC CTG MA.32. J. Natl. Cancro Inst. 107.
Hadad, S., Iwamoto, T., Jordânia, L., Purdie, C., Bray,S., Baker, L., Jellema, G., Deharo, S., Hardie, D. G., Pusztai, L., et al.(2011). Evidência de efeitos biológicos da metformina no cancro da mama operável:um ensaio pré-operatório, de oportunidade e aleatorizado. Breast Cancer Treat. 128, 783–794.
Hadad, S. M., Hardie, D. G., Appleyard, V., andThompson, A. M. (2014). Efeitos da metformina na proliferação de células cancerígenas da mama, na Via AMPK e no ciclo celular. Clin. Transl. Oncol. Nao.Publ. Fartar. Abranger. Oncol. Soc. Natl. Cancro Inst. Mex. 16, 746–752.Hatoum, D., e McGowan, E. M. (2015). Advancesina recente na utilização de metformina: o tratamento da diabetes pode prevenir o cancro da mama? Biomedros. T. 2015, 548436.
Hirsch, H. A., Iliopoulos, D., Tsichlis, P. N., andStruhl, K. (2009). A metformina destina-se selectivamente às células estaminais cancerígenas e actua em conjunto com a quimioterapia para bloquear o crescimento do Tumor e prolongar a remissão. CancerRes. 69, 7507–7511.
Hothi, P., Martins, T. J., Chen, L., Deleyrolle, L.,Yoon, J. G., Reynolds, B., e Foltz, G. (2012). As Quimiicalescreens de alta capacidade identificam o dissulfiram como um inibidor das células estaminais do Glioblastoma humano.Oncotarget 3, 1124-1136.Hou, Z.-J., Luo, X., Zhang, W., Peng, F., Cui, B.,Wu, S.-J., Zheng, F.-M., Xu, J., Xu, L.-Z., Long, Z.-J., et al. (2015).Flubendazol, anti-helmíntico aprovado pela FDA, tem como alvo células estaminais do cancro da mama.Oncotarget 6, 6326-6340.Iliopoulos, D., Hirsch, H. A., and Struhl, K. (2011).A metformina diminui a dose de quimioterapia para prolongar a remissão tumoral nos xenograftos Caseiros envolvendo múltiplos tipos de células cancerígenas. Cancer Res. 71,3196–3201.
Jacob, L., Kostev, K., Rathmann, W., and Kalder, M.(2016). Impacto da metformina nas metástases em doentes com cancro da mama e diabetes tipo 2. J. Diabetes Complications 30, 1056-1059.Jagust, P., de Luxán-Delgado, B., Parejo-Alonso,B., e Sancho, P. (2019). Estratégias Terapêuticas Baseadas No Metabolismo Dirigidas Às Células Cancerígenas. Frente. Farmacol. 10.Jang, M., Kim, S. S., and Lee, J. (2013). Celmetabolismo canceroso: implicações para alvos terapêuticos. Expo. Mol. Med. 45, e45.
Jiralerspong, S., Palla, S. L., Giordano, S. H.,Meric-Bernstam, F., Liedtke, C., Barnett, C. M., Hsu, L., Pendurado, M.-C.,Hortobagyi, G. N., e Gonzalez-Angulo, R. M. (2009). Metformina e Respostas patológicas completas à quimioterapia neoadjuvante em doentes diabéticos com cancro da mama. J. Clin. Oncol. 27, 3297–3302.
Kalinsky, K., Tripulação, K. D., Refice, S., Xiao, T., Wang,A., Feldman, S. M., Taback, B., Ahmad, A., Cremers, S., Hibshoosh, H., et al.(2014). Ensaio pré-cirúrgico da metformina em doentes com excesso de peso e obesos com cancro da mama recentemente diagnosticado. Investimento No Cancro. 32, 150–157.
Kanugula, A. K., Gollavilli, P. N., Vasamsetti, S. B.,Karnewar, S., Gopoju, R., Ummanni, R., e Kotamraju, S. (2014). A proibição da proliferação e invasão do cancro da mama induzida pela estatina envolve a atenuação do transporte do ambiente: intermediação do óxido nítrico e dos mecanismos defensivos antioxidantes. FEBS J. 281, 3719-3738.
Kim, H. J., Kwon, H., Lee, J. W., Kim, H. J., Lee, S. B.,Parque, H. S., Sohn, G., Lee, Y., Koh, B. S., Yu, J. H., et al. (2015). Metforminaumenta a sobrevivência em doentes diabéticos com cancro da mama HER2 positivo, receptores hormonais positivos. Breast Cancer Res. BCR 17, 64.
Kim, J., Lopes, W., Kim, E. K., Kim, M. K., Paik, N.-S.,Jeong, S.-S., Yoon, J. H., Parque, C. H., Ahn, S. H., Kim, L. S., et al. (2014).Ensaio aleatorizado de fase II com neoadjuvante metformina mais Letrozol versus placeboplus Letrozol para o cancro da mama pós-menopáusico positivo para o receptor de estrogénio (meteoro). Cancro da BMC 14, 170.
Kodach, L. L., Jacobs, R. J., Voorneveld, P. W.,Wildenberg, M. E., Verspaget, H. W., van Wezel, T., Morreau, H., Hommes, D. W.,Peppelenbosch, M. P., van den Brink, G. R., et al. (2011). As estatinas aumentam a sensibilidade das células do cancro colorectal, induzindo reprogramação epigenética e reduzindo a “resistência” da célula do cancro colorectal através da via morfogenética óssea. Gut 60, 1544-1553.
Kozar, K., Kaminski, R., Legat, M., Kopec, M., Nowis,D., Skierski, J., Koronkiewicz, M., Jakóbisiak, M., e Golab, J. (2004).A cerivastatina demonstra uma maior actividade antitumoral contra as linhas celulares do cancro da mama humano quando utilizada em associação com doxorrubicina ou cisplatina. T.J. Oncol.Kroemer, G., and Pouyssegur, J. (2008). Tumor celular: Calcanhar de Aquiles do cancro. Célula De Cancro 13, 472-482.Kwan, M. L., Habel, L. A., Flick, E. D.,Quesenberry, C. P., and Caan, B. (2008). O uso pós-diagnóstico de estatina e recorrência do cancro da mama num estudo prospectivo de coorte de cancros mamários em estadoprecto. Breast Cancer Treat. 109, 573–579.
Lacerda, L., Ribeiro, J. P., Liu, D., Larson, R., Li, L.,Masuda, H., Brewer, T., Debeb, B. G., Xu, W., Hortobágyi, G. N., et al. (2014).A sinvastatina radiosensibiliza linhagens diferenciadas e semelhantes às do cancro da mama e está associada a um melhor controlo local em doentes com cancro da mama inflamatório tratados com radiação pós-mastectomia. Células Estaminais Transl. Med.3, 849–856.
Cordeiro, R., Fiorillo, M., Chadwick, A., Ozsvari, B.,Reeves, K. J., Silva, D. L., Clarke, R. B., Howell, S. J., Cappello, R. A.,Martinez-Outschoorn, U. E., et al. (2015a). A doxiciclina para baixo-regula o ADN-PK e a radiosensibiliza as células iniciadoras do tumor: implicações para uma terapêutica mais eficaz de irradiação. Oncotarget 6, 14005-14025.Lamb, R., Ozsvari, B., Lisanti, C. L., Tanowitz, H. B.,Howell, A., Martinez-Outschoorn, U. E., Sotgia, F., e Lisanti, M. P. (2015b).Antibióticos que visam a mitocôndria efetivamente erradicar as células estaminais cancerosas, através de vários tipos de tumor: tratar o câncer como uma doença infecciosa.Oncotarget 6, 4569-4584.Lehman, D. M., Lorenzo, C., Hernandez, J., and Wang, C. (2012). Estatina utilização como moderador da metformina efeito sobre o risco de ProstateCancer nos doentes diabéticos tipo 2. Cuidados Com A Diabetes 35, 1002-1007.Lin, C., Lo, M., Moody, R., Stevers, N., Tinsley,S., and Sun, D. (2018). A doxiciclina destina‑se a células cancerígenas mamárias positivas à aldeído desidrogenase. Oncol. Rep.
Liu, B., Yi, Z., Guan, X., Zeng, Y.-X., And Ma, F.(2017). A relação entre estatinas e prognóstico do câncer de mama varia de tipo de sistatina e tempo de exposição: uma meta-análise. Breast Cancer Treat. 164,1–11.
Liu, H., Scholz, C., Zang, C., Schefe, J. H., Habbel,P., Regierer, A. C., Schulz, C. O., Possinger, K., e Eucker, J. (2012).A metformina e o inibidor do mTOR everolimus (RAD001) sensibilizam as células cancerígenas da mama para o efeito citotóxico in vitro dos medicamentos quimioterapêuticos. AnticancerRes. 32, 1627–1637.
Liu, X., Romero, I. L., Litchfield, L. M., Lengyel, E.,e Locasale, J. W. (2016). A metformina visa o metabolismo central do carbono e as necessidades mitocondriais em cancros humanos. Célula Metab. 24, 728–739.Ma, J., Guo, Y., Chen, S., Zhong, C., Xue, Y.,Zhang, Y., Lai, X., Wei, Y., Yu, S., Zhang, J., et al. (2014). Metformina potenciestamoxifeno mediado inibição do crescimento tumoral no carcinoma da mama ER-positivo. BMCCancer 14, 172.
Manthravadi, S., Shrestha, A., and Madhusudhana, S.(2016). Impact of statin use on cancer recurrence and mortality in breastcancer: A systematic review and meta-analysis. T. J. Cancer 139, 1281-1288.
Marcos, M., Klingbiel, D., Mey, U., Winterhalder, R.,Rothermundt, C., Gillessen, S., von Moos, R., Pollak, M., Manetsch, G.,Strebel, R., et al. (2019). Impacto da adição de metformina à abiraterona doentes com carcinoma da próstata resistente à castração, com progressão de doença durante o tratamento com abiraterona (MetAb-Pro): Fase 2 PilotStudy. Clin. Genitourin. Cancer 17, e323-e328.Martin-Castillo, B., Pernas, S., Dorca, J., Álvarez, I., Martínez, S., Pérez-Garcia, J. M., Batista-López, N., Rodríguez-Sánchez, C. A., Amillano, K., Domínguez, S., et al. (2018). A Fase 2 trial ofneoadjuvant metformina em combinação trastith trastuzumabe e química em womenwith precoce HER2-câncer de mama positivo: o estudo METTEN. Oncotarget 9,35687-35704.
Mokhtari, R. B., Homayouni, T. S., Baluch, N.,Morgatskaya, E., Kumar, S., Das, B., e Yeger, H. (2017). Combination therapyin combating cancer. Oncotarget 8, 38022-38043.Muck, A. O., Seeger, h., and Onsallwiener, D. (2004).Efeito inibitório das estatinas na proliferação do cancro da mama humano cells.Int. J. Clin. Farmacol. Ther. 42, 695–700.Mukhopadhyay, T., Sasaki, J., Ramesh, R., and Roth, J. A. (2002). O mebendazol provoca um efeito Antitumor potente nas linhagens celulares do cancro humano, tanto in Vitro como in Vivo. Clin. Cancer Res. 8, 2963-2969.Murtola, T. J., Visvanathan, K., Artama, M., Vainio, H., and Pukkala, E. (2014). Statin use and breast cancer survival: a nationwidecohort study from Finland. PloS um 9, e110231.Nanni, O., Amadori, D., De Censi, A., Rocca, A., Freschi, A., Bologna, A., Gianni, L., Rosetti, F., Amaducci, L., Cavanna,L., et al. (2019). Metformina mais quimioterapia versus quimioterapia isoladamente no tratamento de primeira linha do cancro da mama metastático HER2 negativo. O ensaio clínico MYMErandomized, Fase 2. Breast Cancer Treat. 174, 433–442.
Nimako, G. K., Wintrob, Z. A. P., Sulik, D. A., Donato,J. L., e Ceacareanu, A. C. (2017). Benefício sinérgico da estatina e da Metforminina doenças malignas gastrointestinais. J. Pharm. Impact. 30, 185–194.
Niraula, S., Dowling, R. J. O., Ennis, M., Chang, M. C.,Feito, S. J., Capa, N., Escallon, J., Leong, W. L., McCready, D. R., Reedijk,M., et al. (2012). Metformina no cancro da mama em fase precoce: uma janela prospectiva de estudo de oportunidade neoadjunto. Breast Cancer Treat. 135, 821–830.Nygren, P., and Larsson, R. (2014). Reposicionamento do fármaco do banco ao lado da cama: remissão tumoral pelo medicamento anti-helmíntico mebendazolein cancro metastático do cólon refractário. Acta Oncol. 53, 427–428.
Orecchioni, S., Reggiani, F., Talarico, G., Mancuso,P., Calleri, A., Gregato, G., Labanca, V., Noonan, D. M., Dallaglio, K., Albini,A., et al. (2015). As biguanidas metformina e a fenformina inibitangiogénese, o crescimento local e metastático do cancro da mama, visando ambas as células neoplásicas e microambientais. T. J. Cancer 136, E534-544.
Ozsvari, B., Sotgia, F., And Lisanti, M. P. (2017). Uma nova abordagem independente da mutação à terapia do cancro: inibir o SRA oncogénico e a MYC, direccionando a biogénese mitocondrial. Aging 9, 2098-2116.Pantziarka, P., Bouche, G., Meheus, L., Sukhatme, V., and Sukhatme, V. P. (2014). Medicamentos reutilizáveis em Oncologia (refeito)—mebendazol Asan agente anti-cancro. Ecancermedicalscience 8.Peiris-Pagès, M., Sotgia, F., And Lisanti, M. P. (2015). Doxiciclina e alvos terapêuticos das células cancerosas de resposta a danos do ADN: medicamento antigo, novo objectivo. Oncoscience 2, 696-699.
Rahmani, J., Manzari, N., Thompson, J., Gudi, S. K.,Chhabra, M., Naik, G., Mousavi, S. M., Varkaneh, H. K., Clark, C., e Zhang, Y.(2019). O efeito da metformina nos biomarcadores associados ao cancro da mama: uma revisão sistemática, meta-análise e resposta à dose de ensaios clínicos aleatórios. Clin. Transl. Oncol.Scatena, C., Roncella, M., Di Paolo, A., Aretini, P., Menicagli, M., Fanelli, G., Marini, C., Mazzanti, C. M., Ghilli, M., Sotgia, F.,et al. (2018). A doxiciclina,um inibidor da Biogénese mitocondrial, reduz efectivamente as células estaminais cancerígenas (CSCs) em doentes com cancro da mama em fase precoce: estudo-piloto clínico. Frente. Oncol. 8.
Seeger, H., Wallwiener, D., and Mueck, A. O. (2003).As estatinas podem inibir a proliferação in vitro de células cancerígenas da mama humana. Expo.Clin. Endocrinol. Diabetes Desligada. J. Ger. Soc. Endocrinol. Ger. Diabetes Assoc.111, 47–48.Skoda, J., Borankova, K., Jansson, P. J.,Huang, M. L.-H., Veselska, R., and Richardson, D. R. (2019). Objectivo farmacológico das mitocôndrias nas células estaminais cancerígenas: uma organela antiga na encruzilhada das terapias anti-cancerígenas a nível nacional. Farmacol. Res. 139, 298-313.
Sonnenblick, A., Agbor-Tarh, D., Bradbury, I., DiCosimo, S., Azim, H. A., Fumagalli, D., Sarp, S., Wolff, A. C., Andersson, M.,Kroep, J., et al. (2017). Impacto da Diabetes, insulina e metformina utilização no rendimento de doentes com cancro da mama do Receptor 2–Positiveprimário do Factor de crescimento epidérmico humano: análise do ensaio aleatorizado de fase III do ALTTO. J. Clin. Oncol. 35, 1421–1429.Van Wyhe, R. D., Rahal, O. M.= = referências = = = = ligações externas = = Efeito das estatinas na recorrência e mortalidade do cancro da mama: uma revisão.O Cancro Da Mama É O Alvo. 9, 559–565.Vázquez-Martin, A., Oliveras-Ferraros, C., Cufí, S., Del Barco, S., Martin-Castillo, B., Lopez-Bonet, E., and Menendez, J. A. (2011).O fármaco anti-diabético metformina suprime o proteinCD24 associado à metástase nas células do cancro da mama MDA-MB-468 tripla-negativas. Oncol. Rep. 25.135–140.
Vintonenko, N., Jais, J.-P., Kassis, N., Abdelkarim,M., Perret, G. Y., Lecouvey, M., Crepin, M., e Di Benedetto, M. (2012).Análise transcriptoma e actividade in vivo da fluvastatina versus zoledronicácida num modelo de metástase do cancro da mama em murinos. Mol. Farmacol. 82, 521–528.
Wahdan-Alaswad, R. S., Cochrane, D. R., Spoelstra, N. S.,Howe, E. N., Edgerton, S. M., Almeida, S. M., Thor, A. D., e mais Rico, J. K.(2014). O abate induzido pela metformina de células triplamente negativas do cancro da mama é mediado pela redução da ácido gordo sintase via miRNA-193b. Horm. Cancro 5374-389.Wang, Z.-S., Huang, H.-R., Zhang, L.-Y., Kim, S., He, Y., Li, D.-L., Farischon, C., Zhang, K., Zheng, X., Du, Z.-Y., et al. (2017).Estudo mecanístico dos efeitos inibitórios da metformina e da incombinação da atorvastatina nas células cancerígenas da próstata in Vitro e in Vivo. Biol. Farmacêutico. Touro.40, 1247–1254.
Wolfe, A. R., Debeb, B. G., Lacerda, L., Larson, R.,Bambhroliya, A., Marques, X., Bertucci, F., Finetti, P., Birnbaum, D., Van Laere,S., et al. (2015). A sinvastatina previne a cancermetastase mamária tripla-negativa em modelos pré-clínicos através da regulação dos Cancerros mamários da FOXO3a. Tratar. 154, 495–508.Xu, H., Chen, K., Jia, X., Tian, Y., Dai, Y., Li,D., Xie, J., Tao, M., and Mao, Y. (2015). O uso de metformina está associado a Bettersurvival em doentes com cancro da mama com Diabetes: uma Meta-análise. TheOncologist 20, 1236-1244.
Inhame, C., Esteva, F. J., Patel, M. M., Raghavendra, A. S.,Ueno, N.T., o Moldador, S. L., Hess, K. R., Shroff, G. S., Hodge, S., Koenig, K. H.,et al. (2019). Eficácia e segurança da Associação de metformina, everolimus e exemestano em doentes pós-menopáusicos com excesso de peso e obesos com cancro da mama metastático,hormonal positivo, HER2-negativo: um estudo de fase II.Investir. Novas Drogas 37, 345-351.Yao, H., He, G., Yan, S., Chen, C., Song, L., Rosol, T.J., and Deng, X. (2017). Cancro da mama triplo-negativo: existe um tratamento no horizonte? Oncotarget 8, 1913-1924.Zhang, L., Guo, M., Li, J., Zheng, Y., Zhang, S.,Xie, T., e Liu, B. (2015). Descoberta baseada em biologia de sistemas de um potencial Atg4bagonista (Flubendazol) que induz a autofagia no cancro da mama. Mol. Biosyst.11, 2860–2866.
Zhang, L., Xu, L., Zhang, F., And Vlashi, E. (2017).A doxiciclina inibe o fenótipo das células estaminais cancerígenas e a transição entre epitelial e mesenquimal no cancro da mama. Ciclo Celular Georget. Tex16, 737-745.Zhang, L., Bochkur Dratver, M., Yazal, T., Dong, K., Nguyen, A., Yu, G., Dao, A., Bochkur Dratver, M., Duhachek-Muggy, S., Bhat,K., et al. (2019a). O mebendazol potencia a radioterapia no cancro do último Negativo3. T. J. Radiat. Oncol. Biol. Phys. 103, 195–207.= = localidades na vizinhança = = o diagrama seguinte representa as localidades num raio de 16 km ao redor de St.Louis. Participação de metformina e AMPK na resposta rádio e prognóstico do cancro da mama de tipo lúminal versusbasal tratado com radioterapia. Oncotarget 5, 12936-12949.Zhang, Z.-J., Yuan, J., Bi, Y., Wang, C., e Liu, Y.(2019b). O efeito da metformina nos biomarcadores e sobrevivências do cancro da mama-uma revisão sistemática e meta-análise dos ensaios clínicos aleatorizados. Farmacol.Res. 141, 551-555.Zhong, S., Zhang, X., Chen, L., Ma, T., Tang, J., andZhao, J. (2015). Utilização da estatina e mortalidade em doentes oncológicos: revisão sistemática e meta-análise de estudos observacionais. Tratamento Do Cancro. Rev. 41, 554-567.
