COC-protokollen i brystkræft
dette dokument er et sammendrag af begrundelsen og nogle af de nuværende videnskabelige beviser, der understøtter brugen af COC-Protokolmedicinerne sammen med standardbehandlinger for brystkræft. Vi forstår, at kræft er en meget personlig tilstand, og hver patient har et unikt sæt udfordringer. For mere information om din egen personlige situation bedes du kontakte Care Oncology Clinic på 800-392-1353 i USA eller besøge hjemmesiden på https://careoncology.com.
Hvis du er ny til pleje onkologi Bemærk venligst følgende:
- du behøver ikke at rejse. Du kan mødes med vores team af onkologer og onkologiske sygeplejersker gennem sikker video for løbende support.
- Care Oncology supplement protocol medicin sendes direkte til dit hjem fra vores amerikanske Partnerapoteker og kan bruges sammen med din standard for plejebehandling.
- Vi er utroligt stolte over at kunne meddele, at vi har bestået Valideringsinstituttets ekstremt strenge valideringsproces med dataanalyse, resultatkrav og værdiberegning. Vi har arbejdet hårdt for at komme til dette punkt. Tidligt, Vi erkendte den enorme værdi et ansvarligt leveret program af repurposed lægemidler, der tilbydes kræftpatienter, endnu, det blev ikke tilbudt i skala. For fire år siden satte vi os for at ændre dette ved at vide, at det var et maraton, ikke en sprint.
COC-protokollen og brystkræft: nøglepunkter
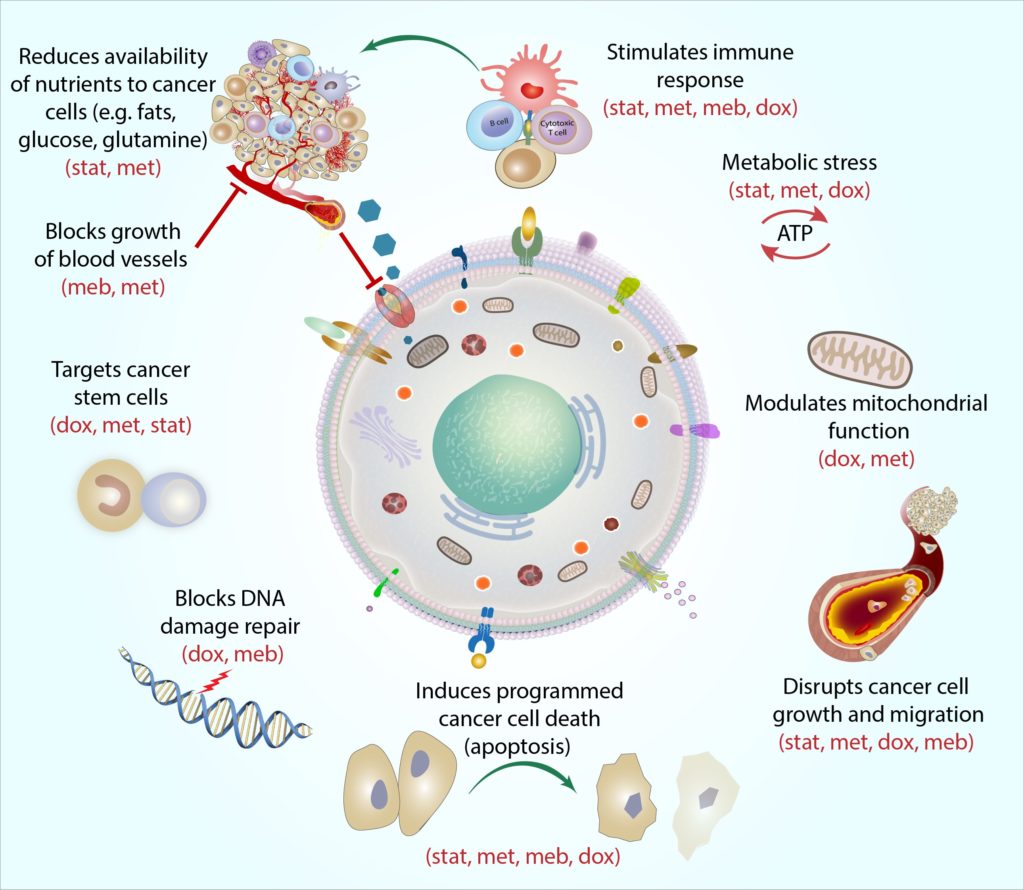
- The cocprotocol er en kombination af fire almindeligt ordinerede lægemidler(atorvastatin, metformin, mebendasol og doksycyclin) med potentialet tilmål brystkræft og hjælpe med at forbedre effektiviteten af standard anticancerterapier.
- et antal observationsstudier har knyttet metformin-eller statinbrug til forbedrede resultater hos patienter med brystkræft. Laboratorietundersøgelser af brystkræftceller dyrket i retter viser, at metformin og statiner direkte kan målrette og skade brystkræftceller – svække dem og gøre dem mere sårbare over for standardbehandlinger.
- resultater fra små ‘mulighedsvindue’ kliniske forsøg hos patienter med operabelbrystkræft viser generelt, at indtagelse af metformin eller statin før kirurgi kan føre til potentielt positive ændringer i molekylære markører for kræft, herunder dem, der regulerer brystkræftcellevækst og opdeling. Flere forsøgundersøgelse af, om metformin eller statiner kan påvirke sygdomsrespons er i gang.kan blokere væksten af både HER2-positive og triple-negative brystkræftstamceller inkuberet i retter i laboratoriet og hjalp med at forbedre resistensrelaterede ændringer induceret af standard kemoterapi paclitaksel. har netop nået tidlige kliniske forsøg med brystkræftpatienter. Resultater fraden første lille undersøgelse viser, at patienter med tidlig brystkræft, som tog doksycyclin i kun 14 dage før operationen, reducerede niveauerne af molekylære markører for tilstedeværelse af kræftstamceller med et gennemsnit på ca.40%. Gavnlige virkninger blev noteret for alle patienter undtagen en af de behandlede(8/9).kan bremse væksten og opdelingen af brystkræftceller dyrket i laboratoriet,herunder brystkræftceller, der er mere resistente over for kemoterapi. Meremenneskelige undersøgelser er nødvendige.
COC-protokollen og brystkræft: Offentliggjort evidens
TheCOC-protokollen er et kombinationsregime med fire almindeligt ordinerede lægemidler,hver med bevis for metabolisk baseret anticanceraktivitet og velforståede sikkerhedsprofiler. Disse lægemidler er: atorvastatin, atorvastatin og metformin. Nogle af de undersøgelser, der understøtter brugen af theCOC-protokollen som en supplerende terapi sammen med de nuværende standardbehandlinger for brystkræft er præsenteret nedenfor. Dette bevis kommer hovedsageligt fra laboratorie undersøgelser, store epidemiologiske undersøgelser (som undersøger sammenhængen mellem at tage medicin og brystkræftresultater i grupper af individer) og tidlige kliniske forsøg.
Dukan bemærke, at mange af nedenstående undersøgelser kun fokuserer på individuelle COC-Protokolmedicin. Vi er de første til at designe en supplerende terapi, der kombinerer allfour. Vi tror, at kombinationen af disse lægemidler vil opnå de størsteresultater, og vores eget forskningsprogram, kaldet METRICS, producerer allerede mereaf de beviser, der er nødvendige for at vise dette. Du kan læse mere om, hvorfor vi mener, at disse lægemidler fungerer så godt sammen for at hjælpe med at målrette kræft, og om selve det metriske program, i yderligere afsnit nedenfor.
Metformin og brystkræft
Metforminuse forbundet med potentielle fordele ved brystkræft
Mangeobservationsstudier giver nu bevis for brugen af metformin ibrystkræft. Metformin er licenseret til behandling af type 2-diabetes, ogobservationsundersøgelser i grupper af patienter med diabetes har tendens til at vise, atdem, der tager metformin, har bedre chancer for et forbedret resultat, hvis de udvikler brystkræft (Aksoy et al., 2013; El – Sheredy og El-Sheredy, 2014; Sonnenblick et al., 2017).Metforminbrug har været forbundet med forbedret overlevelse hos patienter med brystcancer (Kim et al., 2015; Al., 2015), forbedret respons på brystkræftbehandling (Jiralerspong et al., 2009), og mindre chance for, at brystkræft spreder sig andrelapse (Chen et al., 2017; Jacob et al., 2016).
det er sandsynligt, at nogle af de gavnlige virkninger af metformin, der findes i disse undersøgelser,skyldes metformins evne til at forbedre en patients diabetes og/eller vægt ved at reducereglucoseniveauer, hvilket kan medvirke til at reducere risikoen for at udvikle brystkræft ogforbedre en patients sundhed og evne til at tackle brystkræft, hvis de gør det (Hatoum og Mcgovan, 2015). Men laboratorieundersøgelser viser også, at metformin ergør mere end dette. Faktisk kan metformin aktivt arbejde direkte modbrystkræftceller, hvilket reducerer deres evne til at optage og bruge energi og blokererderes evne til at vokse, sprede, overleve og tilbagefald (Alimova et al., 2009; Hadad et al., 2014; Orecchioni et al., 2015).
forskelligetyper af brystkræft kræver forskellige behandlinger. Specifikt til behandling af human epidermal vækstfaktorreceptor 2 (HER2)positiv brystkræft. Tamoksifen er effektiv mod østrogenreceptor (er)positiv brystkræft. Det er vigtigt, at kræftcellestudier i laboratoriet demonstrererat metformin har anticanceraktivitet mod mange forskellige brystkræftcelletyper, herunder er positive (Giles et al., 2018), HER2 positiv (Chen et al., 2013) ogpotentielt sværere at behandle undertyper såsom triple-negative kræftceller (Deng et al., 2012; Martin et al., 2011; Jørgensen et al., 2014).Dette betyder, at metformin har potentialet til at arbejde effektivt sammen med standardbehandlinger for brystkræft, uanset kræftundertypen.
Metformintargets brystkræft stamceller
Metforminhar også vist sig at målrette brystkræft stamceller (Bao et al., 2014; Cufiet al., 2012; Hirsch et al., 2009).Denne aktivitet mod brystkræftstamceller sammen med dens evne til atmåle forskellige undertyper af brystkræft, hjælper med at forklare, hvorfor laboratoriestudierhvordan det kan fungere i kombination med en række standardbehandlinger, herundergrastusumab (Cufi et al., 2012), ma et al., 2014), ogstandard kemoterapimidler (Iliopoulos et al.,2011). Dyr og celleforsøg viser, at metformin beggehjælper med at forbedre effektiviteten af standardbehandlinger (Bradford and Khan,2013; Liu et al., 2012; Chang et al., 2014) ogforsinkelser også tilbagefald af kræftformer, der er blevet behandlet med disse terapier (Iliopoulos et al.,2011). desuden viser laboratoriestudier også, at metformin også kan bidrage til at forhindre brystkræftceller i at blive resistente over for kemoterapi og forbedre følsomheden af allerede resistente kræftceller til behandling (Davies et al., 2017).
Metforminforbedrer markører for brystkræft i tidlige kliniske studier
som et resultat af den store mængde understøttende data for metformin i brystkræftgenereret ved observations-og laboratorieundersøgelser er forskellige kliniske forsøg, der undersøger metformin i brystkræft, nu i gang (Camacho et al., 2015).Samlet set begynder kollektive analyser af resultaterne af disse tidlige stadieforsøg(metaanalyse) at antyde en generelt positiv effekt, nårmetformin føjes til standardkræftterapier (Rahmani etal., 2019; Chang et al., 2019b).
en række ‘mulighedsvindue’-forsøg undersøger, om det at tage metforminfor omkring to uger før operationen kan hjælpe med at forbedre molekylære markører for sygdommen hos patienter med operabel brystkræft i det tidlige stadium. Resultater fra disse undersøgelser antyder generelt, at indtagelse af metformin kan føre til potentielt positive ændringer i molekylære markører for kræft, herunder dem, der regulerer brystkræftcellevækst og opdeling (Bonanni et al., 2012; Torben et al., 2013; Hadad et al., 2011; Kalinsky et al., 2014; Niraula etal., 2012), samt potentielt forbedring af reguleringen afhormoner og andre faktorer for nogle patienter (Kalinsky et al., 2014; Niraula et al., 2012). Disse undersøgelser hjælper nu forskere med at forstå præcis, hvordan og hvornår metformin kunne hjælpepatienter med brystkræft (Bonanni etal., 2012; DeCensi et al., 2014, 2015; Rahmani et al., 2019).
Phase2 ‘neoadjuvant’ – forsøg er generelt længere og mere komplekse forsøg, der undersøger metformin sammen med kurser med standardbehandlinger til behandling af forskellige typer brystkræft. Formålet med disse forsøg er at etablere ifmetformin virkelig hjælper med at forbedre effektiviteten af standardbehandlinger, foreslår aslab-undersøgelser (Kim et al., 2014). I en nylig undersøgelse (METTEN-undersøgelsen) (Martin-Castillo etal., 2018), hos kvinder med HER2-positiv tidlig brystcancer, reagerede flere patienter, der tog metformin, godt på kemoterapi/målrettet behandling (65,5%) sammenlignet med patienter, der ikke tog metformin (58,6%). Denne forskel var ikke statistisk signifikant; hvilket betyder, at dette resultat kunne nås ved en tilfældighed. Fase 2-forsøg er imidlertid generelt underbygget for at nå statistisk signifikans på denne måde, og forskerne kaldte for progression til større fase 3-forsøg, som kan udformes korrekt for at bestemme, hvor reel denne effekt er (Martin-Castillo etal., 2018). Potentielt opmuntrende resultater fra andre fase 2-forsøg, såsom en hos overvægtige personer med metastatisk brystkræfthar også været rapporteret (Yam et al.,2019). Det er også værd at bemærke det som forventet, ikke allemetformin kræftforsøg har rapporteret positive resultater. For eksempel har andre fase 2-forsøg fundet, at metformin med standardterapi ikke havde nogen reelforskel sammenlignet med standardterapi alene under visse omstændigheder (Mark et al., 2019; Nanni et al., 2019). Vi tror detmetformin vil være mest effektiv i enhver indstilling, når den gives i kombination med andre anti-metaboliske medicin.
større undersøgelser er nødvendige for at hjælpe med at løse disse problemer, og en fase 3 forsøg er nu undergang for at undersøge metformin i brystkræft. Selvom forsøget ikke er afsluttet før 2020, viste de første resultater fra de første 6 måneder af forsøget, at patienter, der begyndte at tage metformin straksefter afslutningen af operationen og standard kemoterapicykler, havde gunstigeændringer i en molekylær markør for brystkræft (dyvling et al., 2018), ogforbedrede metaboliske faktorer., 2015).
statiner og brystkræft
observationsstudier forbinder statiner med bedre brystkræftresultater
statiner gives normalt for at hjælpe med at håndtere hjerte-kar-sygdomme. Imidlertid har observationsundersøgelser af store grupper af mennesker, der tager statiner, også fundet detindivider med brystkræft, der tager statiner, kan også have reduceret risikoen for, at deres kræft gentager sig efter behandling sammenlignet med patienter, der ikke tager statiner (Ahern et al., 2014; Manthravadi et al., 2016). For eksempel i enundersøgelse hos næsten 2000 overlevende af brystkræft, dem, der begyndte at tagepletter inden for tre år efter diagnosen, havde en reduceret chance for, at deres kræftkom tilbage (kV et al., 2008). I en anden undersøgelse var kun 6 måneders statinbrug efter diagnosen knyttet tilforbedrede tilbagefaldshastigheder (Chae et al., 2011).
det er vigtigt,at den gavnlige virkning af statiner i disse og andre undersøgelser var stærkere knyttet til mere fedtopløselige ‘lipofile’ statiner (som Atorvastatin). I nogle laboratorieundersøgelser har lipofile statiner også vist sig at have superioranticancereffekter på cellulært niveau sammenlignet med mindre fedtopløselige statiner (Liu et al., 2017).
observationsundersøgelser forbinder også statinbrug med forbedret sygdomsrespons på behandling ogoverlevelse hos patienter med brystkræft, selv for patienter med brystkræfttyper, der kan være mere aggressive (Manthravadi et al., 2016; Murtola et al., 2014; Jong et al., 2015). For eksempel i en undersøgelse hos patienter med inflammatorisk brystkræft, patienter, der tog atorvastatin, mens de blev behandlet for kræft, havde en længere periode, før deres sygdom skred frem sammenlignet med dem, der ikke tog et statin (brygger et al., 2013).
Statinstarget brystkræftceller
statiner,især fedtopløselige lipofile statiner som atorvastatin, reducere vækstog opdeling af brystkræftceller og øge brystkræftcelledød ilaboratorieundersøgelser
German Diabetes Association”,”page”:”47-48″,”volume”:”111″,”issue”:”1″,”source”:”PubMed”,”abstract”:”effekten af fem statiner, dvs.atorvastatin, Fluvastatin, lovastatin, pravastatinog simvastatin blev undersøgt på proliferationen af den humane brystkræftcellelinje MCF-7. Alle statiner undtagen pravastatin var i stand til at hæmmecelleproliferation op til 90% i en koncentration på 50 mikro M. Mellemeffektive statiner der blev ikke observeret nogen signifikant forskel, der indikerer enklassespecifik virkning. Disse data tyder på, at statiner kan have klinisk betydning i den primære forebyggelse af human brystkræft ud over dereskolesterolsænkende virkning. Der skal dog afventes kliniske beviser, før der drages yderligere konklusioner.”, “DOI”: “10.1055 / s-2003-37501″,”ISSN”:”0947-7349″,”note”:”PMID:12605351″,”journalforkortelse”: “eksp. Clin. Endocrinol.Diabetes”, “Sprog”:”eng”,”forfatter”:,”udstedt”: {“dato-dele”:]}}}],”skema”:”https://github.com/citation-style-language/schema/raw/master/csl-citation.json”} (Alarcon Martins etal., 2018; m Kurtck et al., 2004; Seeger et al., 2003).Undersøgelser viser også, at statiner potentielt kan blokere invasiviteten af brystkræftceller i laboratoriet, hvilket tyder på, at de også kan hjælpe langsom kræftspredning tilandre dele af kroppen (Kanugula et al., 2014; Ulf et al., 2015). I en musemodel af metastatisk brystkræft forsinkede statintreatment væksten af kræft,som allerede havde spredt sig med op til 80%, med gavnlig aktivitet noteret inden for en uge efter start af behandlingen (Vintonenko et al.,2012). andre undersøgelser viser også, at statiner kan hjælpe med at sensibilisere brystkræftceller tilStandard strålebehandling og kemoterapibehandlinger., 2004; Jørgen et al., 2017). En undersøgelse fundetsimvastatin kunne sensibilisere triple-negative eller inflammatoriske brystkræftcellertil strålebehandling i laboratoriet. Den samme undersøgelse fortsatte med at observere hos en patientbefolkning, at kvinder med inflammatorisk brystkræft, der tog statiner under deres behandling, havde mindre chance for, at deres kræft kom tilbage inden for 3 år (Lacerda et al., 2014).
I lighed med metformin kan statiner producere disse anticancereffekter på tværs af forskelligebrystkræfttyper, herunder er-positiv, HER2-positiv og triple-negativbrystkræft. Faktisk viser nogle laboratoriestudier, at statiner er særligt effektivemod triple-negative brystkræftceller (Campbell et al., 2006; Yao et al., 2017).
kliniske forsøg, der undersøger statiner i brystkræft, er nu i gang
et par kliniske forsøg i tidlige stadier viser nu robuste positive resultater med hensyn tilstatiner i brystkræft. Tidlige fase ‘vindue af muligheder’ forsøg harundersøgt, hvis tidligt, prækirurgiske statiner kan bidrage til at forbedre molekylærmarkører af sygdommen hos patienter med operabel sygdom. Indtil videre viser disse undersøgelser forbedrede kræftmolekylære profiler hos patienter med statinbehandling,hvilket tyder på atorvastatin og andre statiner i denne sammenhæng kan have gavnligevirkninger på kræftcellevækst og opdeling og celledød, selv hos kvinder medhøjkvalitets mere aggressive tumorer (Bjarnadottir et al., 2013, 2015; Feldt et al., 2015; Torben et al., 2010).
baseret på disse lovende resultater er der nu en række fase 2-undersøgelser, der undersøgeradjunktive statiner til en række forskellige typer brystkræft, herundertriple-negativ brystkræft. Disse undersøgelser skal hjælpeetablere, hvordan statiner kan hjælpe patienter med brystkræft.en potentiel anticancerbehandling er for det meste baseret på lovende mekanistikundersøgelser og overbevisende rapporter fra casestudier hos kræftpatienter (Nygren and Larsson,2014; Pantsiarka et al., 2014).
mebendasol menes at dræbe kræftceller dels ved at forstyrre specielle strukturer indecellen, kaldet mikrotubuli (Pantsiarka et al.,2014). Det virker på samme måde som vincristin, achemotherapy lægemiddel,der i øjeblikket anvendes til behandling af visse typer kræft, herunder avanceret stadium brystkræft., 2017).
undersøgelser af brystkræftceller dyrket i laboratoriet viser, at mebendasol og relaterede lægemidlerfra samme klasse kan bremse væksten og opdelingen afflere forskellige typer brystkræftceller, herunder celler resistente over forkemoterapi (Coyne et al., 2013; Hou et al., 2015; Mukhopadhyay et al., 2002). I en undersøgelse reducerede mebendasol kraftigt overlevelsen af kemoterapi-resistente brystkræftceller med så meget som 63,1% (Coyne et al., 2013).Undersøgelser har også vist robust anticanceraktivitet mod triple-negativ brystkræft (Hou et al., 2015; Chang et al., 2015). Det er vigtigt, at man i en undersøgelse også har vist sig direkte at målrette brystkræftstamceller (Hou et al., 2015).
Emerginglaboratory-baserede beviser tyder også på, at det kan øge aktiviteten af standard brystkræftbehandlinger som f.eks., 2015). I en laboratoriestudie øgede mebendasol effektiviteten af strålebehandling påtredobbelt-negative brystkræftceller og forhindrede resistens over for behandlingudvikling (Jang et al., 2019a). Derudover viste en række undersøgelser,der anvenderkemoterapi-resistente er/HER2-positive brystkræftceller,der blev dyrket i laboratoriet, konsekvent, at mebendasol ikke kun reducerede overlevelsen af kræftceller, det hjalp også med at supplere og forbedre aktiviteten af specielt udviklede målrettede former for brystkræftkemoterapimedicin epirubicin og gemcitabin (Coyne et al., 2014,2012, 2013).
Doksycyclin og brystkræft
Asidefra at være et effektivt antibiotikum besidder doksycyclin også andre ekstremtværdifulde egenskaber, herunder antiinflammatorisk og anticanceraktivitet. Dette giver doksycyclin et reelt terapeutisk potentiale til behandling af en række andresygdomme, herunder kræft (Bahrami et al., 2012). Labundersøgelser og dyreforsøg har længe vist, at doksycyclin kan blokere brystkræftcellevækst, division og bevægelse (Duivenvoorden et al., 2002; Fife og Sledge, 1995, 1998).Nyere undersøgelser viser også, at doksycyclin kan stoppe kræftceller frareparation af deres DNA, når det bliver beskadiget, for eksempel ved kemoterapi (Peiris-Pagriss et al.,2015). Faktisk viser laboratoriestudier, at doksycyclin kan hjælpeforbedre effektiviteten af kemoterapiaktivitet mod brystkræftceller (foroodi et al., 2009; Lamb et al., 2015a). for nylig er fokus faldet på at forstå, hvordan doksycyclin kan blokere brystkræftstamcellevækst., 2017; Chang et al., 2017). En meget nylig undersøgelse af celler dyrket i laboratoriet har vist, at doksycyclin kan blokere vækst af både HER2-positive og triple-negative brystkræftstamceller og hjalp med at forbedre resistensrelaterede ændringer induceret af standardkemoterapi paclitaksel (Lin et al.,2018). I en anden laboratorie undersøgelse, en kombinatorisk tilgangherunder doksycyclin meget effektivt udryddet brystkræft stamceller (Fiorillo etal., 2019). har netop nået tidlige kliniske forsøg med brystkræftpatienter. Resultater fraden første lille undersøgelse, der blev offentliggjort i Oktober 2018, viser, at patienter med brystkræft i tidlig fase, der tog doksycyclin i kun 14 dage førkirurgi reducerede niveauer af molekylære markører for tilstedeværelse af kræftstamcellermed et gennemsnit på omkring 40%. Gavnlige virkninger blev noteret for alle, undtagen en af de behandlede patienter (8/9) (Scatena et al., 2018).Større kliniske forsøg er nu i gang.
vores egne beviser: METRICS Study
Hvad er METRICS?
METRICS er vores egen in-housesearch program. Meget er allerede kendt om sikkerheden ogeffektiviteten af COC-protokollen medicin i kræft. Men det er også vores ansvar at erkende, at vi ikke har alle svarene, og at vi stadig skal generere klinisk forskning af god kvalitet, der undersøger COCProtocol hos patienter med kræft, for at sikre, at COC-protokollen er så effektiv og sikker som den kan være.
for at sætte os i stand til at finansiere denne forskning har vi udviklet et nyt, overkommeligt system, hvor vores kliniske undersøgelse, METRICS, i det væsentlige er ‘patientfinansieret’. Hver samtykkende patient, der kommer ind i klinikken, indrulles i målinger, og disse gebyrer hjælper med at finansiere undersøgelsen. Dette er en ny model for klinisk forskning, der tager sigte på at bygge bro over de finansierings-og dataglapper, der i øjeblikket hindrer genanvendelse og yderligere klinisk udvikling af allerede licenserede lægemidler.
METRICS første resultater
i en første succes forMETRICS blev resultater fra vores indledende pilotundersøgelse for nylig offentliggjort ipeer-gennemgået videnskabeligt tidsskrift Frontiers in Pharmacology. Papiret kan fås frit online her.METRICS pilotundersøgelsen var enobservational retrospektiv undersøgelse, hvilket betyder, at vores forskere kiggede tilbageog analyserede patientkliniske poster for at finde ud af, hvad der skete. De indsamlede data og registrerede resultaterne fra 95 patienter med en avanceret type hjernekræft kaldet glioblastom, der deltog i Care Oncology Clinic, og som tog den fulde COC-protokol sammen med deres sædvanlige standardbehandlinger. Denne undersøgelse havde ikke en kontrolgruppe, så vores forskere sammenlignede resultaterne fra målinger med tidligere offentliggjorte resultater fra tidligere undersøgelser hos patienter med samme type kræft, og som også tog standardbehandlinger. de første resultater tyder på, atpatienter, der deltog i vores klinik og tog COC-protokollen som en del af deressædvanlig pleje, var meget mere tilbøjelige til at overleve mindst 2 år (64.0% af patienterne i vores undersøgelse overlevede mindst 2 år sammenlignet med 27-29% for patienter inkluderet i tidligere offentliggjorte undersøgelser) og havde tendens til at have længere overlevelsestider generelt end normalt forventet for patienter med denne type kræft (patienter overlevede i gennemsnit 27 måneder i vores undersøgelse sammenlignet med15-16 måneder i tidligere undersøgelser)(Agravalet al., 2019).
disse resultater er ekstremtlover, men de er også stadig foreløbige. Vi ved endnu ikke nøjagtigt, hvordan COC-protokollen kan have påvirket overlevelsestider for eksempel, eller hvordan andre faktorer som visse patientkarakteristika også kan have påvirket disseresultater. Men dette første, indledende bevis er bestemt opmuntrende, og det antyder for os, at vi er på vej i den rigtige retning. Vores næste planlagtefase er at gennemføre en større, veldesignet undersøgelse. Du kan finde ud af mere omfremtidige METRICS planer ved at kigge online eller kontakte klinikken.
mere om COC-protokollen
Hvad er COC-protokollen?
COC-protokollen er enkombinationsbehandlingsregime bestående af licenserede lægemidler, specifikt designet af Care Oncology til supplerende brug sammen med en patients sædvanlige behandlinger (dvs.standard-of-care). de fire medikamenter, der er inkluderet i COC-Protokollregimen, er: metformin, Avery common anti-diabetes drug; atorvastatin, en type statin, der bruges til at styre kardiovaskulære tilstande; doksycyclin, en type antibiotikumofte brugt til behandling af kroniske infektioner som acne; og mebendasol, amedicin, der almindeligvis anvendes til behandling af parasitinfektioner hos børn og voksne.
Vi valgte disse firemediciner fra tusindvis af potentielle kandidater specifikt fordi de passer til vores forudbestemte udvælgelseskriterier. Disse kriterier omfatter solide beviser for effektivitet mod kræft, en sammenhængende virkningsmekanisme og vigtig en god sikkerhedsprofil. Disse tre centrale principper har formet vorestilgang fra begyndelsen.
sikkerhed er altafgørende
kræft er en kompleks sygdom med komplekse behandlinger, og vi mener, at tilføjelsen af yderligere terapier sammen med standardbehandlinger bør vurderes meget omhyggeligt. Ikke kun ud fra effektivitetsperspektivet, men også vigtigere med hensyn til sikkerhed. Derfor er hele vores tilgang baseret påbevis-for det meste offentliggjorte videnskabelige undersøgelser, og også i stigende grad vores egendata.
mangeforskellige lægemidler på markedet har i det mindste nogle offentliggjorte beviserunderstøtter deres relativt effektive anvendelse i kræft, men få af dissemedicin har niveauet af bevis for både sikkerhed og effektivitet, der varkræver for COC-protokollen. Der findes allerede store mængder detaljerede data for hver af protokolmedicinerne, hentet fra mange års brug i den generelle befolkning – og dette hjalp med at give os et afgørende forspring under udviklingen.
Vi har omhyggeligt søgt gennem årtiers offentliggjorte data om hver af COC-Protokolmedicinerne, undersøgt, hvordan de virker i forskellige patientpopulationer (herunder patienter med kræft) og på celle-og dyremodeller i laboratoriet. Disse data, sammen med vores egen kliniske erfaring, hjælper med at sikre, at vi har en god forståelse af, hvordan disse lægemidler vil opføre sig hos patienter med forskellige stadier og typer af kræft, både i kombination med hinanden og også i kombination med talrige andre kræftbehandlinger. Denne viden erparamount, og fra vores undersøgelser er denne type beviser bare ikke der endnu for mange andre off‑label anticancer drug kandidater – især når de gives inkombination.
Ananti-metabolisk terapi, der potentielt kan målrette mod enhver kræft
TheCOC-protokollen er designet til at virke ved at begrænse kræftcellernes samlede evne til at optage og bruge (dvs. ‘metabolisere’) energi.
kræftceller har brug for enormemængder energi for at overleve, og langt de fleste kræftformer bruger en adaptivproces kaldet aerob glykolyse for at generere den overdrevne energi, de har brug for (Kroemer andPouyssegur, 2008). Hver af medikamenterne i protokollen kan målrette modforskellige molekylære metaboliske processer involveret i og omkring aerobicglycolyse, og dette kan hjælpe med at sænke den samlede metaboliske hastighed for kræftcellen (Jang et al.,2013).
Vi mener, at COCProtocol-medicin kan fungere i kombination for konsekvent at begrænse energiforsyning og brug, samtidig med at kræftceller forhindres i at tilpasse sig og bruge andre veje til at optage energi (Jagust et al.,2019). Som følge heraf bliver kræftceller stadig svagere og mindre i stand til at optage og bruge næringsstoffer (f. eks. såsom glukose og essentialaminosyrer glutamin og arginin), de har brug for fra deres omgivelser., 2018; Liu et al., 2016).Dette gør det generelt vanskeligere for kræftceller at overleve, vokse og sprede sigi kroppen. Gradvist bliver de svækkede celler (herunder mere modstandsdygtige ogtidligere behandlingsresistente celler) mere sårbare over for angreb fraandre celledrabende kræftbehandlinger såsom strålebehandling, kemoterapi,hormonbehandling og målrettede terapier (Bradford andKhan, 2013; Chen et al., 2012; Lacerda et al., 2014; Lamb et al., 2015a; Pantsiarka et al., 2014). ved at målrette de tilpassede metaboliske mekanismer, der er fælles for de fleste kræftformer(men normalt ikke sunde celler), mener vi, at COC-protokollen kan være effektiv og selektiv for stort set enhver kræft uanset specifik type, stadium eller placering af kræft. Offentliggjorte epidemiologiske og laboratoriestudier i stigende gradstøtte den potentielt brede vifte af denne terapi (Chae et al., 2015, 2016; Iliopoulos et al., 2011; Lamb et al., 2015b; Pantsiarka et al.,2014).
mekanistisk sammenhæng i handling – kraften i kombination
den sande kraft i theCOC-protokollen ligger i den specifikke kombination af medicin, vi bruger. Vi udviklede protokollen ikke kun som et regime med fire individuelle behandlinger hver med kræftaktivitet, men også til at fungere som en enkelt kombineret behandling – med potentialet til at producere kraftige synergistiske effekter (Mokhtari et al., 2017).
hver medicin i COC-protokollen målretter kræftcellemetabolisme på en tydelig og komplementær måde, og vi har kaldt denne handling ‘mekanistisk sammenhæng’. Putsimpelthen beskriver mekanistisk sammenhæng, hvordan hver medicin kan angribe kræftcellen fra en anden vinkel. For eksempel er kræftstamceller en særlig elastisk type kræftcelle, og hver medicin retter sig mod disse celler på en anden måde: metformin retter sig mod cellens ‘batterier’ (kaldetmitokondrier) ved at gøre det meget vanskeligt for mitokondrier at køre de molekylære reaktioner, de har brug for for at producere energi., 2019), statinerkan ændre kræftstamcellegenekspression, hvilket gør cellerne merefølsomme over for andre kræftbehandlinger (Kodach et al., 2011) kan afbryde adskillige molekylære processer involveret i celledivision for at hjælpe med at blokere kræftstamcellevækst (Hothi et al., 2012; Hou et al., 2015).
Ved at kombinere alle fire agenter sammen kan COC-protokollen ramme kræftstamceller (og andrekræftceller) på tværs af flere ‘svage pletter’, og som en en-to punch, dette efterlader cellerne mindre i stand til at undvige og komme sig.
Labundersøgelser begynder at fremhæve effektiviteten af denne tilgang ved hjælp af COCprotocol medicin kombinationer. I en mekanistisk undersøgelse reducerede kombinationen af statin og metformin kraftigt væksten af prostatacancerceller mere endenten middel alene., 2017). Observationsundersøgelser har også rapporteret potentielt ‘synergistiske’ virkninger af disse lægemidler mod forskellige kræftformer (Babcook etal., 2014; Jørgen et al., 2015; Lehman et al., 2012; Nimako et al., 2017). Et klinisk forsøg, der undersøger metformin og doksycyclin i brystkræft, er nu undergang (NCT02874430), og vores eget forskningsprogram, METRICS, begynder nu også at producere lovende data.
en langvarig supplerende terapi
TheCOC-protokollen er primært designet til at være en langsigtet ‘supplerende’ terapi, der hjælper med at optimere standardbehandlinger. Da metabolisk behandling med COCProtocol imidlertid er beregnet til at køre på lang sigt, kan patienter også tage protokollen som envedligeholdelsesregime efter standardbehandling er afsluttet eller i pauserfra standardbehandling og som en del af en langsigtet strategi for at afbøde risikoen for gentagelse eller metastaser. Af denne grund er det også værd at bemærke dethver af COC-protokollen medicin har også rapporteret gavnlige mekanismer forhandling i kræft, som ikke er afhængige af samtidig administration af standardterapier, og som uafhængigt kan bidrage til at reducere risikoen for tilbagefald ogmetastatisk spredning.
Care Oncology model
aktiv medicinsk overvågning af hver patient
selvom COCProtocol medicin er blevet brugt sikkert i den generelle befolkning for mangeår er hver patient, der kommer til os, unik. Dette er grunden til, at enhver patient, der deltager i Care Oncology Clinic, placeres under direkte pleje af klinikere med specialviden om at ordinere COC-protokollens medicin ikontekst af kræft. Vores klinikere vurderer individuelt de potentielle fordele og risici, der er forbundet med at tage COC-protokollen med hver patient. De vil kun anbefale COC-protokollen til patienter, når de mener, at det vil være sikkert og gavnligt at gøre det. Hver COC-Protokolrecept er skræddersyet til patientens behov, og doser og regimer gennemgås nøje og justeres baseret på, hvordan patienten skrider frem.
det er derfor vigtigt, at patienter kun tager COC-protokollen, mens de overvåges nøje på vores klinik i hele behandlingsvarigheden.
*********************************************************************************
Vigtig meddelelse
formålet med denne artikel
Denne artikel er en oversigt over nogle af de videnskabelige og medicinske offentliggjortlitteratur vedrørende medicin, der omfatter den patenterede pleje Onkologiprotokol. Der er sørget for at udvælge relevante artikler, der understøtter off-label brug af disse lægemidler i kliniske omgivelser til supplerende behandling af kræft. Denne artikel foregiver ikke at være en omfattende gennemgang af alle beviser, og den fanger heller ikke alle de potentielle bivirkninger af en sådan behandling.
Denne artikel er kun til orientering, og den udgør ikke medicaladvice. De lægemidler, der diskuteres heri, er kun receptpligtige og bør ikke tages uden konsultation med din læge eller anden professionel sundhedsudbyder. Care Oncology læger vil diskutere egnetheden af disse lægemidler med dig og vil kontakte din læge eller onkolog for at drøfte deres egnethed for dig.
duskal ikke stole på oplysningerne i denne artikel som et alternativ til medicinskråd fra din læge eller anden professionel sundhedsudbyder. Hvis du har nogen specifikke spørgsmål om ethvert medicinsk spørgsmål, bør du konsultere din lægeeller anden professionel sundhedsudbyder. Hvis du tror, du kan lidefra enhver medicinsk tilstand, skal du straks søge lægehjælp. Du bør aldrig forsinke at søge lægehjælp, se bort fra lægehjælp, ellerfortsæt medicinsk behandling på grund af oplysningerne i denne artikel.
Copyright
ophavsretten til denne artikel ejes af Health Clinics LLC og dets licensgivere.
Patent
Care Oncology(“COC”) protokollen er beskyttet af United States patent US9622982B2 og afforskellige yderligere internationale patenter.
*********************************************************************************
Agraval, S., Vamadevan, P., Masibuko, N., Bannister, R., R., R., S., Andes, S. (2019). En ny metode til etisk og effektiv Evidensgenerering til brug af Off-Label medicin i onkologi (en casestudie i glioblastom). Front.Pharmacol. 10.Ahern, T. P., Lash, T. L., Damkier, P., Christiansen,P.M. og Cronin-Fenton, D. P. (2014). Statiner og brystkræft prognose: beviser og muligheder. Lancet Oncol. 15, e461-468.
Aksoy, S., Sendur, M. A. N. og Altundag, K. (2013).Demografiske og klinisk-patologiske egenskaber hos patienter med invasivbrystkræft, der modtager metformin. Middelhavs. Oncol. Lond. Engl. 30, 590.Alarcon Martins, T., Seybek, N. D., og M. K. L., S. (2018). Evaluering af de cytotoksiske og Autofagiske virkninger af Atorvastatin påmcf-7 brystkræftceller. Vægre. Middelhavs. J. 35, 256-262.Alimova, I. N., Liu, B., Fan, Edgerton, S. M., Dillon, T., Lind, S. E. og Thor, A. D. (2009). Metformin hæmmer brystkræftcellevækst, kolonidannelse og inducerer cellecyklusstop in vitro. Cellecykel 8, 909-915.S., Siegel, P.M. og St-Pierre, J.(2018). Metaboliske profiler forbundet med metformins effekt ved Cancer. Front.Endocrinol. 9.
Babcook, M. A., Shukla, S., Fu, P., M. A.,Molter, J. P., Oak, C. A., MacLennan, G. T., Flask,C. A., Lindner, D. J., et al. (2014). Synergistisk Simvastatin og Metformin Kombinationkemoterapi til osseøs metastatisk Kastreringsresistent prostatacancer. Mol.Kræft Ther. 13, 2288–2302.
Bahrami, F., Morris, D. L. og Pourgholami, M. H.(2012). Tetracycliner: lægemidler med stort terapeutisk potentiale. Mini Rev. Med.Chem. 12, 44–52.
Bao, B., A. S., Ali, S., S., F., Og Sarkar, F. H. (2014). Metformin kan fungere som anticancermiddel via målrettet kræftstemceller: den potentielle biologiske betydning af tumorassocierede miRNA ‘ er i bryst-og bugspytkirtelkræft. Ann. Transl. Middelhavs. 2.Bjarnadottir, O. Bendahl, P.-O.,Jirstrr larm, K., Ryd Larn, L., Loman, N., Uhl Larn, M., Johannesson, H., Rose, C., Grabau, D., etal. (2013). Målretning mod HMG-CoA-reduktase med statiner i et vindue-of-opportunitybrystkræft forsøg. Brystkræft Res. Behandle. 138, 499–508.(2015), J. P., Bendahl, P.-O., Grabau, D., Hedenfalk,I., S. (2015). Globale transkriptionelle ændringer efter statinbehandling i brystcancer. Clin. Kræft Res. Off. J. Am. Assoc. Kræft Res. 21, 3402-3411.
Bonanni, B., Puntoni, M. P., Gennari, A., Trabacca, M. S.,Galimberti, V., Veronesi, P., Et Al. (2012). Dobbelt effekt af metformin på brystkræftproliferation i et randomiseret prækirurgisk forsøg. J. Clin. Oncol. Ved. J. Am.Soc. Clin. Oncol. 30, 2593–2600.Bradford, S. A. og Khan, A. (2013). Individualiseringkemoterapi ved hjælp af det antidiabetiske lægemiddel, Metformin, som en Kurraadjuvant Kurra: Aneksporterende undersøgelse. J. Kræft Sci. Ther. 5.det er et af de mest populære områder i verden, der findes i verden., et al.(2013). Statin brug i primær inflammatorisk brystkræft: en kohortestudie. Br.J. Kræft 109, 318-324.
Camacho, L., Dasgupta, A. og Jiralerspong, S. (2015). Metformin i brystkræft-et udviklende mysterium. Brystkræft Res. BCR 17, 88.det er en af de mest populære og mest populære måder at gøre det på. (2006). Forebyggelse af brystkræft vækst af statiner. Kræft Res. 66,8707-8714.C., C., Pruneri, G., Puntoni,M., Bottiglieri, L., Varricchio, C., Guerrieri-Gonsaga, A., Gentilini, O. D., Pagani, G., Dell ‘ Orto, P., et al. (2013). Virkningen af metformin på apoptosei et prækirurgisk forsøg med brystkræft. Br. J. Kræft 109, 2792-2797.Chae, Y. K., Valsecchi, M. E., Kim, J., Bianchi, A. L., D., Desai, A. og Tester (2011). Reduceret risiko for Brystkræftforekomst hos patienter, der bruger ACE-hæmmere, ARB ‘ er og/eller statiner. CancerInvest. 29, 585–593.
Chae, Y. K., Yousaf, M., Malecek, M.-K., Carneiro,B., Chandra, S., Kaplan, J., Kalyan, A., Sassano, A., Platanias, L. C. og Giles,F. (2015). Statiner som anti-cancer terapi; Kan vi oversætte prækliniske ogepidemiologiske data til klinisk fordel? Discov. Middelhavs. 20, 413–427.
Chae, Y. K., Arya, A., Malecek, M.-K., Shin,D. S., Carneiro, B., Chandra, S., Kaplan, J., Kalyan, A., Altman, J. K., Platanias,L., et al. (2016). Repurposing metformin til kræftbehandling: nuværende kliniskeundersøgelser. Oncotarget 7, 40767-40780.
Chen, J., Lan, T., Hou, J., Hang, J., An, Y.,Tie, L., Pan, Y., Liu, J. og Li, H. (2012). Atorvastatin sensibiliserer humannon-småcellet lungecarcinomer over for carboplatin via undertrykkelse af AKT-aktiveringog opregulering af TIMP-1. Int. J. Biochem. Celle Biol. 44, 759–769.Chen, L., Chubak, J., Boudreau, D. M., Chen, N. S. og Li,C. I. (2017). Diabetesbehandlinger og risici for negative Brystkræftresultater blandt brystkræftpatienter i det tidlige stadium: en SEER-Medicareanalyse. Kræft Res. 77, 6033-6041.Chen, T., Liang, Y., Feng, D., Tao, L., K.,Chang, H., Vang, H., Lin, K. Og Kong, H. (2013). Metformin hæmmer proliferationog fremmer apoptose af HER2-positive brystkræftceller ved nedreguleringsp90. J. BUON slukket. J. Balk. Union Oncol. 18, 51–56.
Coyne, C., Jones, T. og Bear, R. (2014).Anti-neoplastisk cytotoksicitet af gemcitabin-(C4 – amid)-inDual-kombination med Epirubicin-(C3 – amid)-modkemoterapeutisk resistent Brystadenocarcinom (SKBr-3) ogkomplementær virkning af mebendasol. J. Kræft Res. Ther. Oncol. 2.
Coyne, C. P., Jones, T. og Bear, R. (2012). Påvirkningaf Alternative Tubulininhibitorer på styrken af aEpirubicin-Immunokemoterapeutisk syntetiseret med et Ultra VioletLight-aktiveret mellemprodukt. Kræft Clin. Oncol. 1, 49–80.
Coyne, C. P., Jones, T. og Bear, R. (2013).Gemcitabine-(C4-amide)- Anti-Neoplastic Cytotoxicity in DualCombination with Mebendazole against Chemotherapeutic-Resistant MammaryAdenocarcinoma. J. Clin. Exp. Oncol. 2.
Cufi, S., Corominas-Faja, B., Vazquez-Martin, A.,Oliveras-Ferraros, C., Dorca, J., Bosch-Barrera, J., Martin-Castillo, B., andMenendez, J.A. (2012). Metformin-induced preferential killing of breast cancerinitiating CD44+CD24-/low cells is sufficient to overcome primary resistance totrastuzumab in HER2+ human breast cancer xenografts. Oncotarget 3, 395–398.
Danzig, M.R., Kotamarti, S., Ghandour, R.A. B. P., Benson, M. C., Badani, K. K. og McKiernan, J. M. (2015).Synergisme mellem metformin og statiner ved ændring af risikoen for biokemiskrekurren efter radikal prostatektomi hos mænd med diabetes. Prostatacancer Prostata Dis. 18, 63–68.Harkness, T., T. (2017). Metformin hæmmer udviklingen og fremmer resensibilisering afbehandlingsresistent brystkræft. PLoS en 12.Hanson, D., Al Dimassi, S., Atlas, M., Boockvar, J., Ruggieri, R. og Symons, M. (2017). Som erstatning for vincristin tilbehandling af hjernetumorer. Mol. Middelhavs. 23, 50–56.det er en af de mest almindelige måder at gøre det på, er ved at blive brugt til at gøre det. (2014). Differentielle virkninger af metforminon brystkræftproliferation ifølge markører for insulinresistens ogtumorundertype i et randomiseret prækirurgisk forsøg. Brystkræft Res. Behandle. 148,81–90.
DeCensi, A., Puntoni, M., Guerrieri-Gonsaga, A.Viale, G., Et Al. (2015). Effekt af Metformin på Brystkanalcarcinoma In Situ Proliferation i et randomiseret Prækirurgisk forsøg. Kræft Prev.Res. Phila. Pa 8, 888-894.(2012), Deng, Deng,Deng, A., Liu, B., Edgerton, S. M., Lind, S. E., R. og Thor, A. D. (2012). Metformin targetsStat3 for at hæmme cellevækst og inducere apoptose hos triple-negative brystkræftmænd. Celle Cyklus Georget. Tekst 11, 367-376.L. A., L. E., Virk, S., Ennis, M., Mao, F., Ligibel, J. A., Hershman,D. L., Rastogi, P., et al. (2018). CA15-3 / MUC1 i CCTG MA-32 (NCT01101438): en phaseIII RCT af effekten af metformin vs. placebo på invasiv sygdomsfri ogsamlet overlevelse i tidlig fase brystkræft (BC). J. Clin. Oncol.duivenvoorden, Popovi, S. V., Lhot, S., Seidlits, E., Hirte, H. V., R. G. og Singh, G. (2002). I en knoglemetastase model af human brystkræft. Kræft Res. 62,1588-1591.el-Sheredy, S. A. og El-Sheredy, H. G. (2014).Metformin og overlevelse hos diabetespatienter med brystkræft. J. Egypten.Folkesundhedsassoc. 89, 148–153.
Feldt, M., Bjarnadottir, O., Kimbung, S.,Jirstrr, K., Bendahl, P.-O., Veerla, S., Grabau, D., Hedenfalk, I. og Borgkvist, S.(2015). Statin-inducerede anti-proliferative virkninger via cyclin D1 og p27 i et vindue-of-opportunity brystkræftforsøg. J. Transl. Middelhavs. 13, 133.Fife, R. S. og Sledge (1995). Virkninger af doksycyclin på In vitro vækst, migration og gelatinase aktivitet af brystcarcinomceller. J. Lab. Clin. Middelhavs. 125, 407–411.Fife, R. S., og Sledge, G. H. (1998). Virkninger af oksycyclin på cancerceller in vitro og in vivo. Adv. Dent. Res. 12, 94-96.
Fiorillo, M., T Pristh, F., Sotgia, F. og Lisanti, M. P.(2019). C-vitamin (DAV) : en potent kombinationsterapi til målretning af mitokondrier og udryddelse af kræftstamceller (CSC ‘ er).Aldring 11, 2202-2216.
Foroodi, F., Duivenvoorden, C. C. og Singh, G.(2009). Interaktioner af doksycyclin med kemoterapeutiske midler i humanbryst adenocarcinom MDA-MB-231 celler. Anticancer. Stoffer 20, 115-122.E. R., Kumar, A. S., Baehner, F. L. H. C., H. C., C. I., Garber, J., Lesnikoski, B.-A., yang,E. S., Et Al. (2010). Fluvastatin reducerer proliferation og stigningerapoptose hos kvinder med høj gradbrystkræft. Brystkræft Res. Behandle. 119, 137–144.
Giles, E. D., Jindal, S., Wellberg, E. A., Schedin, T.,Andersen, S. M., Thor, A. D., Edwards, D. P., MacLean, P. S., og Schedin, P.(2018). Metformin hæmmer ekspression af stromal aromatase og tumorprogressioni en gnavermodel af postmenopausal brystkræft. Brystkræft Res. BCR 20.P. J., Parulekar, L. R., Gelmon, K. A., Shepherd, L. E., Ligibel, J. A., Hershman, D. L., Rastogi, P., Mayer,I. A., Hobday, T. J., Et Al. (2015). Effekt af metformin vs placebo på ogmetaboliske faktorer i NCIC CTG MA.32. J. Natl. Kræft Ist. 107.Hadad, S., Jordan, L., Purdie, C., Bray, S., Baker, L., Jellema, G., Deharo, S., Hardie, D. G., Pusstai, L., et al.(2011). Bevis for biologiske virkninger af metformin i operabel brystkræft:et præoperativt, vindue-af-mulighed, randomiseret forsøg. Brystkræft Res. Behandle. 128, 783–794.Hadad, S. M., Hardie, D. G., Appleyard, V., andThompson, A. M. (2014). Virkninger af metformin på brystkræftcelleproliferation, AMPK-vejen og cellecyklussen. Clin. Transl. Oncol. Ved.Publ. Fodret. Span. Oncol. Soc. Natl. Kræft Ist. Meks. 16, 746–752.
Hatoum, D. og Mcgovan, E. M. (2015). Nylige fremskridtved brug af metformin: kan behandling af diabetes forhindre brystkræft? BioMedRes. Int. 2015, 548436.
Hirsch, H. A., Iliopoulos, D., Tsichlis, P. N., andStruhl, K. (2009). Metformin målretter selektivt kræftstamceller og Virkersammen med kemoterapi for at blokere tumorvækst og forlænge Remission. CancerRes. 69, 7507–7511.
Hothi, P.(2012), J. J., T. J., Chen, L., Deleyrolle,L., Yoon, J.-G., Reynolds, B. High-Throughput ChemicalScreens identificerer Disulfiram som en hæmmer af humane glioblastom stamceller.Oncotarget 3, 1124-1136.hou, J.-J., Luo, J., J., J., P., P., F., cu, B.,S.-J., F.-M., F.-M., J., L.-S., Long, J.-J., Et Al. (2015).FDA-godkendt anthelmintikum, er målrettet mod brystkræftstamlignende celler.Oncotarget 6, 6326-6340.
Iliopoulos, D., Hirsch, H. A. og Struhl, K. (2011).Metformin nedsætter dosis af kemoterapi til forlængelse af tumor remission imuseksenotransplantater, der involverer flere cancercelletyper. Kræft Res. 71,3196-3201.
Jacob, L., Kostev, K., Rathmann, V. og Kalder, M.(2016). Virkningen af metformin på metastaser hos patienter med brystkræft ogtype 2 diabetes. J. Diabetes Komplikationer 30, 1056-1059.
Jagust, P., P., B., Parejo-Alonso, B. og Sancho, P. (2019). Metabolismebaserede Terapeutiske Strategier Rettet Mod Kræftstemceller. Front. Pharmacol. 10.
Jang, M., Kim, S. S. og Lee, J. (2013). Kræftcellemetabolisme: konsekvenser for terapeutiske mål. Eksp. Mol. Middelhavs. 45, e45.jiralerspong, S., Palla, S. L., Giordano, S. H., Meric-Bernstam, F., Liedtke, C., Barnett, C. M., Hsu, L., Hung,M.-C., Hortobagyi, G. N. og Gonsales-Angulo, A. M. (2009). Metformin og Patologiskkomplet respons på neoadjuvant kemoterapi hos diabetespatienter med brystcancer. J. Clin. Oncol. 27, 3297–3302.det er en af de bedste måder at gøre dette på, når du er i stand til at finde ud af, om du er i stand til at finde ud af, om du er i stand til at finde ud af, om du er i stand til at finde ud af, om du er i stand til at finde ud af, om du er i stand til at finde ud af, om du er i stand til at finde ud af, om du er i stand til at finde ud af,om du er i stand til at finde ud af, hvad du har brug for.(2014). Presurgisk forsøg med metformin hos overvægtige og overvægtige patienter medny diagnosticeret brystkræft. Kræft Invest. 32, 150–157.
Kanugula, A. K., Gollavilli, P. N., Vasamsetti,S. B., Karnevar, S., Gopoju, R., Ummanni, R. og Kotamraju, S. (2014). Statin-induceret hæmning af brystkræftproliferation og invasion involverer dæmpning af jerntransport: mellemprodukt af salpetersyre og antioksidant forsvarsmekanismer. FEBS J. 281, 3719-3738.Kim, H. J., Lee, Yu, J. H.,Park, H. S., Sohn, G., Lee, Y., Koh, B. S., Yu, J. H., et al. (2015). Metforminøger overlevelsen i hormonreceptorpositiv, HER2-positiv brystkræftpatienter med diabetes. Brystkræft Res. BCR 17, 64.Kim, E.-K., Kim, M.-K., Paik, N.-S., Jeong, S.-S., Yoon, J.-H., Park, C. H., Ahn, S. H., Kim, L. S., et al. (2014).Fase II randomiseret forsøg med neoadjuvant metformin plus letrosol versus placeboplus letrosol til østrogenreceptorpositiv postmenopausal brystkræft (METEOR). BMC kræft 14, 170.Kodach, L. L., Jacobs, R. J., Voorneveld, P. E., Verspaget, T., Morreau, H., Hommes, D. V., Peppelenbosch, M. P., van Den Brink, G. R., et al. (2011). Statiner forøgerkemosensitivitet af kolorektale cancerceller inducerende epigenetisk omprogrammeringog reduktion af kolorektal cancercelle” stamness ” via knoglemorfogenetiskproteinvej. Gut 60, 1544-1553.J., J., J., J., J., J., J., J., J., J. og Golab, J. (2004).Cerivastatin demonstrerer forbedret antitumoraktivitet mod humane brystkræftcellelinjer, når de anvendes i kombination med doksorubicin eller cisplatin. Int.J. Oncol.
Kroemer, G., og Pouyssegur, J. (2008). Tumorcellemetabolisme: Kræftens akilleshæl. Kræftcelle 13, 472-482.(2008), C. P., C. P., M. L., Habel,L. A., S. A., C. P. og Caan, B. (2008). Post-diagnose statin brug og brystkræftgenoptræden i en prospektiv kohortestudie af tidlige stadium brystkræftoverlevende. Brystkræft Res. Behandle. 109, 573–579.
Lacerda, L., Reddy, J. P., Liu, D., Larson, R., Li,L., Masuda, H., brygger, T., Debeb, B. G., H., Hortob Largyi, G. N., Et Al. (2014).Simvastatin radiosensibiliserer differentierede og stamlignende brystkræftcellelinjer og er forbundet med forbedret lokal kontrol hos inflammatoriske brystkræftpatienter behandlet med postmastektomistråling. Stamceller Transl. Middelhavs.3, 849–856.det er en af de bedste måder at gøre dette på, når du er i stand til at finde ud af, om du er i stand til at finde ud af, om du er i stand til at finde ud af, om du er i stand til at finde ud af, om du er i stand til at finde ud af, om du er i stand til at finde ud af, om du er i stand til at finde ud af,om du er i stand til at finde ud af, om du er i stand til at finde ud af, om du er i stand til at finde ud af, om du er i stand til at finde ud af, om du er i stand til at finde ud af, om du er i stand til at finde ud af, hvad du har brug for. (2015a). Dok-cyclin nedregulerer DNA-Pkog radiosensibiliserer tumorinitierende celler: implikationer for mere effektiveradiationsterapi. Oncotarget 6, 14005-14025.
Lamb, R., Ossvari, B., Lisanti, C. L., M. P. (2015b).Antibiotika, der er målrettet mod mitokondrier, udrydder effektivt kræftstamceller på tværs af flere tumortyper: behandling af kræft som en smitsom sygdom.Oncotarget 6, 4569-4584.Lehman, D. M., Lehman, C., Hernandes, J. og Vang, C.(2012). Statin brug som Moderator af Metformin effekt på risikoen for ProstateCancer blandt Type 2 diabetespatienter. Diabetes Pleje 35, 1002-1007.
Lin, C., Lo, M., Moody, R., Stevers, N., Tinsley,S. og Sun, D. (2018). Aldehyddehydrogenase‑positiv brystkræftstemceller. Oncol. Rep.
Liu, B., Yi, S., Guan, S., S., Y.-S. og Ma, F.(2017). Forholdet mellem statiner og brystkræftprognose varierer efterstatintype og eksponeringstid: en metaanalyse. Brystkræft Res. Behandle. 164,1–11.
Liu, H., Scholt, C., sang, C., Schefe, J. H.,Habbel, P., Regierer, A.-C., C.-O., Possinger, K. og Eucker, J. (2012).Metformin og mTOR-hæmmeren everolimus (RAD001) sensibiliserer brystkræftceller til den cytotoksiske virkning af kemoterapeutiske lægemidler in vitro. AnticancerRes. 32, 1627–1637.Liu, Romero, I. L., Litchfield, L. M., Lengyel, E. og Locasale (2016). Metformin er målrettet mod central kulstofmetabolisme ogafslører mitokondrie krav i humane kræftformer. Cellemetab. 24, 728–739.
Ma, J., Guo, Y., Chen, S., Chong, C., Y., Y.,Y., Y., Lai, Y., Y., Y., Y., Y., J., Et Al. (2014). Metformin enhancestamoksifen-medieret tumorvæksthæmning i er-positivt brystcarcinom. BMCCancer 14, 172.
Manthravadi, S., Shrestha, A. og Madhusudhana, S. (2016). Effekt af statin brug på kræft tilbagefald og dødelighed i brystcancer: en systematisk gennemgang og meta-analyse. Int. J. Kræft 139, 1281-1288.Mark, M., Klingbiel, D., Mey, U., Vinterhalder,R., Rothermundt, C., Gillessen, S., von Moos, R., Pollak, M., Manetsch,G., Strebel, R., et al. (2019). Virkning af tilsætning af Metformin til Abirateron imetastatisk Kastreringsresistent prostatacancerpatienter med sygdomsprogression under behandling med Abirateron (MetAb-Pro): fase 2 pilotundersøgelse. Clin. Genitourin. Kræft 17, e323-e328.Martin-Castillo, B., Pernas, S., Dorca, J. A. S., A. S., A. S., A. S.,A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., et al. (2018). Et fase 2-forsøg med neoadjuvant metformin i kombination med kemoterapi hos kvinder med tidlig HER2-positiv brystkræft: METTEN-undersøgelsen. Oncotarget 9.35687-35704.Mokhtari, R. B., Homayouni, T. S., Baluch,N., Morgatskaya, E., Kumar, S., Das, B. Og Yeger, H. (2017). Kombinationsterapi bekæmpelse af kræft. Oncotarget 8, 38022-38043.M. R., A. O., Seeger, H. og H., D. (2004).Hæmmende virkning af statiner på spredning af human brystkræft cells.Int. J. Clin. Pharmacol. Ther. 42, 695–700.
Mukhopadhyay, T., Sasaki, J., Ramesh, R. og Roth, J. A. (2002). Det fremkalder en Potent Antitumor effekt på humane Cancercelliner både in Vitro og in vivo. Clin. Kræft Res. 8, 2963-2969.
Murtola, T. J., Visvanathan, K., Artama, M.,Vainio, H. og Pukkala, E. (2014). Statinbrug og brystkræftoverlevelse: en landsdækkende kort undersøgelse fra Finland. PloS One 9, e110231.Nanni, O., Amadori, D., De Censi, A., Rocca,A., Freschi, A., Bologna, A., Gianni, L., Rosetti, F., Amaducci, L., Cavanna,L., et al. (2019). Metformin plus kemoterapi versus kemoterapi alene iførstelinjebehandling af HER2-negativ metastatisk brystkræft. Det Mymerandomiserede kliniske fase 2-Forsøg. Brystkræft Res. Behandle. 174, 433–442.(2017).det er en af de bedste måder, hvorpå vi kan hjælpe dig med at finde ud af, hvad der er bedst. Synergistisk fordel ved Statin og Metforminin gastrointestinale maligniteter. J. Pharm. Pract. 30, 185–194.Niraula, R. J. O., Ennis, M., Chang, M. C.,Done, S. J., Hood, N., Escallon, J., Leong, V. L., McCready, D. R., Reedijk,M., et al. (2012). Metformin i tidlig brystkræft: et potentielt vindue afopportunity neoadjuvant undersøgelse. Brystkræft Res. Behandle. 135, 821–830.
Nygren, P. og Larsson, R. (2014). Omplacering af lægemidler fra bænk til seng: tumor remission af det antihelmintiske lægemiddel mebendasolein refraktær metastatisk tyktarmskræft. Acta Oncol. 53, 427–428.
Orecchioni, S., Reggiani, F., Talarico, G., Mancuso,P., Calleri, A., Gregato, G., Labanca, V., Noonan, D. M., Dallaglio, K., Albini,A., et al. (2015). Biguaniderne metformin og phenformin inhibitangiogenese, lokal og metastatisk vækst af brystkræft ved at målrette mod bothneoplastiske og mikromiljøceller. Int. J. Kræft 136, E534-544.B., Sotgia, F. og Lisanti, M. P. (2017). Ny mutationsuafhængig tilgang til kræftbehandling: inhibering af onkogen RAS ogmyc ved at målrette mitokondriel biogenese. Aldring 9, 2098-2116.P., Bouche, G., Meheus, L., Sukhatme, V. og Sukhatme, V. P. (2014). Repurposing medicin i onkologi (ReDO)—mebendasol asan anti-cancer agent. Ecancermedicalscience 8.
Peiris-Pag Kriss, M., Sotgia, F. og Lisanti, M. P.(2015). Terapeutisk målretning af DNA-skadesresponset icancerceller: gammelt lægemiddel, nyt formål. Oncoscience 2, 696-699.Rahmani, J., Mansari, N., Thompson, J., Gudi,S. K., Chhabra, M., Naik, G., Mousavi, S. M., Varkaneh, H. K., Clark, C. og Jang, Y.(2019). Effekten af metformin på biomarkører forbundet med brystkræftresultater: en systematisk gennemgang, metaanalyse og dosisrespons af randomiseredekliniske forsøg. Clin. Transl. Oncol.
Scatena, C., Roncella, M., Di Paolo, A., Aretini, P., Menicagli, M. C. M., Ghilli, M., Sotgia, F., et al. (2018). En hæmmer af mitokondriel Biogenese reducerer effektivt kræftstamceller (CSC’ er) hos tidlige brystkræftpatienter: Aklinisk pilotundersøgelse. Front. Oncol. 8.
Seeger, H., D. og Mueck, A. O. (2003).Statiner kan hæmme proliferation af humane brystkræftceller in vitro. Eksp.Clin. Endocrinol. Diabetes Slukket. J. Ger. Soc. Endocrinol. Ger. Diabetes Assoc.111, 47–48.
Skoda, J., Borankova, K., Jansson, P. J.,Huang, M. L.-H., Veselska, R. og Richardson, D. R. (2019). Farmakologisk målretningaf mitokondrier i kræftstamceller: en gammel organel ved krydset Afroman anti-cancer terapier. Pharmacol. Res. 139, 298-313.Sonnenblick, A., Agbor-Tarh, D., Bradbury, I., DiCosimo, S., aim, H. A., Fumagalli, D., Sarp, S., Ulff, A. C.,Andersson, M., Kroep, J., et al. (2017). Virkning af Diabetes, Insulin og Metformin brug påudkomsten af patienter med Human Epidermal vækstfaktorreceptor 2–Positivprimær brystkræft: analyse fra Altto fase III randomiseret forsøg. J. Clin. Oncol. 35, 1421–1429.R. D., Rahal, O. M.( 2017). Effekt af statiner på tilbagefald og dødelighed af brystkræft: en gennemgang.Brystkræft Mål Ther. 9, 559–565.(2011), C., C., C.,C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C., C.Det antidiabetiske lægemiddel metformin undertrykker den metastaseassocierede proteinCD24 i MDA-MB-468 triple-negative brystkræftceller. Oncol. Rep. 25.135–140.
Vintonenko, N., Jais, J.-P., Kassis, N.,Abdelkarim, M., Perret, G.-Y., Lecouvey, M., Crepin, M. Og Di Benedetto, M. (2012).Transkriptomanalyse og in vivo-aktivitet af fluvastatin i en Murin metastasemodel for brystkræft. Mol. Pharmacol. 82, 521–528.(2014), J. K.,Edgerton, S. M., Anderson, S. M., Thor, A. D. og Richer, J. K.(2014). Metformin-induceret drab af triple-negative brystkræftceller ermedieret ved reduktion i fedtsyresyntase via miRNA-193b. Horm. Kræft 5.374–389.et al.det er en af de mest populære og mest populære måder at gøre det på. (2017).Mekanistisk undersøgelse af hæmmende virkninger af Metformin og atorvastatin inkombination på prostatacancerceller in Vitro og in vivo. Biol. Pharm. Bull.40, 1247–1254.L., Larson,R., Bambhroliya, A., Huang, Bertucci, F., Finetti, P., Birnbaum, D., Van Laere,S., et al. (2015). Simvastatin forhindrer triple-negativ brystkræftmetastase i prækliniske modeller gennem regulering af Ræv3a. Brystkræftres. Behandle. 154, 495–508.(2015) (engelsk), engelsk (engelsk). Metformin brug er forbundet med Bedreoverlevelse af brystkræftpatienter med Diabetes: en metaanalyse. TheOncologist 20, 1236-1244.
Yam, C., Esteva, F. J., Patel, M. M., Raghavendra,A. S., Ueno, N. T., Moulder, S. L., Hess, K. R., Shroff, G. S., Hodge, S., Koenig,K. H., et al. (2019). Effekt og sikkerhed af kombinationen af metformin, everolimusog eksemestan hos overvægtige og overvægtige postmenopausale patienter med metastatisk,hormonreceptorpositiv, HER2-negativ brystkræft: en fase II-undersøgelse.Investere. Nye Lægemidler 37, 345-351.
Yao, H., Han, G., Yan, S., Chen, C., sang, L., Rosol, T.J. og Deng (2017). Triple-negativ brystkræft: er der en behandlingi horisonten? Oncotarget 8, 1913-1924.L., Guo, M., Li, J., J., J., J., S.,S., T. og Liu, B. (2015). Systembiologibaseret opdagelse af en potentiel Atg4Bagonist (Flubendasol), der inducerer autofagi i brystkræft. Mol. Biosyst.11, 2860–2866.
Jang, L., Ju, L., Jang, F. og Vlashi, E. (2017).Doksycyclin hæmmer kræftstamcellefænotypen ogepithelial-til-mesenkymal overgang i brystkræft. Celle Cyklus Georget. Tekst 16, 737-745.L., Bochkur Dratver, M. T., Dong,K., Nguyen, A., Yu, G., Dao, A., Bochkur Dratver, M., Duhachek-Muggy, S., Bhat,K., Et Al. (2019a). I Triple-Negativbrystkræft. Int. J. Radiat. Oncol. Biol. Phys. 103, 195–207.(2014), S. A., S. A., S. G., S. G., S. G.,S. G., S. A., S. G., S. A., S. G., S. G., S. G., S. G., S. G., S. G., S. A., S. G., S. G., S. G., S. G. Involvering af metformin og AMPK i radioresponsen og prognosen for luminal versusbasal-lignende brystkræft behandlet med strålebehandling. Oncotarget 5, 12936-12949.J., J., J., Bi, Y., Vang, C., og Liu, Y.(2019b). Effekten af metformin på biomarkører og overlevende for brystkræft-en systematisk gennemgang og metaanalyse af randomiserede kliniske forsøg. Pharmacol.Res. 141, 551-555.(2015). (engelsk). Statinbrug og dødelighed hos kræftpatienter: systematisk gennemgang og meta-analyse af observationsstudier. Kræft Behandle. Åb 41, 554-567.
