Das COC-Protokoll ™ bei Brustkrebs
Dieses Dokument ist eine Zusammenfassung der Gründe und einiger der aktuellen wissenschaftlichen Erkenntnisse, die die Verwendung der COC-Protokollmedikamente neben Standardbehandlungen für Brustkrebs unterstützen. Wir verstehen, dass Krebs eine sehr persönliche Erkrankung ist, und jeder Patient hat eine einzigartige Reihe von Herausforderungen. Für weitere Informationen zu Ihrer persönlichen Situation wenden Sie sich bitte an die Care Oncology Clinic unter 800-392-1353 in den USA oder besuchen Sie die Website unter https://careoncology.com.
Wenn Sie neu in der Pflege sind, beachten Sie bitte Folgendes:
- Sie müssen nicht reisen. Sie können mit unserem Team von Onkologen und Onkologie Krankenschwestern durch sichere Video für die laufende Unterstützung gerecht zu werden.
- Die Care Oncology Adjunct Protocol-Medikamente werden von unseren US-Partnerapotheken direkt zu Ihnen nach Hause geliefert und können neben Ihrer Standardbehandlung verwendet werden.
- Wir sind unglaublich stolz, Ihnen mitteilen zu können, dass wir den äußerst strengen Validierungsprozess des Validation Institute für Datenanalyse, Ergebnisansprüche und Wertberechnung bestanden haben. Wir haben hart gearbeitet, um an diesen Punkt zu gelangen. Schon früh erkannten wir den enormen Wert, den ein verantwortungsvoll durchgeführtes Programm von umgewidmeten Medikamenten Krebspatienten bot, aber es wurde nicht in großem Umfang angeboten. Vor vier Jahren wollten wir das ändern, weil wir wussten, dass es ein Marathon war, kein Sprint.
Das COC-Protokoll und Brustkrebs: Schlüsselpunkte
- Das COC-Protokoll ist eine Kombination aus vier häufig verschriebenen Medikamenten (“ b. Atorvastatin, Metformin, Mebendazol und Doxycyclin) mit dem Potenzial, Brustkrebs zu bekämpfen und die Wirksamkeit von Standard-Krebstherapien zu verbessern.
- Eine Reihe von Beobachtungsstudien haben die Verwendung von Metformin oder Statin mit verbesserten Ergebnissen bei Brustkrebspatientinnen in Verbindung gebracht.
- Laborstudien an Brustkrebszellen, die in Schalen gezüchtet wurden, zeigen, dass Metformin und Statine Brustkrebszellen direkt angreifen und schädigen können – sie schwächen und sie anfälliger für Standardbehandlungen machen.
- Ergebnisse aus kleinen ‚Fenster der Gelegenheit‘ klinische Studien bei Patienten mit operablem Brustkrebs zeigen im Allgemeinen, dass die Einnahme von Metformin oder Statin vor der Operation zu potenziell positiven Veränderungen der molekularen Marker von Krebs führen kann, einschließlich derjenigen, die das Wachstum und die Teilung von Brustkrebszellen regulieren. Weitere Studien, die untersuchen, ob Metformin oder Statine die Krankheitsreaktion beeinflussen können, sind im Gange.
- Doxycyclin Kann das Wachstum von HER2-positiven und triple-negativen Brustkrebs-Stammzellen blockieren, die in Schalen im Labor inkubiert wurden, und dazu beitragen, resistenzbedingte Veränderungen zu verbessern, die durch die Standardchemotherapie Paclitaxel induziert werden.
- Doxycyclinhat gerade frühe klinische Studien bei Brustkrebspatientinnen erreicht. Die Ergebnisse der ersten kleinen Studie zeigen, dass Patientinnen mit Brustkrebs im Frühstadium, die Doxycyclin nur 14 Tage vor der Operation einnahmen, die molekularen Marker für das Vorhandensein von Krebsstammzellen um durchschnittlich etwa 40% reduzierten. Positive Effekte wurden für alle bis auf einen der behandelten Patienten festgestellt(8/9).
- Mebendazolekann das Wachstum und die Teilung von im Labor gezüchteten Brustkrebszellen verlangsamen, einschließlich Brustkrebszellen, die resistenter gegen Chemotherapie sind. Mehrmenschliche Studien sind erforderlich.
Das COC-Protokoll und Brustkrebs: Veröffentlichte Evidenz
Das COC-Protokoll ist ein Kombinationsregime von vier häufig verschriebenen Medikamenten, die jeweils Hinweise auf metabolisch basierte Antikrebsaktivität und gut verstandene Sicherheitsprofile enthalten. Diese Medikamente sind: Metformin, Atorvastatin,Doxycyclin und Mebendazol. Einige der Studien, die die Verwendung des COC-Protokolls als Zusatztherapie neben den derzeitigen Standardbehandlungen für Brustkrebs unterstützen, sind nachstehend aufgeführt. Diese Evidenz stammt hauptsächlich aus Laborstudien, großen epidemiologischen Studien (die Zusammenhänge zwischen der Einnahme von Medikamenten und Brustkrebsergebnissen in Gruppen von Einzelpersonen untersuchen) und klinischen Studien im Frühstadium.
Sie werden feststellen, dass sich viele der folgenden Studien nur auf einzelne COC-Protokollmedikamente konzentrieren. Wir sind die ersten, die eine Zusatztherapie entwickeln, die Allfour kombiniert. Wir glauben, dass die Kombination dieser Medikamente die Größtenergebnisse erzielen wird, und unser eigenes Forschungsprogramm, genannt METRIKEN, produziert bereits mehr der Beweise, die benötigt werden, um dies zu zeigen. Sie können mehr darüber lesen, warum wir glauben, dass diese Medikamente so gut zusammenarbeiten, um Krebs zu bekämpfen, und über theMETRICS Programm selbst, in weiteren Abschnitten unten.
Metformin und Brustkrebs
Metformin ist mit potenziellen Vorteilen für Brustkrebs verbunden
Viele Beobachtungsstudien belegen nun die Verwendung von Metformin inbrustkrebs. Metformin ist zur Behandlung von Typ-2-Diabetes zugelassen, und Beobachtungsstudien an Gruppen von Patienten mit Diabetes zeigen tendenziell, dass diejenigen, die Metformin einnehmen, bessere Chancen auf ein verbessertes Ergebnis haben, wenn sie an Brustkrebs erkranken (Aksoy et al., 2013;El-Benhawy und El-Sheredy, 2014; Sonnenschein et al., 2017).Die Anwendung von Metformin wurde mit einem verbesserten Überleben bei Patientinnen mit Brustkrebs in Verbindung gebracht (Kim et al., 2015; Xuet al., 2015), verbessertes Ansprechen auf die Brustkrebsbehandlung (Jiralerspong et al., 2009) und eine geringere Wahrscheinlichkeit, dass sich Brustkrebs ausbreitet und zurückfällt (Chen et al., 2017;Jacob et al., 2016). Es ist wahrscheinlich, dass ein Teil der positiven Wirkung von Metformin, die in diesen Studien gefunden wurde, auf die Fähigkeit von Metformin zurückzuführen ist, den Diabetes und / oder das Gewicht einer Patientin zu verbessern, indem der Glukosespiegel reduziert wird, was dazu beitragen kann, das Risiko der Entwicklung von Brustkrebs zu verringern und die Gesundheit und Fähigkeit einer Patientin zu verbessern, Brustkrebs zu bekämpfen, wenn sie es haben (Hatoum und McGowan, 2015). Aber Laborstudien zeigen auch, dass Metformin istmacht mehr als das. Tatsächlich kann Metformin aktiv direkt gegen Brustkrebszellen wirken, ihre Fähigkeit, Energie aufzunehmen und zu nutzen, verringern und ihre Fähigkeit, zu wachsen, sich auszubreiten, zu überleben und einen Rückfall zu erleiden, blockieren (Alimova et al., 2009;Hadad et al., 2014; Orecchioni et al., 2015).
Verschiedene Arten von Brustkrebs erfordern unterschiedliche Behandlungen. Trastuzumab wird beispielsweise speziell zur Behandlung von humanem epidermalem Wachstumsfaktor-Rezeptor-2 (HER2) -positivem Brustkrebs eingesetzt. Tamoxifen ist wirksam gegen Östrogenrezeptor (ER) positiven Brustkrebs. Wichtig ist, dass Krebszellstudien im Labor zeigen, dass Metformin eine Antikrebsaktivität gegen viele verschiedene Brustkrebszelltypen aufweist, einschließlich ER-positiv (Giles et al., 2018),HER2 positiv (Chen et al., 2013) und potenziell schwieriger zu behandelnde Subtypen wie dreifach negative Krebszellen (Deng et al., 2012;Vazquez-Martin et al., 2011; Wahdan-Alaswad et al., 2014).Dies bedeutet, dass Metformin das Potenzial hat, effektiv neben Standardbehandlungen für Brustkrebs zu arbeiten, unabhängig vom Krebs-Subtyp.
Metforminzielt Brustkrebsstammzellen
Es wurde auch gezeigt, dass Metformin auf Brustkrebsstammzellen abzielt (Bao et al., 2014; Cuf et al., 2012; Hirsch et al., 2009).Diese Aktivität gegen Brustkrebsstammzellen, zusammen mit ihrer Fähigkeit, verschiedene Subtypen von Brustkrebs anzusprechen, helfen zu erklären, warum Laborstudien zeigen, wie es in Kombination mit einer Reihe von Standardbehandlungen, Einschließlichtrastuzumab (Cufi et al., 2012),Tamoxifen (Ma et al., 2014) undstandard-Chemotherapeutika (Iliopoulos et al.,2011). Tier- und Zellstudien zeigen, dass Metformin beidhilft, die Wirksamkeit von Standardbehandlungen zu verbessern (Bradford und Khan, 2013; Liu et al., 2012; Zhang et al., 2014) und verzögert auch den Rückfall von Krebserkrankungen, die mit diesen Therapien behandelt wurden (Iliopoulos et al.,2011).
Darüber hinaus zeigen Laborstudien, dass Metformin auch dazu beitragen kann, zu verhindern, dass Brustkrebszellen gegen Chemotherapie resistent werden, und die Empfindlichkeit bereits resistenter Krebszellen gegenüber der Behandlung zu verbessern (Davies et al., 2017).
Metforminimproves markers of breast cancer in early clinical studies
Als Ergebnis der großen Menge an unterstützenden Daten für Metformin bei Brustkrebs, die durch Beobachtungs- und Laborstudien generiert wurden, laufen derzeit verschiedene klinische Studien zur Untersuchung von Metformin bei Brustkrebs (Camacho et al., 2015).Insgesamt deuten kollektive Analysen der Ergebnisse dieser Studien im Frühstadium(Metaanalyse) auf einen allgemein positiven Effekt hin, wenn Metformin zu Standardkrebstherapien hinzugefügt wird (Rahmani etal., 2019; Zhang et al., 2019b).
Eine Reihe von ‚Fenster der Gelegenheit‘ -Studien untersuchen, ob die Einnahme von Metformin für etwa zwei Wochen vor der Operation dazu beitragen kann, die molekularen Marker der Krankheit bei Patienten mit operierbarem Brustkrebs im Frühstadium zu verbessern. Die Ergebnisse dieser Studien legen im Allgemeinen nahe, dass die Einnahme von Metformin zu potenziell positiven Veränderungen molekularer Marker für Krebs führen kann, einschließlich solcher, die das Wachstum und die Teilung von Brustkrebszellen regulieren (Bonanni et al., 2012;Cazzaniga et al., 2013; Hadad et al., 2011; Kalinsky et al., 2014; Niraula etal., 2012), sowie möglicherweise die Regulierung vonHormone und andere Faktoren für einige Patienten (Kalinsky et al., 2014;Niraula et al., 2012). Diese Studien helfen Wissenschaftlern nun, genau zu verstehen, wie und wann Metformin Patienten mit Brustkrebs helfen kann (Bonanni etal., 2012; DeCensi et al., 2014, 2015; Rahmani et al., 2019).
Phase 2 ’neoadjuvante‘ Studien sind im Allgemeinen längere und komplexere Studien, in denen Metformin neben Standardbehandlungen zur Behandlung verschiedener Brustkrebsarten untersucht wird. Ziel dieser Studien ist es festzustellen, Obmetformin wirklich dazu beiträgt, die Wirksamkeit von Standardbehandlungen zu verbessern, wie einige Studien nahelegen (Kim et al., 2014). In einer aktuellen Studie (die METTEN-Studie) (Martin-Castillo etal., 2018), sprachen bei Frauen mit HER2-positivem Brustkrebs im Frühstadium mehr Patienten, die Metformin einnahmen, gut auf eine Chemotherapie / gezielte Behandlung an (65,5%) als bei Patienten, die kein Metformin einnahmen (58,6%). Dieser Unterschied war statistisch nicht signifikant, was bedeutet, dass dieses Ergebnis zufällig erreicht werden konnte. Phase-2-Studien sind jedoch im Allgemeinen nicht in der Lage, auf diese Weise eine statistische Signifikanz zu erreichen, und die Forscher forderten den Übergang zu größeren Phase-3-Studien, die richtig gestaltet werden können, um festzustellen, wie real dieser Effekt ist (Martin-Castillo etal., 2018). Potenziell ermutigende Ergebnisse aus anderen Phase-2-Studien, wie einer bei übergewichtigen Personen mit metastasiertem Brustkrebs, wurden ebenfalls berichtet (Yam et al.,2019). Es ist auch erwähnenswert, dass erwartungsgemäß nicht alle Metformin-Krebsstudien positive Ergebnisse gemeldet haben. Beispielsweise haben andere Phase-2-Studien ergeben, dass Metformin mit Standardtherapie unter bestimmten Umständen keinen wirklichen Unterschied zur Standardtherapie allein aufweist (Mark et al.,2019; Nanni et al., 2019). Wir glauben, dass Metformin in jeder Umgebung am wirksamsten ist, wenn es in Kombination mit anderen antimetabolischen Medikamenten verabreicht wird.Größere Studien sind erforderlich, um diese Probleme zu lösen, und eine Phase-3-Studie ist jetzt im Gange, um Metformin bei Brustkrebs zu untersuchen. Obwohl die Studie nicht vor 2020 abgeschlossen sein soll, zeigten erste Ergebnisse aus den ersten 6 Monaten der Studie, dass Patienten, die unmittelbar nach Abschluss der Operation und der Standard-Chemotherapie mit der Einnahme von Metformin begonnen hatten, günstige Veränderungen in einem molekularen Marker für Brustkrebs aufwiesen (Dowling et al., 2018) undverbesserte metabolische Faktoren (Goodwin et al., 2015).
Statine und Brustkrebs
Beobachtungsstudien verknüpfen Statine mit besseren Ergebnissen bei Brustkrebs
Statine werden normalerweise zur Behandlung von Herz-Kreislauf-Erkrankungen verabreicht. Beobachtungsstudien an großen Gruppen von Menschen, die Statine einnahmen, haben jedoch auch ergeben, dass Brustkrebspatientinnen, die Statine einnahmen, möglicherweise auch das Risiko eines erneuten Auftretens ihres Krebses nach der Behandlung verringert haben, verglichen mit Patienten, die keine Statine einnahmen (Ahern et al., 2014;Manthravadi et al., 2016). Zum Beispiel hatten in einer Studie von fast 2000 Überlebenden von Brustkrebs diejenigen, die innerhalb von drei Jahren nach der Diagnose anfingen, Flecken zu nehmen, eine verringerte Chance, dass ihr Krebs zurückkehrte (Kwan et al., 2008). In einer anderen Studie war nur 6 Monate Statinkonsum nach der Diagnose mit verbesserten Rückfallraten verbunden (Chae et al., 2011).
Wichtig ist, dass die positive Wirkung von Statinen in diesen und anderen Studien stärker mit fettlöslicheren ‚lipophilen‘ Statinen (wie Atorvastatin) verbunden war. In einigen Laborstudien wurde auch gezeigt, dass lipophile Statine im Vergleich zu weniger fettlöslichen Statinen überlegene Antikrebseffekte auf zellulärer Ebene haben (Liu et al., 2017).
Beobachtungsstudien verknüpfen auch die Verwendung von Statinen mit einer verbesserten Reaktion der Krankheit auf die Behandlung und das Überleben bei Patienten mit Brustkrebs, selbst bei Patienten mit Brustkrebsarten, die aggressiver sein können (Manthravadi et al.,2016; Murtola et al., 2014; Zhong et al., 2015). In einer Studie an Patientinnen mit entzündlichem Brustkrebs hatten Patientinnen, die Atorvastatin einnahmen, während sie wegen Krebs behandelt wurden, einen längeren Zeitraum, bevor ihre Krankheit fortgeschritten war, im Vergleich zu Patienten, die kein Statin einnahmen (Brewer et al., 2013).
Statinstarget Brustkrebszellen
Statine, insbesondere fettlösliche lipophile Statine wie Atorvastatin, reduzieren das Wachstum und die Teilung von Brustkrebszellen und erhöhen den Brustkrebszelltod Inlaborstudien
Deutsche Diabetes Gesellschaft“,“Seite“:“47-48″,“Band“:“111″,“Ausgabe“:“1″,“Quelle“:“PubMed“,“abstract“:“Diewirkung von fünf Statinen, d.h. Atorvastatin, Fluvastatin, Lovastatin, Pravastatin und Simvastatin wurde an der Proliferation der humanen Brustkrebs-Zelllinie MCF-7 untersucht. Alle Statine außer Pravastatin konnten die Zellproliferation bei einer Konzentration von bis zu 90 % hemmen 50 Mikro M. Zwischen den wirksamen Statinen wurde kein signifikanter Unterschied beobachtet, der auf eine klassenspezifische Wirkung hinweist. Diese Daten deuten darauf hin, dass Statine über ihre cholesterinsenkende Wirkung hinaus eine klinische Bedeutung bei der Primärprävention von Brustkrebs beim Menschen haben können. Der klinische Beweis muss jedoch abgewartet werden, bevor weitere Schlussfolgerungen gezogen werden.“,“DOI“:“10.1055/s-2003-37501″,“ISSN“:“0947-7349″,“note“:“PMID:12605351″,“journalAbbreviation“:“Verwendbar bis. Clin. Endocrinol.Diabetes“,“language“:“eng“,“author“:,“issued“:{„date-parts“:]}}}],“schema“:“https://github.com/citation-style-language/schema/raw/master/csl-citation.json“}(Alarcon Martinez etal., 2018; Mück et al., 2004; Seeger et al., 2003).Studien zeigen auch, dass Statine möglicherweise die Invasivität von Brustkrebszellen im Labor blockieren können, was darauf hindeutet, dass sie auch dazu beitragen können, die Ausbreitung von Krebs auf andere Körperteile zu verlangsamen (Kanugula et al., 2014;Wolfe et al., 2015). In einem Mausmodell für metastasierten Brustkrebs verzögerte die Statinbehandlung das Wachstum von Krebs, der sich bereits ausgebreitet hatte, um bis zu 80%, wobei innerhalb einer Woche nach Beginn der Behandlung eine vorteilhafte Aktivität festgestellt wurde (Vintonenko et al.,2012).
Andere Studien zeigen auch, dass Statine helfen können, Brustkrebszellen für standardmäßige Strahlentherapie- und Chemotherapiebehandlungen zu sensibilisieren (Kozar et al., 2004;Van Wyhe et al., 2017). Eine Studie ergab, dass Simvastatin dreifach negative oder entzündliche Brustkrebszellen für die Strahlentherapie im Labor sensibilisieren könnte. In derselben Studie wurde bei einer Patientenpopulation beobachtet, dass Frauen mit entzündlichem Brustkrebs, die während ihrer Behandlung Statine einnahmen, eine geringere Chance hatten, dass ihr Krebs innerhalb von 3 Jahren wieder auftrat (Lacerda et al., 2014).Ähnlich wie Metformin können Statine diese Antikrebseffekte bei verschiedenen Brustkrebsarten hervorrufen, einschließlich ER-positivem, HER2-positivem und dreifach negativem Brustkrebs. Tatsächlich zeigen einige Laborstudien, dass Statine besonders wirksam sindgegen dreifach negative Brustkrebszellen (Campbell et al., 2006;Yao et al., 2017).
Klinische Studien, die Statine bei Brustkrebs untersuchen, sind jetzt im Gange
Einige klinische Studien im Frühstadium zeigen nun robust positive Ergebnisse in Bezug auf Statine bei Brustkrebs. Frühphasen-Studien haben untersucht, ob frühe, präoperative Statine dazu beitragen können, molekulare Marker der Erkrankung bei Patienten mit operierbarer Erkrankung zu verbessern. Bisher zeigen diese Studien verbesserte molekulare Krebsprofile bei Patienten mit Statinbehandlung, was darauf hindeutet, dass Atorvastatin und andere Statine in diesem Zusammenhang positive Auswirkungen auf das Wachstum und die Teilung von Krebszellen und den Zelltod haben können, selbst bei Frauen mit hochgradig aggressiveren Tumoren (Bjarnadottir et al.,2013, 2015; Feldt et al., 2015; Garwood et al., 2010).
Basierend auf diesen vielversprechenden Ergebnissen laufen derzeit eine Reihe von Phase-2-Studien, in denen zusätzliche Statine für eine Vielzahl verschiedener Brustkrebsarten untersucht werden, darunter dreifach negativer Brustkrebs. Diese Studien sollten helpestablish, wie Statine Patienten mit Brustkrebs helfen können.
Mebendazol und Brustkrebs
Das Interesse an Mebendazol als potenzielle Krebsbehandlung basiert hauptsächlich auf vielversprechenden mechanistischen Studien und überzeugenden Berichten aus Fallstudien bei Krebspatienten (Nygren und Larsson, 2014; Pantziarka et al., 2014).
Es wird angenommen, dass Mebendazol Krebszellen teilweise abtötet, indem es spezielle Strukturen in der Zelle, sogenannte Mikrotubuli, zerstört (Pantziarka et al.,2014). Es wirkt ähnlich wie Vincristin, ein Chemotherapeutikum, das derzeit zur Behandlung einiger Krebsarten, einschließlich Brustkrebs im fortgeschrittenen Stadium, eingesetzt wird (De Witt et al., 2017).
Studien über Brustkrebszellen, die im Labor gezüchtet wurden, zeigen, dass Mebendazol und verwandte Arzneimittel aus derselben Klasse (Benzimidazole genannt) das Wachstum und die Teilung mehrerer verschiedener Arten von Brustkrebszellen verlangsamen können, einschließlich Zellen, die gegen Chemotherapie resistent sind (Coyne et al., 2013;Hou et al., 2015; Mukhopadhyay et al., 2002). In einer Studie reduzierte Mebendazol das Überleben chemotherapieresistenter Brustkrebszellen um bis zu 63,1% (Coyne et al., 2013).Studien haben auch eine robuste Antikrebsaktivität von Benzimidazolen gegen dreifach negativen Brustkrebs gezeigt (Hou et al., 2015;Zhang et al., 2015). Wichtig ist, dass in einer Studie auch gezeigt wurde, dass ein Benzimidazol direkt auf Brustkrebsstammzellen abzielt (Hou et al., 2015).
Auftauchende Evidenz aus dem Labor legt auch nahe, dass Benzimidazole die Wirksamkeit von Standard-Brustkrebsbehandlungen wie Doxorubicin Undfluorouracil verbessern können (Hou et al., 2015). In einer Laborstudie erhöhte Mebendazol die Wirksamkeit der Strahlentherapie bei tripelnegativen Brustkrebszellen und verhinderte die Entwicklung von Resistenzen gegen die Behandlung (Zhang et al.,2019a). Darüber hinaus zeigte eine Reihe von Studien mit chemotherapieresistenten ER / HER2-positiven Brustkrebszellen, die im Labor gezüchtet wurden, durchweg, dass Mebendazol nicht nur das Überleben von Krebszellen reduzierte, sondern auch dazu beitrug, die Aktivität speziell entwickelter Formen von Brustkrebs-Chemotherapeutika Epirubicin und Gemcitabin zu ergänzen und zu verbessern (Coyne et al., 2014,2012, 2013).
Doxycyclin und Brustkrebs
Neben einem wirksamen Antibiotikum besitzt Doxycyclin auch andere extremwertvolle Eigenschaften, einschließlich entzündungshemmender und Antikrebsaktivität. Dies gibt Doxycyclin ein wirkliches therapeutisches Potenzial bei der Behandlung einer Reihe anderer Krankheiten, einschließlich Krebs (Bahrami et al., 2012).
Labor- und Tierstudien haben seit langem gezeigt, dass Doxycyclin das Wachstum, die Teilung und die Bewegung von Brustkrebszellen blockieren kann (Duivenvoorden et al., 2002; Fife und Sledge, 1995, 1998).Neuere Studien zeigen auch, dass Doxycyclin Krebszellen daran hindern kann, ihre DNA zu reparieren, wenn sie beispielsweise durch Chemotherapie beschädigt wird (Peiris-Pagès et al.,2015). In der Tat zeigen Laborstudien, dass Doxycyclin helfen kannverbessern Sie die Wirksamkeit der Chemotherapie gegen Brustkrebszellen (Foroodi et al., 2009;Lamb et al., 2015a).
In jüngster Zeit lag der Schwerpunkt auf dem Verständnis, wie Doxycyclin das Wachstum von Brustkrebsstammzellen blockieren kann (Ozsvari etal., 2017; Zhang et al., 2017). Eine kürzlich durchgeführte Studie an im Labor gezüchteten Zellen hat gezeigt, dass Doxycyclin das Wachstum sowohl HER2-positiver als auch dreifach negativer Brustkrebs-Stammzellen blockieren und dazu beitragen kann, resistenzbedingte Veränderungen zu verbessern, die durch die Standardchemotherapie Paclitaxel induziert werden (Lin et al.,2018). In einer anderen Laborstudie hat ein kombinatorischer Ansatz, einschließlich Doxycyclin, Brustkrebsstammzellen sehr effektiv ausgerottet (Fiorillo etal., 2019).
Doxycyclinhat gerade frühe klinische Studien bei Brustkrebspatientinnen erreicht. Die Ergebnisse der ersten kleinen Studie, die im Oktober 2018 veröffentlicht wurde, zeigen, dass Patientinnen mit Brustkrebs im Frühstadium, die Doxycyclin nur 14 Tage vor der Operation einnahmen, die molekularen Marker für das Vorhandensein von Krebsstammzellen um durchschnittlich etwa 40% reduzierten. Vorteilhafte Wirkungen wurden für alle bis auf einen der behandelten Patienten festgestellt (8/9) (Scatena et al., 2018).Derzeit laufen größere klinische Studien.
Unsere eigene Evidenz: Die METRICS-Studie
Was sind METRIKEN?
METRICS ist unser eigenes In-Houseresearch-Programm. Über die Sicherheit undWirksamkeit der COC-Protokollmedikamente bei Krebs. Aber es ist auch unsere Verantwortung anzuerkennen, dass wir nicht alle Antworten haben und dass wir immer noch qualitativ hochwertige klinische Forschung zur Untersuchung des COC-Protokolls bei Krebspatienten durchführen müssen, um sicherzustellen, dass das COC-Protokoll so effektiv und sicher wie möglich ist.
Um diese Forschung finanzieren zu können, haben wir ein neuartiges, erschwingliches System entwickelt, bei dem unsere klinische Studie METRICS im Wesentlichen ‚patientenfinanziert‘ ist. Jeder einwilligende Patient, der die Klinik betritt, wird in METRIKEN eingeschrieben, und diese Gebühren helfen, die Studie zu finanzieren. Dies ist ein neues Modell klinischer Forschung, das darauf abzielt, die Finanzierungs- und Datenlücken zu überbrücken, die derzeit die Umwidmung und klinische Weiterentwicklung bereits zugelassener Medikamente behindern.
Die ersten Ergebnisse
In einer ersten Erfolgsformel wurden die Ergebnisse unserer ersten Pilotstudie kürzlich in der von Experten begutachteten Fachzeitschrift Frontiers in Pharmacology veröffentlicht. Das Papier kann hier kostenlos online abgerufen werden.
Die METRICS-Pilotstudie war eine beobachtende retrospektive Studie, was bedeutet, dass unsere Forscher zurückblickten und die klinischen Aufzeichnungen der Patienten analysierten, um herauszufinden, was passiert war. Sie sammelten Daten und zeichneten die Ergebnisse von 95 Patienten mit einem fortgeschrittenen Hirntumor namens Glioblastom auf, die an der Care Oncology Clinic teilnahmen und das vollständige COC-Protokoll neben ihren üblichen Standardbehandlungen einnahmen. Diese Studie hatte keine Kontrollgruppe, daher verglichen unsere Forscher die Ergebnisse aus METRIKEN mit zuvor veröffentlichten Ergebnissen aus früheren Studien an Patienten mit der gleichen Krebsart, die auch Standardbehandlungen einnahmen.
Erste Ergebnisse deuten darauf hin, dass Patienten, die unsere Klinik besuchten und das COC-Protokoll als Teil ihrer üblichen Pflege einnahmen, viel wahrscheinlicher mindestens 2 Jahre überlebten (64.0% der Patienten in unserer Studie überlebten mindestens 2 Jahre, verglichen mit 27-29% bei Patienten in zuvor veröffentlichten Studien) und hatten tendenziell insgesamt längere Überlebenszeiten als normalerweise bei Patienten mit dieser Art von Krebs zu erwarten (Patienten überlebten in unserer Studie durchschnittlich 27 Monate, verglichen mit 15-16 Monaten in früheren Studien) (Agrawalet al., 2019).
Diese Ergebnisse sind extrem vielversprechend, aber sie sind auch noch vorläufig. Wir wissen noch nicht genau, wie sich das COC-Protokoll beispielsweise auf die Überlebenszeiten ausgewirkt haben könnte oder wie andere Faktoren wie bestimmte Patientenmerkmale diese Ergebnisse ebenfalls beeinflusst haben könnten. Aber diese ersten, ersten Beweise sind sicherlich ermutigend und deuten darauf hin, dass wir in die richtige Richtung gehen. Unsere nächste geplante Phase ist die Durchführung einer größeren, gut gestalteten Studie. Sie können mehr darüber erfahrenzukünftige Gesundheitspläne, indem Sie online suchen oder sich an die Klinik wenden.
Mehr über das COC-Protokoll
Was ist das COC-Protokoll?
Das COC-Protokoll ist ein Kombinationsbehandlungsschema, das aus lizenzierten Medikamenten besteht, die von Care Oncology speziell für die zusätzliche Anwendung neben den üblichen Behandlungen (d. H. Standardbehandlungen) eines Patienten entwickelt wurden. Die vier Medikamente, die im COC-Protokoll enthalten sind, sind: Metformin, ein sehr verbreitetes Anti-Diabetes-Medikament; Atorvastatin, eine Art Statin zur Behandlung von Herz-Kreislauf-Erkrankungen; Doxycyclin, eine Art Antibiotikum, das häufig zur Behandlung chronischer Infektionen wie Akne eingesetzt wird; und Mebendazol, ein Arzneimittel, das häufig zur Behandlung von Parasiteninfektionen bei Kindern und Erwachsenen eingesetzt wird.
Wir haben diese vier Medikamente aus Tausenden von potenziellen Kandidaten ausgewählt, weil sie unseren vorgegebenen Auswahlkriterien entsprechen. Zu diesen Kriterien gehören ein solider Nachweis der Wirksamkeit gegen Krebs, ein kohärenter Wirkmechanismus und vor allem ein gutes Sicherheitsprofil. Diese drei zentralen Grundsätze haben unseren Ansatz von Anfang an geprägt.
Sicherheit steht an erster Stelle
Krebs ist eine komplexe Krankheit mit komplexen Behandlungen, und wir glauben, dass die Hinzufügung weiterer Therapien neben Standardbehandlungen sehr sorgfältig bewertet werden sollte. Nicht nur unter dem Gesichtspunkt der Wirksamkeit, sondern vor allem auch in Bezug auf die Sicherheit. Aus diesem Grund basiert unser gesamter Ansatz auf beweisenmeistens auf veröffentlichten wissenschaftlichen Studien und in zunehmendem Maße auch auf unseren eigenen Daten.
Viele verschiedene Medikamente auf dem Markt haben zumindest einige veröffentlichte Beweise für ihre relativ wirksame Anwendung bei Krebs, aber nur wenige dieser Medikamente haben das Niveau der Beweise für Sicherheit und Wirksamkeit, die für das COC-Protokoll erforderlich waren. Für jedes der Protokollmedikamente existieren bereits große Mengen detaillierter Daten, die aus jahrelanger Anwendung in der Allgemeinbevölkerung gewonnen wurden – und dies hat uns bei der Entwicklung einen entscheidenden Vorsprung verschafft.
Wir haben jahrzehntelang veröffentlichte Daten zu jedem der COC-Protokollmedikamente sorgfältig durchsucht und untersucht, wie sie in verschiedenen Patientenpopulationen (einschließlich Krebspatienten) sowie an Zell- und Tiermodellen im Labor wirken. Diese Daten tragen zusammen mit unseren eigenen klinischen Erfahrungen dazu bei, dass wir ein gutes Verständnis dafür haben, wie sich diese Medikamente bei Patienten mit unterschiedlichen Krebsstadien und -typen verhalten, sowohl in Kombination untereinander als auch in Kombination mit zahlreichen anderen Krebstherapien. Dieses Wissen isparamount, und aus unseren Studien, diese Art von Beweisen ist einfach nicht da yetfor viele andere Off-Label-Anti-Krebs-Medikament Kandidaten – vor allem, wenn Inkombination gegeben.
Eine antimetabolische Therapie, die potenziell jeden Krebs bekämpfen kann
Das COC-Protokoll wurde entwickelt, um die allgemeine Fähigkeit von Krebszellen, Energie aufzunehmen und zu nutzen (d. h. zu metabolisieren), einzuschränken. Krebszellen benötigen riesige Energiemengen, um zu überleben, und die überwiegende Mehrheit der Krebsarten verwendet einen adaptiven Prozess namens aerobe Glykolyse, um die überschüssige Energie zu erzeugen, die sie benötigen (Kroemer andPouyssegur, 2008). Jedes der Medikamente im Protokoll kann auf die verschiedenen molekularen Stoffwechselprozesse abzielen, die an und um die aerobe Glykolyse beteiligt sind, und dies kann dazu beitragen, die Gesamtstoffwechselrate der Krebszelle zu senken (Jang et al.,2013).
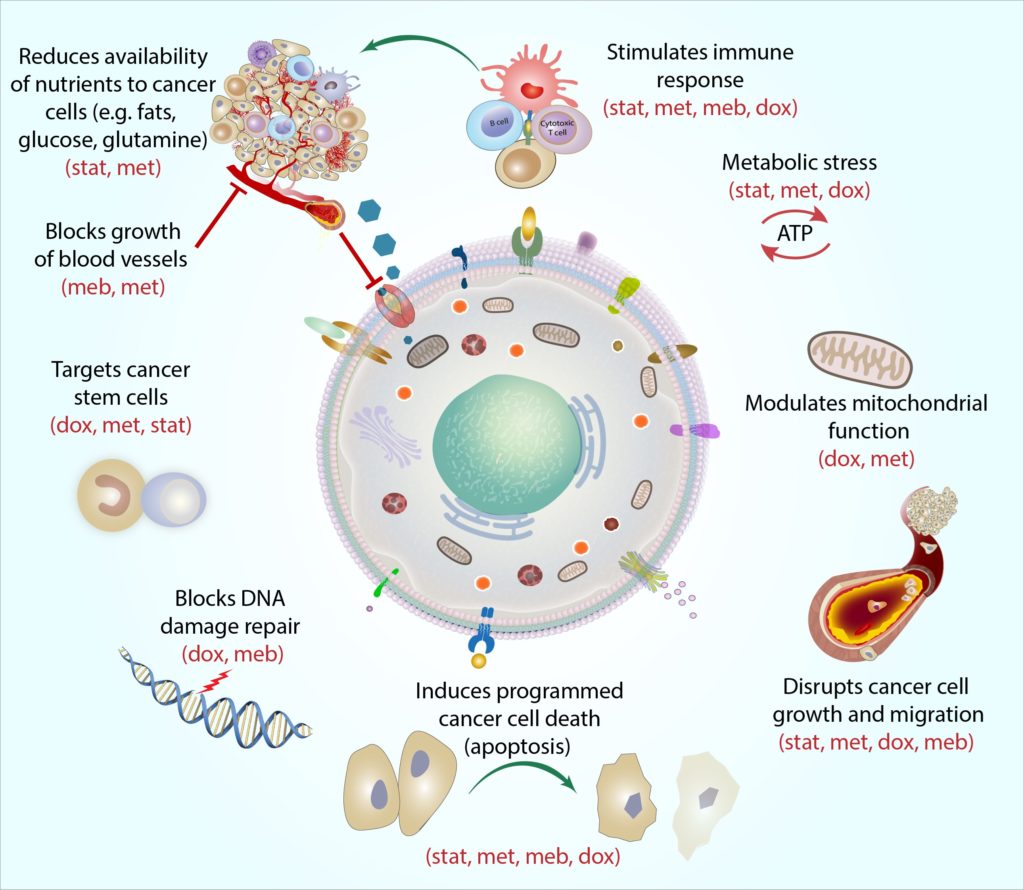
Wir glauben, dass die COCProtocol-Medikamente in Kombination wirken können, um die Energieversorgung und -nutzung konsequent einzuschränken und gleichzeitig zu verhindern, dass Krebszellen sich anpassen und andere Wege nutzen, um Energie aufzunehmen (Jagust et al.,2019). Dadurch werden Krebszellen immer schwächer und weniger in der Lage, die Nährstoffe aufzunehmen und zu verwerten (z. wie Glucose und essentialaminosäuren Glutamin und Arginin) benötigen sie aus ihrer Umgebung (Andrzejewsk Et al., 2018; Liu et al., 2016).Dies macht es für Krebszellen insgesamt schwieriger zu überleben, zu wachsen und sich im Körper auszubreiten. Allmählich werden die geschwächten Zellen (einschließlich widerstandsfähigerer und früher behandlungsresistenter Zellen) anfälliger für Angriffe von anderen zelltötenden Krebstherapien wie Strahlentherapie, Chemotherapie, Hormontherapie und gezielten Therapien (Bradford andKhan, 2013; Chen et al., 2012; Lacerda et al., 2014; Lamb et al., 2015a;Pantziarka et al., 2014). Indem wir die angepassten Stoffwechselmechanismen, die bei den meisten Krebsarten (aber nicht bei gesunden Zellen) üblich sind, gezielt einsetzen, glauben wir, dass das COC-Protokoll für praktisch jeden Krebs wirksam und selektiv sein kann, unabhängig von der spezifischen Art, dem Stadium oder dem Ort des Krebses. Veröffentlichte epidemiologische und Laborstudien unterstützen zunehmend das potenziell breite Spektrum dieser Therapie (Chae et al.,2015, 2016; Iliopoulos et al., 2011; Lamb et al., 2015b; Pantziarka et al.,2014).
Mechanistische Kohärenz in Aktion – die Kraft der Kombination
Die wahre Kraft des COC-Protokolls liegt in der spezifischen Kombination von Medikamenten, die wir verwenden. Wir entwickelten das Protokoll nicht nur als ein Regime von vier Einzelbehandlungen mit jeweils Antikrebsaktivität, sondern auch als eine einzige kombinierte Behandlung – mit dem Potenzial, starke synergistische Effekte zu erzielen (Mokhtari et al., 2017).
Jedes Medikament im COC-Protokoll zielt auf den Stoffwechsel von Krebszellen auf eine unterschiedliche und komplementäre Weise ab, und wir haben diese Aktion als ‚mechanistische Kohärenz‘ bezeichnet. Einfach ausgedrückt beschreibt die mechanistische Kohärenz, wie jedes Medikament die Krebszelle aus einem anderen Blickwinkel angreifen kann. Zum Beispiel sind Krebsstammzellen eine besonders widerstandsfähige Art von Krebszellen, und jedes Medikament zielt auf diese Zellen auf eine andere Weise ab: Metformin zielt auf die ‚Batterien‘ der Zelle (genannt Mitochondrien) ab, indem es es den Mitochondrien sehr schwer macht, die molekularen Reaktionen auszuführen, die sie zur Energieerzeugung benötigen, Doxycyclin blockiert die Zell-DNAmachinery, die Mitochondrien replizieren und reparieren müssen (Skoda et al., 2019) können Statine die Genexpression von Krebsstammzellen verändern, wodurch die Zellen gegenüber anderen Krebstherapien empfindlicher werden (Kodach et al., 2011) Undmebendazol können zahlreiche molekulare Prozesse unterbrechen, die an der Zellteilung beteiligt sind, um das Wachstum von Krebsstammzellen zu blockieren (Hothi et al., 2012; Hou et al., 2015).
Durch die Kombination aller vier Wirkstoffe kann das COC-Protokoll Krebsstammzellen (und andere Krebszellen) über mehrere Schwachstellen hinweg treffen, und wie bei einem Doppelschlag sind die Zellen weniger in der Lage, auszuweichen und sich zu erholen.
Laborstudien beginnen, die Wirksamkeit dieses Ansatzes unter Verwendung von COCprotocol-Medikamentenkombinationen hervorzuheben. In einer mechanistischen Studie verringerte die Kombination von Statin und Metformin das Wachstum von Prostatakrebszellen stärker als jedes Mittel allein (Wang et al., 2017). Beobachtungsstudien haben auch potenziell ’synergistische‘ Wirkungen dieser Medikamente gegen verschiedene Krebsarten berichtet (Babcook etal., 2014; Danzig et al., 2015; Lehman et al., 2012; Nimako et al., 2017). Eine klinische Studie zur Untersuchung von Metformin und Doxycyclin bei Brustkrebs ist im Gange (NCT02874430), und unser eigenes Forschungsprogramm, METRICS, beginnt nun auch vielversprechende Daten zu liefern.
Eine langfristige Zusatztherapie
Das COC-Protokoll ist in erster Linie als langfristige Zusatztherapie konzipiert, um die Standardbehandlungen zu optimieren. Da die metabolische Behandlung mit dem KOKPROTOKOLL jedoch langfristig erfolgen soll, können die Patienten das Protokoll auch als Wartungsregime nach Abschluss der Standardbehandlung oder während der Pausen von der Standardbehandlung und als Teil einer langfristigen Strategie zur Minderung des Risikos eines erneuten Auftretens oder von Metastasen anwenden. Aus diesem Grund ist es auch erwähnenswert, dass jedes der COC-Protokollmedikamente auch über vorteilhafte Wirkungsmechanismen bei Krebs berichtet hat, die nicht von der gleichzeitigen Verabreichung von Standardtherapien abhängen und unabhängig voneinander dazu beitragen können, das Risiko eines Rückfalls und einer metastatischen Ausbreitung zu verringern.
Das Care-Onkologie-Modell
Aktive medizinische Überwachung jedes Patienten
Obwohl die COCProtocol-Medikamente seit vielen Jahren in der Allgemeinbevölkerung sicher angewendet werden, ist jeder Patient, der zu uns kommt, einzigartig. Aus diesem Grund wird jeder Patient, der die Care Oncology Clinic besucht, unter die direkte Obhut von Klinikern mit Fachwissen über die Verschreibung der COC-Protokollmedikamente im Kontext von Krebs gestellt. Unsere Kliniker bewerten individuell die potenziellen Vorteile und Risiken, die mit der Einnahme des COC-Protokolls bei jedem Patienten verbunden sind. Sie werden das COC-Protokoll nur dann Patienten empfehlen, wenn sie der Meinung sind, dass dies sicher und vorteilhaft ist. Jede Verschreibung des COC-Protokolls ist auf die Bedürfnisse des Patienten zugeschnitten, und Dosen und Behandlungsschemata werden sorgfältig überprüft und angepasst, je nachdem, wie der Patient fortschreitet.
Es ist daher wichtig, dass Patienten das COC-Protokoll nur einnehmen, während sie in unserer Klinik für die Dauer ihrer Behandlung sorgfältig überwacht werden.
*********************************************************************************
Wichtiger Hinweis
Zweck dieses Artikels
Dieser Artikel gibt einen Überblick über einige wissenschaftliche und medizinische Literatur über die Medikamente, die das patentierte Care Oncologyprotokoll enthalten. Es wurde sorgfältig darauf geachtet, relevante Artikel auszuwählen, die die Off-Label-Anwendung dieser Arzneimittel in einem klinischen Umfeld zur Zusatzbehandlung von Krebs unterstützen. Dieser Artikel erhebt nicht den Anspruch, eine umfassende Überprüfung aller Beweise zu sein, noch erfasst er alle möglichen Nebenwirkungen einer solchen Behandlung.
Dieser Artikel dient nur zu Informationszwecken und stellt KEINE medizinische Beratung dar. Die hier besprochenen Arzneimittel sind nur auf Rezept erhältlich und sollten nicht ohne Rücksprache mit Ihrem Arzt oder einem anderen professionellen Gesundheitsdienstleister eingenommen werden. Pflege Onkologie Ärzte werden die Eignung dieser Medikamente mit Ihnen besprechen und mit Ihrem Arzt oder Onkologen in Verbindung treten, um ihre Eignung für Sie zu besprechen.
Sie dürfen sich NICHT auf die Informationen in diesem Artikel als Alternative zum medizinischen Rat Ihres Arztes oder eines anderen professionellen Gesundheitsdienstleisters verlassen. Wenn Sie spezielle Fragen zu medizinischen Fragen haben, sollten Sie Ihren Arzt oder einen anderen professionellen Gesundheitsdienstleister konsultieren. Wenn Sie glauben, dass Sie an einer Krankheit leiden, sollten Sie sofort einen Arzt aufsuchen. Youshould verzögern nie, ärztlichen Rat zu suchen, ärztlichen Rat zu missachten, ordiscontinue medizinische Behandlung wegen der Informationen, die in diesem Artikel enthalten werden.
Copyright
Das Urheberrecht an diesem Artikel liegt bei Health Clinics LLC und seinen Lizenzgebern.
Patent
Das Care Oncology(„COC“)-Protokoll ist durch das US-Patent US9622982B2 und verschiedene weitere internationale Patente geschützt.
*********************************************************************************
Agrawal,S., Vamadevan, P., Mazibuko, N., Bannister, R., Swery, R., Wilson, S., andEdwards, S. (2019). Eine neue Methode zur ethischen und effizienten Evidenzgenerierung für den Off-Label-Einsatz von Medikamenten in der Onkologie (eine Fallstudie zum Glioblastom). Front.Pharmacol. 10.
Ahern, T.P., Lash, T.L., Damkier, P., Christiansen,P.M. und Cronin-Fenton, D.P. (2014). Statine und Brustkrebsprognose:Evidenz und Chancen. Lancet Oncol. 15, e461-468.
Aksoy, S., Sendur, M.A.N. und Altundag, K. (2013).Demografische und klinisch-pathologische Merkmale bei Patienten mit invasivenbrustkrebs, der Metformin erhält. Med. Oncol. Northwood Lond. In: Engl. 30, 590.
Alarcon Martinez, T., Zeybek, N.D. und Müftüoğlu, S.(2018). Bewertung der zytotoxischen und autophagischen Wirkungen von Atorvastatin auf MCF-7-Brustkrebszellen. Sträuben. Med. J. 35, 256-262.
Alimova, I.N., Liu, B., Fan, Z., Edgerton, S.M.,Dillon, T., Lind, S.E. und Thor, A.D. (2009). Metformin hemmt brust cancercell wachstum, kolonie bildung und induziert zelle zyklus arrest in vitro. Zellzyklus 8, 909-915.
Andrzejewski, S., Siegel, P.M. und St-Pierre, J.(2018). Metabolische Profile im Zusammenhang mit der Wirksamkeit von Metformin bei Krebs. Front.Endocrinol. 9.
Babcook, M.A., Shukla, S., Fu, P., Vazquez, E.J.,Puchowicz, M.A., Molter, J.P., Eiche, C.Z., MacLennan, G.T., Flasche, C.A.,Lindner, D.J., et al. (2014). Synergistische Simvastatin- und Metformin-Kombinationchemotherapie bei knöchernem metastasiertem kastrationsresistentem Prostatakrebs. Mol.Krebs Ther. 13, 2288–2302.
Bahrami, F., Morris, D.L. und Pourgholami, M.H.(2012). Tetracycline: Medikamente mit großem therapeutischen Potenzial. Dr. Med.Chem. 12, 44–52.
Bao, B., Azmi, AS, Ali, S., Zaiem, F. und Sarkar,FH (2014). Metformin kann als Antikrebsmittel wirken, indem es auf Krebsstammzellen abzielt: die potenzielle biologische Bedeutung von tumorassoziierten miRNAs bei Brust- und Bauchspeicheldrüsenkrebs. Ann. In: Transl. Med. 2.
Bjarnadottir, O., Romero, Q., Bendahl, P.-O., Jirström,K., Rydén, L., Loman, N., Uhlén, M., Johannesson, H., Rose, C., Grabau, D., etal. (2013). Targeting HMG-CoA-Reduktase mit Statinen in einem Fenster-of-opportunitybreast Krebs-Studie. Brustkrebs Res. Behandeln. 138, 499–508.
Bjarnadottir, O., Kimbung, S., Johansson, I., Veerla,S., Jönsson, M., Bendahl, P.-O., Grabau, D., Hedenfalk, I. und Borgquist, S.(2015). Globale transkriptionelle Veränderungen nach Statin-Behandlung bei Brustkrebs. Clin. Krebs Res. Aus. J. Am. Assoc. Krebs Res. 21, 3402-3411.
Bonanni, B., Puntoni, M., Cazzaniga, M., Pruneri, G.,Serrano, D., Guerrieri-Gonzaga, A., Gennari, A., Trabacca, MS, Galimberti,V., Veronesi, P., et al. (2012). Metformin auf Brustkrebsproliferation in einer randomisierten prächirurgischen Studie. J. Clin. Oncol. Off. J. Am.Soc. Clin. Oncol. 30, 2593–2600.
Bradford, S.A. und Khan, A. (2013). Individualisierungchemotherapie mit dem Antidiabetikum Metformin als âÂÂœAdjuvantâÂÂ: AnExploratory Study. J. Krebs Sci. Ther. 5.
Brauer, T.M., Masuda, H., Liu, D.D., Shen, Y., Liu,P., Iwamoto, T., Kai, K., Barnett, C.M., Woodward, W.A., Reuben, J.M., et al.(2013). Statin Verwendung bei primären entzündlichen Brustkrebs: eine Kohortenstudie. Br.J. Krebs 109, 318-324.
Camacho, L., Dasgupta, A. und Jiralerspong, S.(2015). Metformin bei Brustkrebs – ein sich entwickelndes Rätsel. Brustkrebs Res.BCR 17, 88.
Campbell, M.J., Esserman, L.J., Zhou, Y., Schuhmacher,M., Lobo, M., Borman, E., Baehner, F., Kumar, A.S., Adduci, K., Marx, C., etal. (2006). Brustkrebs-Wachstum Prävention durch Statine. Krebs Res. 66,8707-8714.
Cazzaniga, M., DeCensi, A., Pruneri, G., Puntoni, M.,Bottiglieri, L., Varricchio, C., Guerrieri-Gonzaga, A., Gentilini, O.D.,Pagani, G., Dell’Orto, P., et al. (2013). Die Wirkung von Metformin auf die Apoptose in einer prächirurgischen Studie gegen Brustkrebs. Br. J. Krebs 109, 2792-2797.
Chae, YK, Valsecchi, ME, Kim, J., Bianchi, A.L.,Khemasuwan, D., Desai, A. und Tester, W. (2011). Reduziertes Risiko für Brustkrebswiederauftreten bei Patienten mit ACE-Hemmern, ARBs und / oder Statinen. In: CancerInvest. 29, 585–593.
Chae, YK, Yousaf, M., Malecek, M.-K., Carneiro, B.,Chandra, S., Kaplan, J., Kalyan, A., Sassano, A., Platanias, LC und Giles,F. (2015). Statine als Krebstherapie; Können wir präklinische und epidemiologische Daten in klinischen Nutzen übersetzen? Discov. Med. 20, 413–427.
Chae, Y.K., Arya, A., Malecek, M.-K., Shin, D.S.,Carneiro, B., Chandra, S., Kaplan, J., Kalyan, A., Altman, J.K., Platanias, L.,et al. (2016). Repurposing Metformin für die Krebsbehandlung: aktuelle klinische Studien. Oncotarget 7, 40767-40780.
Chen, J., Lan, T., Hou, J., Zhang, J., Ein, Y., Krawatte,L., Pan, Y., Liu, J., und Li, X. (2012). Atorvastatin sensibilisiert humane kleinzellige Lungenkarzinome für Carboplatin durch Unterdrückung der AKT-Aktivierung und Hochregulierung von TIMP-1. Int. J. Biochem. In: Cell Biol. 44, 759–769.
Chen, L., Chubak, J., Boudreau, D.M., Barlow, W.E.,Weiss, N.S. und Li, C.I. (2017). Diabetes-Behandlungen und Risiken von AdverseBreast Cancer Outcomes bei Brustkrebspatientinnen im Frühstadium: Ein SEHER-MedicareAnalysis. Krebs Res. 77, 6033-6041.
Chen, T., Liang, Y., Feng, D., Tao, L., Qi, K., Zhang,H., Wang, H., Lin, Q. und Kong, H. (2013). Metformin hemmt die Proliferation und fördert die Apoptose von HER2-positiven Brustkrebszellen, indem es HSP90 herunterreguliert. J. BUON aus. J. Balk. In: Union Oncol. 18, 51–56.
Coyne, C., Jones, T. und Bear, R. (2014).Anti-neoplastische Zytotoxizität von Gemcitabin-(C4-Amid)- inDual-Kombination mit Epirubicin- (C3-Amid)- gegenchEmotherapeutisch-resistentes Mamma-Adenokarzinom (SKBr-3) und dieKomplementäre Wirkung von Mebendazol. In: J. Cancer Res. Ther. Oncol. 2.
Coyne, CP, Jones, T. und Bär, R. (2012). Einfluss alternativer Tubulin-Inhibitoren auf die Wirksamkeit eines Epirubicin-Immunchemotherapeutikums, das mit einem ultraviolettlichtaktivierten Zwischenprodukt synthetisiert wird. Krebs Clin. Oncol. 1, 49–80.
Coyne, CP, Jones, T. und Bär, R. (2013).Gemcitabine-(C4-amide)- Anti-Neoplastic Cytotoxicity in DualCombination with Mebendazole against Chemotherapeutic-Resistant MammaryAdenocarcinoma. J. Clin. Exp. Oncol. 2.
Cufi, S., Corominas-Faja, B., Vazquez-Martin, A.,Oliveras-Ferraros, C., Dorca, J., Bosch-Barrera, J., Martin-Castillo, B., andMenendez, J.A. (2012). Metformin-induced preferential killing of breast cancerinitiating CD44+CD24-/low cells is sufficient to overcome primary resistance totrastuzumab in HER2+ human breast cancer xenografts. Oncotarget 3, 395–398.
Danzig, M.R., Kotamarti, S., Ghandour, R.A., Rothberg,MB, Dubow, BP, Benson, MC, Badani, KK und McKiernan, JM (2015).Synergismus zwischen Metformin und Statinen bei der Modifizierung des Risikos eines biochemischen Wiederauftretens nach radikaler Prostatektomie bei Männern mit Diabetes. Prostatakrebs Prostatakrebs Dis. 18, 63–68.
Davies, G., Lobanova, L., Dawicki, W., Groot, G.,Gordon, JR, Bowen, M., Harkness, T. und Arnason, T. (2017). Metformin hemmt die Entwicklung und fördert die Resensibilisierung von behandlungsresistentem Brustkrebs. Plus EINS 12.
De Witt, M., Gamble, A., Hanson, D., Markowitz, D.,Powell, C., Al Dimassi, S., Atlas, M., Boockvar, J., Ruggieri, R. und Symons,M. (2017). Umwidmung von Mebendazol als Ersatz für Vincristin zur Behandlung von Hirntumoren. Mol. Med. 23, 50–56.
DeCensi, A., Puntoni, M., Gandini, S.,Guerrieri-Gonzaga, A., Johansson, H.A., Cazzaniga, M., Pruneri, G., Serrano,D., Schwab, M., Hofmann, U., et al. (2014). Differentielle Wirkungen von Metforminon Brustkrebsproliferation nach Markern der Insulinresistenz Undtumorsubtyp in einer randomisierten prächirurgischen Studie. Brustkrebs Res. Behandeln. 148,81–90.
DeCensi, A., Puntoni, M., Guerrieri-Gonzaga, A.,Cazzaniga, M., Serrano, D., Lazzeroni, M., Vingiani, A., Gentilini, O.,Petrera, M., Viale, G., et al. (2015). Wirkung von Metformin auf Brustduktalkarzinom In Situ Proliferation in einer randomisierten prächirurgischen Studie. Krebs Prev.In: Res. Phila. Pa 8, 888-894.
Deng, X.-S., Wang, S., Deng, A., Liu, B., Edgerton,S.M., Lind, S.E., Wahdan-Alaswad, R. und Thor, A.D. (2012). Metformin targetsStat3 hemmt das Zellwachstum und induziert Apoptose bei dreifach negativen Brustkrebs. Zellzyklus Georget. Tex 11, 367-376.
Dowling, R.J., Parulekar, W.R., Gelmon, K.A.,Schäfer, L.E., Virk, S., Ennis, M., Mao, F., Ligibel, JA, Hershman, DL,Rastogi, P., et al. (2018). CA15-3 / MUC1 in CCTG MA-32 (NCT01101438): Eine phaseIII-RCT der Wirkung von Metformin vs. Placebo auf das invasive krankheitsfreie und Gesamtüberleben bei Brustkrebs im Frühstadium (BC). J. Clin. Oncol.
Duivenvoorden, W.C.M., Popović, S.V., Lhoták, S., Seidlitz,E., Hirte, H.W., Tozer, R.G. und Singh, G. (2002). Doxycyclin verringert tumorburden in einem Knochenmetastasenmodell von menschlichem Brustkrebs. Krebs Res. 62,1588–1591.
El-Benhawy, S.A. und El-Sheredy, H.G. (2014).Metformin und Überleben bei Diabetikern mit Brustkrebs. J. Ägypten.Öffentliche Gesundheit Assoc. 89, 148–153.
Feldt, M., Bjarnadottir, O., Kimbung, S., Jirström,K., Bendahl, P.-O., Veerla, S., Grabau, D., Hedenfalk, I. und Borgquist, S.(2015). Statin-induzierte anti-proliferative Effekte über Cyclin D1 und p27 in einer Window-of-Opportunity-Brustkrebs-Studie. In: J. Transl. Med. 13, 133.
Fife, R.S. und Sledge, G.W. (1995). Auswirkungen Vondoxycyclin auf in vitro Wachstum, Migration und Gelatinaseaktivität von Brustkarzinomzellen. In: J. Lab. Clin. Med. 125, 407–411.Fife, R.S., und Sledge, G.W. (1998). Auswirkungen Vondoxycyclin auf Krebszellen in vitro und in vivo. Adv. Dent. 12, 94-96.
Fiorillo, M., Tóth, F., Sotgia, F. und Lisanti, M.P.(2019). Doxycyclin, Azithromycin und Vitamin C (DAV) : Eine wirksame Kombinationstherapie zur Bekämpfung von Mitochondrien und zur Ausrottung von Krebsstammzellen (CSCs).Altern 11, 2202-2216.
Foroodi, F., Duivenvoorden, W.C. und Singh, G.(2009). Wechselwirkungen von Doxycyclin mit Chemotherapeutika in menschlichen Brustadenokarzinom-MDA-MB-231-Zellen. Krebsmedikamente. Drogen 20, 115-122.
Garwood, E.R., Kumar, A.S., Baehner, F.L., Moore,DH, Au, A., Hylton, N., Blumen, C.I., Garber, J., Lesnikoski, B.-A., Hwang,ES, et al. (2010). Fluvastatin reduziert die Proliferation und Erhöhtapoptose bei Frauen mit hochgradigem Brustkrebs. Brustkrebs Res. Behandeln. 119, 137–144.
Giles, E.D., Jindal, S., Wellberg, E.A., Schedin, T.,Anderson, S.M., Thor, A.D., Edwards, D.P., MacLean, P.S. und Schedin, P.(2018). Metformin hemmt stromal aromatase ausdruck und tumor progressionin ein nagetier modell von postmenopausalen brustkrebs. Brustkrebs Res. BCR 20.
Goodwin, P.J., Parulekar, W.R., Gelmon, K.A.,Shepherd, L.E., Ligibel, J.A., Hershman, D.L., Rastogi, P., Mayer, I.A.,Hobday, T.J., Lemieux, J., et al. (2015). Wirkung von Metformin vs Placebo auf undmetabolische Faktoren in NCIC CTG MA.32. In: J. Natl. Krebs Inst. 107.
Hadad, S., Iwamoto, T., Jordan, L., Purdie, C., Bray,S., Bäcker, L., Jellema, G., Deharo, S., Hardie, D.G., Pusztai, L., et al.(2011). Beweise für biologische Wirkungen von Metformin bei operablem Brustkrebs: eine präoperative, randomisierte Studie mit Zeitfenster. Brustkrebs Res.Behandeln. 128, 783–794.
Hadad, S.M., Hardie, D.G., Appleyard, V., andThompson, A.M. (2014). Auswirkungen von Metformin auf die Brustkrebszellproliferation, den AMPK-Signalweg und den Zellzyklus. Clin. In: Transl. Oncol. Off.Publ. FBI. Span. Oncol. Soc. Natl. Krebs Inst. Mex. 16, 746–752.
Hatoum, D. und McGowan, EM (2015). Jüngste Fortschritte bei der Verwendung von Metformin: Kann die Behandlung von Diabetes Brustkrebs verhindern? Biomedizin. Int. 2015, 548436.
Hirsch, H.A., Iliopoulos, D., Tsichlis, P.N. und Struhl, K. (2009). Metformin zielt selektiv auf Krebsstammzellen ab und wirkt zusammen mit Chemotherapie, um das Tumorwachstum zu blockieren und die Remission zu verlängern. CancerRes. 69, 7507–7511.
P., Martins, TJ, Chen, L., Deleyrolle, L.,Yoon, JG, Reynolds, B. und Foltz, G. (2012). High-Throughput ChemicalScreens identifizieren Disulfiram als Inhibitor von humanen Glioblastom-Stammzellen.Onkotarget 3, 1124-1136.
Hou, Z.-J., Luo, X., Zhang, W., Peng, F., Cui, B., Wu, S.-J., Zheng, F.-M., Xu, J., Xu, L.-Z., Lange, Z.-J., et al. (2015).Flubendazol, FDA-zugelassenes Anthelminthikum, zielt auf Brustkrebs-Stammzellen ab.Oncotarget 6, 6326-6340.
Iliopoulos, D., Hirsch, H.A. und Struhl, K. (2011).Metformin verringert die Dosis der Chemotherapie zur Verlängerung der Tumorremission bei Xenotransplantaten von Mäusen, an denen mehrere Krebszelltypen beteiligt sind. Krebs Res. 71,3196-3201.
Jacob, L., Kostev, K., Rathmann, W. und Kalder, M.(2016). Auswirkungen von Metformin auf Metastasen bei Patienten mit Brustkrebs undTyp-2-Diabetes. J. Diabetes Komplikationen 30, 1056-1059.
Jagust, P., de Luxán-Delgado, B., Parejo-Alonso, B.und Sancho, P. (2019). Stoffwechselbasierte Therapiestrategien gegen Krebsstammzellen. Front. Pharmacol. 10.
Jang, M., Kim, SS und Lee, J. (2013). Krebszellstoffwechsel: auswirkungen auf therapeutische Ziele. Verwendbar bis. Mol. Med. 45, e45.
Jiralerspong, S., Palla, S.L., Giordano, S.H.,Meric-Bernstam, F., Liedtke, C., Barnett, C.M., Hsu, L., Hung, M.-C.,Hortobagyi, G.N. und Gonzalez-Angulo, A.M. (2009). Metformin und PathologicComplete Antworten auf neoadjuvante Chemotherapie bei Diabetikern mit Brustkrebs. J. Clin. Oncol. 27, 3297–3302.
Kalinsky, K., Crew, K.D., Refice, S., Xiao, T., Wang,A., Feldman, S.M., Taback, B., Ahmad, A., Cremers, S., Hibshoosh, H., et al.(2014). Metformin bei übergewichtigen und adipösen Patienten mitneu diagnostizierter Brustkrebs. Krebs investieren. 32, 150–157.
Kanugula, A.K., Gollavilli, P.N., Vasamsetti, S.B.,Karnewar, S., Gopoju, R., Ummanni, R. und Kotamraju, S. (2014). Statin-induzierte Hemmung der Proliferation und Invasion von Brustkrebs beinhaltet die Abschwächung des Eisentransports: Vermittlung von Stickoxid und antioxidativen Abwehrmechanismen. FEBS J. 281, 3719-3738.
Kim, H.J., Kwon, H., Lee, J.W., Kim, H.J., Lee, S.B.,Park, H.S., Sohn, G., Lee, Y., Koh, B.S., Yu, J.H., et al. (2015). Metformin erhöht das Überleben bei Hormonrezeptor-positiven, HER2-positiven Brustkrebspatientinnen mit Diabetes. Brustkrebs Res. BCR 17, 64.
Kim, J., Lim, W., Kim, E.-K., Kim, M.-K., Paik, N.-S.,Jeong, S.-S., Yoon, J.-H., Park, C.H., Ahn, S.H., Kim, L.S., et al. (2014).Randomisierte Phase-II-Studie mit neoadjuvantem Metformin plus Letrozol im Vergleich zu Placeboplus Letrozol bei Östrogenrezeptorpositivem postmenopausalem Brustkrebs (METEOR). BMC Krebs 14, 170.
Kodach, L.L., Jacobs, R.J., Voorneveld, P.W.,Wildenberg, M.E., Verspaget, H.W., van Wezel, T., Morreau, H., Hommes, D.W.,Peppelenbosch, M.P., van den Brink, G.R., et al. (2011). Statine erhöhen thechemosensitivity von Darmkrebszellen, die epigenetic reprogrammingand induzieren, das Darmkrebszell „stemness“ über die knochenmorphogeneticprotein Bahn verringernd. Gut 60, 1544-1553.
Kozar, K., Kaminski, R., Legat, M., Kopec, M., Nowis,D., Skierski, J., Koronkiewicz, M., Jakóbisiak, M. und Golab, J. (2004).Cerivastatin zeigt eine verbesserte Antitumoraktivität gegen menschliche Brustkrebszelllinien, wenn es in Kombination mit Doxorubicin oder Cisplatin angewendet wird. Int.In: J. Oncol.
Kroemer, G., und Pouyssegur, J. (2008). Tumorzellstoffwechsel: Die Achillesferse des Krebses. Krebszelle 13, 472-482.
Kwan, ML, Habel, LA, Flick, ED, Quesenberry, CP und Caan, B. (2008). Statinkonsum nach der Diagnose und Brustkrebswiederauftreten in einer prospektiven Kohortenstudie an Brustkrebs-Überlebenden im Frühstadium. Brustkrebs Res. Behandeln. 109, 573–579.
Lacerda, L., Reddy, J.P., Liu, D., Larson, R., Li, L.,Masuda, H., Brauer, T., Debeb, B.G., Xu, W., Hortobágyi, G.N., et al. (2014).Simvastatin radiosensibilisiert differenzierte und stammähnliche Brustkrebszelllinien und ist mit einer verbesserten lokalen Kontrolle bei entzündlichen Brustkrebspatientinnen verbunden, die mit Postmastektomiebestrahlung behandelt wurden. Stammzellen Transl. Med.3, 849–856.
Lamb, R., Fiorillo, M., Chadwick, A., Ozsvari, B.,Reeves, K.J., Schmied, D.L., Clarke, R.B., Howell, S.J., Cappello, A.R.,Martinez-Outschoorn, U.E., et al. (2015a). Doxycyclin reguliert DNA-PK herunter und radiosensibilisiert tumorinitiierende Zellen: Implikationen für eine effektivere Strahlentherapie. Oncotarget 6, 14005-14025.
Lamb, R., Ozsvari, B., Lisanti, C.L., Tanowitz, H.B.,Howell, A., Martinez-Outschoorn, U.E., Sotgia, F. und Lisanti, M.P. (2015b).Antibiotika, die auf Mitochondrien abzielen, beseitigen effektiv Krebsstammzellen über mehrere Tumortypen hinweg: Behandlung von Krebs wie eine Infektionskrankheit.Oncotarget 6, 4569-4584.
Lehman, D.M., Lorenzo, C., Hernandez, J. und Wang, C.(2012). Statin Verwendung als Moderator von Metformin Wirkung auf das Risiko für Prostatakrebs bei Typ-2-Diabetes-Patienten. Diabetes Pflege 35, 1002-1007.
Lin, C., Lo, M., Moody, R., Stevers, N., Tinsley, S.und Sun, D. (2018). Doxycyclin zielt auf Aldehyddehydrogenase-positive Brustkrebsstammzellen ab. Oncol. Rep.
Liu, B., Yi, Z., Guan, X., Zeng, Y.-X. und Ma, F.(2017). Die Beziehung zwischen Statinen und Brustkrebsprognose variiert je nach Typ und Expositionszeit: eine Metaanalyse. Brustkrebs Res. Behandeln. 164,1–11.
Liu, H., Scholz, C., Zang, C., Schefe, J.H., Habbel,P., Regierer, A.-C., Schulz, C.-O., Possinger, K. und Eucker, J. (2012).Metformin und der mTOR-Inhibitor Everolimus (RAD001) sensibilisieren Brustkrebszellen für die zytotoxische Wirkung von Chemotherapeutika in vitro. Anti-Krebs. 32, 1627–1637.
Liu, X., Romero, I.L., Litchfield, L.M., Lengyel, E.und Locasale, J.W. (2016). Metformin zielt auf den zentralen Kohlenstoffstoffwechsel ab und deckt den mitochondrialen Bedarf bei menschlichen Krebserkrankungen auf. Zelle Metab. 24, 728–739.
Ma, J., Guo, Y., Chen, S., Zhong, C., Xue, Y., Zhang,Y., Lai, X., Wei, Y., Yu, S., Zhang, J., et al. (2014). Metformin verstärkt die durch Tamoxifen vermittelte Tumorwachstumshemmung bei ER-positivem Mammakarzinom. BMCCancer 14, 172.
Manthravadi, S., Shrestha, A. und Madhusudhana, S.(2016). Auswirkungen des Statinkonsums auf das Wiederauftreten und die Mortalität von Krebs bei Brustkrebs: Eine systematische Überprüfung und Metaanalyse. Int. J. Krebs 139, 1281-1288.
Mark, M., Klingbiel, D., Mey, U., Winterhalder, R.,Rothermundt, C., Gillessen, S., von Moos, R., Pollak, M., Manetsch, G.,Strebel, R., et al. (2019). Auswirkungen der Zugabe von Metformin zu Abirateron bei Patienten mit metastasiertem kastrationsresistentem Prostatakrebs mit fortschreitender Erkrankung während der Behandlung mit Abirateron (MetAb-Pro): Phase-2-Pilotstudie. Clin. Genitourin. Krebs 17, e323-e328.
Martin-Castillo, B., Pernas, S., Dorca, J., A. S., A. S., A. S., A. S., A. S.,A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., et al. (2018). Eine Phase-2-Studie mit neoadjuvantem Metformin in Kombination mit Trastuzumab und Chemotherapie bei Frauen mit frühem HER2-positivem Brustkrebs: die METTEN-Studie. Oncotarget 9.35687-35704.Mokhtari, RB, Homayouni, TS, Baluch, N.,Morgatskaya, E., Kumar, S., Das, B. und Yeger, H. (2017). Kombinationstherapie zur Bekämpfung von Krebs. Oncotarget 8, 38022-38043.Mück, A.O., Seeger, H. und Wallwiener, D. (2004).Inhibitorische Wirkung von Statinen auf die Proliferation von Brustkrebs beim Menschen cells.Int . J. Clin. Pharmacol. Ther. 42, 695–700.
Mukhopadhyay, T., Sasaki, J., Ramesh, R. und Roth, JA (2002). Mebendazol löst sowohl in vitro als auch in vivo eine starke Antitumorwirkung auf menschliche Krebszelllinien aus. Clin. Krebs Res. 8, 2963-2969.
Murtola, TJ, Visvanathan, K., Artama, M., Vainio,H. und Pukkala, E. (2014). Statingebrauch und Brustkrebsüberleben: eine landesweite Kohortenstudie aus Finnland. PLoS One 9, e110231.
Nanni, O., Amadori, D., De Censi, A., Rocca, A.,Freschi, A., Bologna, A., Gianni, L., Rosetti, F., Amaducci, L., Cavanna, L.,et al. (2019). Metformin plus Chemotherapie versus Chemotherapie allein in der Erstlinientherapie von HER2-negativem metastasiertem Brustkrebs. Die klinische Phase-2-Studie MYMErandomized. Brustkrebs Res. Behandeln. 174, 433–442.
Nimako, G.K., Wintrob, Z.A.P., Sulik, D.A., Donato,J.L. und Ceacareanu, A.C. (2017). Synergistischer Nutzen von Statin und Metformin Bei gastrointestinalen Malignomen. In: J. Pharm. Prakt. 30, 185–194.
Niraula, S., Dowling, R.J.O., Ennis, M., Chang, M.C.,Getan, S.J., Haube, N., Escallon, J., Leong, W.L., Reedijk, M., et al. (2012). Metformin bei Brustkrebs im Frühstadium: ein prospektives Zeitfenster neoadjuvante Studie. Brustkrebs Res. Behandeln. 135, 821–830.
Nygren, P. und Larsson, R. (2014). Drug repositioningvon der Bank zum Krankenbett: Tumorremission durch das Antihelmintikum Mebendazol bei refraktärem metastasierendem Dickdarmkrebs. Acta Oncol. 53, 427–428.
Orecchioni, S., Reggiani, F., Talarico, G., Mancuso,P., Calleri, A., Gregato, G., Labanca, V., Noonan, DM, Dallaglio, K., Albini,A., et al. (2015). Die Biguanide Metformin und Phenformin hemmen die Angiogenese, das lokale und metastasierte Wachstum von Brustkrebs, indem sie sowohl auf neoplastische als auch auf Mikroumgebungszellen abzielen. Int. J. Krebs 136, E534-544.
Ozsvari, B., Sotgia, F. und Lisanti, MP (2017). Ein mutationsunabhängiger Ansatz zur Krebstherapie: Hemmung von onkogenem RAS und MYC durch gezielte mitochondriale Biogenese. Altern 9, 2098-2116.
Pantziarka, P., Bouche, G., Meheus, L., Sukhatme, V.und Sukhatme, V.P. (2014). Repurposing Drugs in Oncology (ReDO)-Mebendazol als Antikrebsmittel. Ecancermedicalscience 8.
Peiris-Pagès, M., Sotgia, F. und Lisanti, M.P.(2015). Doxycyclin und therapeutisches Targeting der DNA-Schadensreaktion Inkrebszellen: altes Medikament, neuer Zweck. Oncoscience 2, 696-699.
Rahmani, J., Manzari, N., Thompson, J., Gudi, S.K.,Chhabra, M., Naik, G., Mousavi, S.M., Varkaneh, H.K., Clark, C. und Zhang, Y.(2019). Die Wirkung von Metformin auf Biomarker im Zusammenhang mit Brustkrebs überwindet: eine systematische Überprüfung, Meta-Analyse und Dosis–Wirkungs-Verhältnis von randomisierten klinischen Studien. Clin. In: Transl. Oncol.
Scatena, C., Roncella, M., Di Paolo, A., Aretini, P.,Menicagli, M., Fanelli, G., Marini, C., Mazzanti, C.M., Ghilli, M., Sotgia, F.,et al. (2018). Doxycyclin, ein Inhibitor der mitochondrialen Biogenese, reduziert effektiv Krebsstammzellen (CSCs) bei Brustkrebspatientinnen im Frühstadium: Eine klinische Pilotstudie. Front. Oncol. 8.
Seeger, H., Wallwiener, D. und Mueck, A.O. (2003).Statine können die Proliferation menschlicher Brustkrebszellen in vitro hemmen. Verwendbar bis.Clin. Endocrinol. Diabetes aus. J. Ger. Soc. Endocrinol. Ger. Diabetes Assoc.111, 47–48.
Skoda, J., Borankova, K., Jansson, PJ, Huang, MLH, Veselska, R. und Richardson, DR (2019). Pharmakologische targetingof Mitochondrien in Krebsstammzellen: Eine alte Organelle an der Kreuzung von novel Anti-Krebs-Therapien. Pharmacol. Entschließung 139, 298-313.
Schreiber, A., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., Schreiber, M., et al. (2017). Auswirkungen der Verwendung von Diabetes, Insulin und Metformin auf das Ergebnis von Patienten mit humanem epidermalem Wachstumsfaktorrezeptor 2–positivem primärem Brustkrebs: Analyse aus der randomisierten Phase-III-Studie ALTTO. J.Clin. Oncol. 35, 1421–1429.
Van Wyhe, R.D., Rahal, O.M., und Woodward, W.A.(2017). Wirkung von Statinen auf Brustkrebsrezidiv und Mortalität: eine Überprüfung.Brustkrebs zielt auf Ther. 9, 559–565.
Vazquez-Martin, A., Oliveras-Ferraros, C., Cufí, S.,Del Barco, S., Martin-Castillo, B., Lopez-Bonet, E. und Menendez, JA (2011).Das Antidiabetikum Metformin unterdrückt das metastasenassoziierte proteinCD24 in MDA-MB-468 dreifach negativen Brustkrebszellen. Oncol. Rep. 25,135–140.
Vintonenko, N., Jais, J.-P., Kassis, N., Abdelkarim,M., Perret, G.-Y., Lecouvey, M., Crepin, M. und Di Benedetto, M. (2012).Transkriptomanalyse und In-vivo-Aktivität von Fluvastatin im Vergleich zu Zoledronicacid in einem murinen Brustkrebs-Metastasenmodell. Mol. Pharmacol. 82, 521–528.
Wahdan-Alaswad, R.S., Cochrane, Dr., Spoelstra, N.S.,Howe, E.N., Edgerton, S.M., Anderson, S.M., Thor, A.D. und Richer, J.K.(2014). Metformin-induzierte Abtötung von dreifach negativen Brustkrebszellen wird durch Reduktion der Fettsäuresynthase über miRNA-193b. Horm vermittelt. Krebs 5,374–389.
Wang, Z.-S., Huang, H.-R., Zhang, L.-Y., Kim, S., Er,Y., Li, D.-L., Farischon, C., Zhang, K., Zheng, X., Du, Z.-Y., et al. (2017).Mechanistische Untersuchung der inhibitorischen Wirkungen von Metformin und Atorvastatin Inkombination auf Prostatakrebszellen in vitro und in Vivo. Biol. Pharm. Bull.40, 1247–1254.
Wolfe, A.R., Debeb, B.G., Lacerda, L., Larson, R.,Bambhroliya, A., Huang, X., Bertucci, F., Finetti, P., Birnbaum, D., Van Laere,S., et al. (2015). Simvastatin verhindert die dreifach negative Brustkrebsmetastase in präklinischen Modellen durch Regulation von FOXO3a. Behandeln. 154, 495–508.
Xu, H., Chen, K., Jia, X., Tian, Y., Dai, Y., Li, D.,Xie, J., Tao, M. und Mao, Y. (2015). Die Verwendung von Metformin ist mit einer Verbesserung verbundenüberleben von Brustkrebspatientinnen mit Diabetes: Eine Metaanalyse. Theonkologe 20, 1236-1244.
Yam, C., Esteva, F.J., Patel, M.M., Raghavendra, A.S.,Ueno, N.T., Moulder, S.L., Hess, K.R., Shroff, G.S., Hodge, S., König, K.H.,et al. (2019). Wirksamkeit und Sicherheit der Kombination von Metformin, Everolimus und Exemestan bei übergewichtigen und adipösen postmenopausalen Patienten mit metastasiertem, Hormonrezeptorpositivem, HER2-negativem Brustkrebs: eine Phase-II-Studie.Investieren. Neue Medikamente 37, 345-351.
Yao, H., He, G., Yan, S., Chen, C., Song, L., Rosol,T.J., und Deng, X. (2017). Dreifach negativer Brustkrebs: Gibt es eine Behandlungam Horizont? Onkotarget 8, 1913-1924.
Zhang, L., Guo, M., Li, J., Zheng, Y., Zhang, S., Xie,T. und Liu, B. (2015). Systembiologische Entdeckung eines potenziellen Atg4bagonisten (Flubendazol), der Autophagie bei Brustkrebs induziert. Mol. Biosyst.11, 2860–2866.
Zhang, L., Xu, L., Zhang, F. und Vlashi, E. (2017).Doxycyclin hemmt den Phänotyp der Krebsstammzellen und den Übergang von epithelial zu Mesenchym bei Brustkrebs. Zellzyklus Georget. Tex16, 737-745.
Zhang, L., Bochkur Dratver, M., Yazal, T., Dong, K.,Nguyen, A., Yu, G., Dao, A., Bochkur Dratver, M., Duhachek-Schwül, S., Bhat, K.,et al. (2019a). Mebendazol potenziert die Strahlentherapie bei Triple-negativbrustkrebs. Int. In : J. Radiat. Oncol. Biol. Phys. 103, 195–207.
Zhang, Y., Storr, S.J., Johnson, K., Grün, A.R.,Rakha, E.A., Ellis, I.O., Morgan, D.A.L. und Martin, S.G. (2014). Metformin und AMPK in der Radioresponse und Prognose von luminal versusbasal-like Brustkrebs mit Strahlentherapie behandelt. Oncotarget 5, 12936-12949.
Zhang, Z.-J., Yuan, J., Bi, Y., Wang, C., und Liu, Y.(2019b). Die Wirkung von Metformin auf Biomarker und Überlebensraten bei Brustkrebs – eine systematische Überprüfung und Metaanalyse randomisierter klinischer Studien. Pharmacol.141, 551-555.
Zhong, S., Zhang, X., Chen, L., Ma, T., Tang, J. und Zhao, J. (2015). Statinkonsum und Mortalität bei Krebspatienten: Systematische Überprüfung und Metaanalyse von Beobachtungsstudien. Krebs behandeln. Offenbarung 41, 554-567.
