The CoC Protocol™ in Breast Cancer
ten dokument jest streszczeniem uzasadnienia i niektórych aktualnych dowodów naukowych, które potwierdzają stosowanie leków z protokołem COC obok standardowych metod leczenia raka piersi. Rozumiemy, że rak jest bardzo osobistą chorobą, a każdy pacjent ma unikalny zestaw wyzwań. Aby uzyskać więcej informacji na temat własnej sytuacji osobistej, skontaktuj się z kliniką Onkologii Care pod numerem 800-392-1353 w Stanach Zjednoczonych lub odwiedź stronę internetową pod adresem https://careoncology.com.
Jeśli jesteś nowy w opiece onkologicznej, zwróć uwagę na następujące kwestie:
- nie musisz podróżować. Możesz spotkać się z naszym zespołem onkologów i pielęgniarek onkologicznych poprzez bezpieczne wideo do ciągłego wsparcia.
- leki care Oncology adjunct protocol są wysyłane bezpośrednio do domu z naszych amerykańskich aptek partnerskich i mogą być stosowane wraz ze standardowym leczeniem pielęgnacyjnym.
- z ogromną dumą ogłaszamy, że przeszliśmy niezwykle rygorystyczny proces walidacji Instytutu walidacji w zakresie analizy danych, wniosków o wyniki i obliczania wartości. Ciężko pracowaliśmy, aby dojść do tego punktu. Na początku dostrzegliśmy ogromną wartość odpowiedzialnie dostarczonego programu repurposed lekarstwa oferowanego pacjentom z chorobą nowotworową, jednak nie był on oferowany na dużą skalę. Cztery lata temu postanowiliśmy to zmienić wiedząc, że to był maraton, a nie sprint.
protokół COC i rak piersi: kluczowe punkty
- cocprotocol jest połączeniem czterech powszechnie przepisywanych leków(atorwastatyny, metforminy, mebendazolu i doksycykliny) z potencjalnym rakiem piersi i pomaga poprawić skuteczność standardowych leków przeciwnowotworowych.
- wiele badań obserwacyjnych powiązało stosowanie metforminy lub statyny z poprawą wyników u pacjentek z rakiem piersi.
- badania laboratoryjne nad komórkami raka piersi hodowanymi w naczyniach pokazują, że metformina i statynastępują bezpośrednio na komórki raka piersi i uszkadzają je – osłabiając je i czyniąc je bardziej podatnymi na standardowe leczenie.
- Wyniki z małych „okienek możliwości” badań klinicznych u pacjentów z operacyjnym rakiem piersi zazwyczaj pokazują, że przyjmowanie metforminy lub statyny przed operacją może prowadzić do potencjalnie pozytywnych zmian w markerach molekularnych raka, w tym tych, które regulują wzrost i podział komórek raka piersi. Trwają dalsze badania, jeśli metformina lub statyny mogą wpływać na odpowiedź choroby.
- wzrost bloku Doksycyklinekanu zarówno HER2 dodatnich, jak i potrójnie ujemnych komórek macierzystych raka piersi inkubowanych w naczyniach w laboratorium i pomógł poprawić zmiany związane z opornością wywołane standardową chemioterapią paklitakselem.
- Doksycyklina właśnie dotarła do wczesnych badań klinicznych u pacjentów z rakiem piersi. Wyniki pierwszego niewielkiego badania pokazują, że pacjentki z rakiem piersi we wczesnym stadium, którzywyjęły doksycyklinę przez zaledwie 14 dni przed operacją, zmniejszyły poziom markerów molekularnych obecności komórek macierzystych raka średnio o około 40%. Korzystne efekty odnotowano u wszystkich leczonych pacjentów z wyjątkiem jednego(8/9).
- Mebendazolekan spowalnia wzrost i podział komórek raka piersi hodowanych w laboratorium, w tym komórek raka piersi, które są bardziej odporne na chemioterapię. Potrzebne są bardziej ludzkie badania.
protokół COC a rak piersi: Opublikowane dowody
protokół CoC to połączenie reżimu czterech powszechnie przepisywanych leków,z których każdy ma dowody na aktywność przeciwnowotworową opartą na metabolizmie i dobre profile bezpieczeństwa. Leki te są: metformina, atorwastatyna, doksycyklina i mebendazol. Poniżej przedstawiono niektóre z badań, które wspierają stosowanie protokołu CoC jako terapii wspomagającej obok aktualnych standardowych metod leczenia raka piersi. Dowody te pochodzą głównie z badań laboratoryjnych, dużych badań epidemiologicznych (które badają związki między przyjmowaniem leków a wynikami raka piersi w grupach osób) oraz wczesnych badań klinicznych.
możesz zauważyć, że wiele z poniższych badań koncentruje się tylko na indywidualnych protokołach COC. Jako pierwsi zaprojektowaliśmy terapię wspomagającą, która łączy w sobie allfour. Wierzymy, że połączenie tych leków osiągnie najwspanialsze rezultaty, a nasz własny program badawczy, zwany METRICS, już teraz dostarcza więcej dowodów potrzebnych do wykazania tego. Możesz przeczytać więcej o tym, dlaczego uważamy, że te leki tak dobrze ze sobą współpracują, aby pomóc w zwalczaniu raka, oraz o samym programie tematycznym, w dalszych sekcjach poniżej.
metformina i rak piersi
Metforminuse związane z potencjalnymi korzyściami z raka piersi
wiele badań obserwacyjnych dostarcza obecnie dowodów potwierdzających stosowanie metforminy w raku wsobnym. Metformina jest dopuszczona do leczenia cukrzycy typu 2, a badania prowadzone w grupach pacjentów z cukrzycą wykazują tendencję do wykazywania, że ci, którzy przyjmują metforminę, mają większe szanse na poprawę wyników w przypadku rozwinięcia raka piersi(Aksoy et al., 2013; El-Benhawy and El-Sheredy, 2014; Sonnenblick et al., 2017).Stosowanie metforminy było związane z poprawą przeżycia pacjentów z rakiem piersi (Kim i wsp., 2015; Xuet al., 2015), poprawiona odpowiedź na leczenie raka piersi (Jiralerspong et al., 2009), a mniejsze szanse na rozprzestrzenianie się raka piersi (Chen et al., 2017; Jacob et al., 2016).
jest prawdopodobne, że korzystny wpływ metforminy stwierdzony w tych badaniach wynika ze zdolności metforminy do poprawy cukrzycy i / lub masy ciała pacjenta poprzez zmniejszenie poziomu glukozy, co może pomóc zmniejszyć ryzyko zachorowania na raka piersi,a także poprawić zdrowie pacjenta i zdolność do walki z rakiem piersi, jeśli go wystąpią (Hatoum and McGowan, 2015). Ale badania laboratoryjne pokazują również, że metformina czyni więcej niż to. W rzeczywistości metformina może aktywnie działać bezpośrednio przeciwko komórkom rakowym, zmniejszając ich zdolność do pobierania i wykorzystywania energii oraz blokując ich zdolność do wzrostu, rozprzestrzeniania się, przetrwania i nawrotu choroby (Alimova et al., 2009; Hadad et al., 2014; Orecchioni et al., 2015).
Różnytypy raka piersi wymagają różnych metod leczenia. Na przykład Trastuzumab jest specjalnie stosowany w leczeniu raka piersi z receptorem 2 ludzkiego naskórkowego czynnika wzrostu (HER2). Tamoksyfen jest skuteczny przeciwko dodatniemu rakowi piersi receptora estrogenowego (ER). Co ważne, badania na komórkach nowotworowych w laboratorium wykazały, że metformina ma działanie przeciwnowotworowe przeciwko wielu różnym rodzajom komórek raka piersi, w tym ER dodatnim (Giles et al., 2018), HER2 positive (Chen et al., 2013), andpotencjalnie trudniejsze w leczeniu podtypów, takich jak potrójnie ujemne komórki nowotworowe (Deng et al., 2012;Vazquez-Martin et al., 2011; Wahdan-Alaswad et al., 2014).Oznacza to, że metformina może skutecznie działać wraz ze standardowymi lekami na raka piersi, niezależnie od podtypu raka.
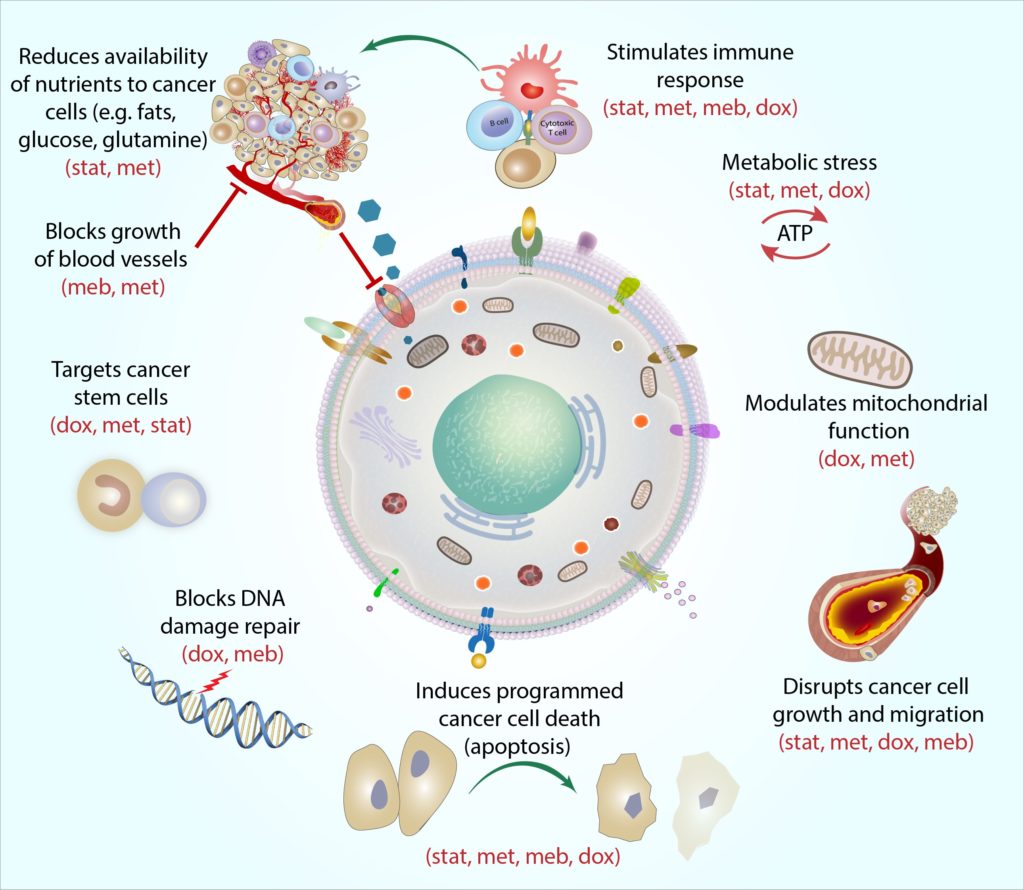
Metformintargety komórki macierzyste raka piersi
metforminy również wykazano, że celują w komórki macierzyste raka piersi (Bao et al., 2014; Cufiet al., 2012; Hirsch et al., 2009).Ta aktywność przeciwko komórkom macierzystym raka piersi, wraz z jego zdolnością doodbierać różne podtypy raka piersi, pomagają wyjaśnić, dlaczego badania laboratoryjne, jak to może działać w połączeniu z wieloma standardowymi zabiegami, w tym trastuzumabem (Cufi et al., 2012), tamoksyfen (Ma et al., 2014), oraz standardowe środki chemioterapii (Iliopoulos et al.,2011). Badania na zwierzętach i komórkach pokazują, że metformina zarówno pomaga poprawić skuteczność standardowych metod leczenia (Bradford and Khan, 2013; Liu et al., 2012; Zhang et al., 2014) oraz opóźnia nawrót nowotworów, które były leczone tymi terapiami (Iliopoulos et al.,2011).
ponadto badania laboratoryjne pokazują, że metformina może również pomóc w zapobieganiu oporności komórek raka piersi na chemioterapię i poprawić wrażliwość już opornych komórek nowotworowych na leczenie (Davies et al., 2017).
Metforminipoprawia markery raka piersi we wczesnych badaniach klinicznych
w wyniku dużej ilości danych wspomagających dla metforminy w raku piersizagrożonych badaniami obserwacyjnymi i laboratoryjnymi, obecnie trwają różne badania kliniczne w celu zbadania metforminy w raku piersi (Camacho et al., 2015).Ogólnie rzecz biorąc, zbiorowe analizy wyników tych wczesnych badań (metaanaliza) zaczynają sugerować ogólnie pozytywny efekt, gdy metaformina jest dodawana do standardowych terapii nowotworowych (Rahmani etal., 2019; Zhang et al., 2019b).
wiele badań „okienka możliwości” bada, czy przyjmowanie Metformin przez około dwa tygodnie przed operacją może pomóc w poprawie markerów molekularnych choroby u pacjentek z operatywnym rakiem piersi we wczesnym stadium. Wyniki tych badań na ogół sugerują, że przyjmowanie metforminy może prowadzić do potencjalnie pozytywnych zmian w markerach molekularnych raka, w tym tych, które regulują wzrost i podział komórek nowotworowych (Bonanni et al., 2012;Cazzaniga et al., 2013; Hadad et al., 2011; Kalinsky et al., 2014; Niraula etal., 2012), a także potencjalnie poprawę regulacji hormonów i innych czynników u niektórych pacjentów (Kalinsky et al., 2014; Niraula et al., 2012). Badania te są obecnie pomocne naukowcom zrozumieć dokładnie, w jaki sposób i kiedy metformina może pomocapacjenci z rakiem piersi (Bonanni etal., 2012; DeCensi et al., 2014, 2015; Rahmani et al., 2019).
badania Neoadjuwantowe Fazy 2 są na ogół dłuższymi i bardziej złożonymi badaniami, w których bada się metforminę wraz z kursami standardowych metod leczenia różnych typów raka piersi. Celem tych badań jest ustalenie, czy ifmetformin naprawdę pomaga poprawić skuteczność standardowych metod leczenia, jak sugerują badania Lab (Kim et al., 2014). Inone recent study (badanie METTENA) (Martin-Castillo etal., 2018), u kobiet z HER2 dodatnim wczesnym stadium raka piersi, więcej pacjentów przyjmujących metforminę dobrze zareagowało na chemioterapię/docelowe leczenie (65,5%) w porównaniu do pacjentów nie przyjmujących metforminy (58,6%). Różnica ta nie była statystycznie istotna, co oznacza, że wynik ten mógł zostać osiągnięty przez przypadek. Jednak badania fazy 2 są na ogół niedostateczne w celu osiągnięcia istotności statystycznej w ten sposób, a badacze nazywają postęp do większych badań fazy 3, które mogą być odpowiednio zaprojektowane, aby określić, jak realny jest ten efekt (Martin-Castillo etal., 2018). Potencjalnie zachęcające wyniki z innych fazy 2trials, takich jak jeden u osób z nadwagą z przerzutowym rakiem piersi odnotowano również (Yam et al.,2019). Warto również zauważyć, że zgodnie z oczekiwaniami nie wszystkie badania nad rakiem Metformin wykazały pozytywne wyniki. Na przykład w innych badaniach fazy 2 wykazano, że metformina w standardowym leczeniu nie miała rzeczywistej różnicy w porównaniu ze standardowym leczeniem w pewnych okolicznościach (Mark i wsp ., 2019; Nanni et al., 2019). Wierzymy, żemetformina będzie najbardziej skuteczna w każdym otoczeniu, gdy będzie podawana w połączeniu z innymi lekami przeciw metabolizmowi.
aby pomóc w rozwiązaniu tych problemów, potrzebne są większe badania, a obecnie trwa badanie fazy 3 mające na celu zbadanie metforminy w raku piersi. Chociaż badanie ma zostać zakończone dopiero w 2020 r., wstępne wyniki z pierwszych 6 miesięcy badania wykazały, że pacjenci, którzy rozpoczęli przyjmowanie metforminy natychmiast po zakończeniu operacji i standardowych cykli chemioterapii, mieli korzystne zmiany w markerze molekularnym raka piersi(Dowling et al., 2018) i ulepszone czynniki metaboliczne (Goodwin et al., 2015).
statyny i rak piersi
badania obserwacyjne łączą statyny, aby uzyskać lepsze wyniki raka piersi
statyny są zwykle podawane, aby pomóc w leczeniu chorób sercowo-naczyniowych. Jednak badania obserwacyjne na dużych grupach osób przyjmujących statyny wykazały również, żeindywidualne osoby z rakiem piersi, które przyjmują statyny, mogą również zmniejszyć ryzyko nawracającego raka po leczeniu, w porównaniu z pacjentami, którzy nie przyjmują statyn(Ahern et al., 2014; Manthravadi et al., 2016). Na przykład, w onestudy w prawie 2000 osób, które przeżyły raka piersi, ci, którzy zaczęli takingstains w ciągu trzech lat po diagnozie miał zmniejszoną szansę na ich raka z powrotem (Kwan et al., 2008). W innym badaniu zaledwie 6 miesięcy stosowania statyn po rozpoznaniu było związane z poprawą częstości nawrotów (Chae et al., 2011).
co ważne,korzystny wpływ statyn w tych i innych badaniach był silniej powiązany z bardziej rozpuszczalnymi w tłuszczach „lipofilowymi” statynami (takimi jak Atorwastatyna). W niektórych badaniach laboratoryjnych wykazano również, że lipofilowe statyny mają działanie superioranticancer na poziomie komórkowym w porównaniu do mniej rozpuszczalnych w tłuszczach statyn (Liu i wsp ., 2017).
badania obserwacyjne również łączą stosowanie statyny z poprawą odpowiedzi na leczenie i przystawki u pacjentów z rakiem piersi, nawet u pacjentów z rakiem piersi, które mogą być bardziej agresywne (Manthravadi i wsp., 2016; Murtola et al., 2014; Zhong et al., 2015). Na przykład, w jednym badaniu z udziałem pacjentek z zapalnym rakiem piersi, pacjentki przyjmujące atorwastatynę podczas leczenia raka miały dłuższy okres czasu przed postępem choroby, w porównaniu z pacjentami, którzy nie przyjmowali statyn (Brewer i wsp., 2013).
Statinstarget breast cancer cells
statyny,szczególnie rozpuszczalne w tłuszczach lipofilowe statyny, takie jak Atorwastatyna, zmniejszają wzrost i podział komórek raka piersi i zwiększają śmierć komórek raka piersi w badaniach laboratoryjnych
German Diabetes Association”,”page”:”47-48″,”volume”:”111″,”issue”:”1″,”source”:”PubMed”,”abstract”:”Theeffect of five statins, tj. atorwastatyna, fluwastatyna, Lowastatyna, prawastatyna i symwastatyna były badane pod kątem proliferacji linii komórek raka piersi u ludzi MCF-7. Wszystkie statyny z wyjątkiem prawastatyny były w stanie hamować proliferację komórek do 90% przy stężeniu 50 mikro M. pomiędzy skutecznymi statynami nie zaobserwowano znaczącej różnicy wskazującej na działanie specyficzne dla szkła. Dane te sugerują, że statyny mogą mieć kliniczne znaczenie w zapobieganiu pierwotnemu rakowi piersi u ludzi poza działaniem obniżającym poziom cholesterolu. Jednakże przed podjęciem dalszych decyzji należy oczekiwać dowodu klinicznego.”, „DOI”:”10.1055/s-2003-37501″,”ISSN”:”0947-7349″,”note”:”PMID:12605351″,”journalAbbreviation”: „Exp. Clin. Endokrynol.Cukrzyca”,”language”:”eng”,”author”:,”issued”:{„date-parts”:]}}},”schema”:”https://github.com/citation-style-language/schema/raw/master/csl-citation.json”}(Alarcon Martinez etal., 2018; Mück et al., 2004; Seeger et al., 2003).Badania pokazują również, że statyny mogą potencjalnie blokować inwazyjność komórek raka piersi w laboratorium, co sugeruje, że mogą również pomóc w powolnym rozprzestrzenianiu się raka w innych częściach ciała(Kanugula et al., 2014; Wolfe et al., 2015). W mysim modelu przerzutowego raka piersi, statyterapia opóźniła wzrost raka, który już się rozprzestrzenił nawet o 80%, z korzystną aktywnością odnotowaną w ciągu tygodnia od rozpoczęcia leczenia(Vintonenko et al.,2012).
inne badania pokazują również, że statyny mogą pomóc uwrażliwić komórki raka piersi na standardowe zabiegi radioterapii i chemioterapii (Kozar et al., 2004; Van Wyhe et al., 2017). Jedno z badań wykazało, żesimwastatyna może uczulać potrójnie ujemne lub zapalne komórki raka piersi na radioterapię w laboratorium. W tym samym badaniu zaobserwowano u pacjentkiopulacja, że kobiety z zapalnym rakiem piersi, które przyjmowały statyny podczas ich leczenia, miały mniejsze szanse na nawrót raka w ciągu 3 lat(Lacerda et al., 2014).
podobnie jak metformina, statyny mogą wywoływać te działanie przeciwnowotworowe w różnych typach raka piersi, w tym w raku ER dodatnim, HER2 dodatnim i raku potrójnie ujemnym. W rzeczywistości niektóre badania laboratoryjne pokazują, że statyny są szczególnie skuteczneagainst potrójnie ujemne komórki raka piersi(Campbell et al., 2006; Yao et al., 2017).
trwają badania kliniczne nad statynami w raku piersi
nieliczne badania kliniczne wykazują obecnie zdecydowanie pozytywne wyniki pod względem statyn w raku piersi. Badania wczesnej fazy „window of opportunity” zostały zbadane, jeśli wczesne, przedoperacyjne statyny mogą pomóc w poprawie molekularnych markerów choroby u pacjentów z operatywną chorobą. Do tej pory badania te wykazały poprawę profilu molekularnego raka u pacjentów leczonych statynami, co sugeruje, że atorwastatyna i inne statyny w tym kontekście mogą mieć korzystny wpływ na wzrost i podział komórek nowotworowych oraz śmierć komórek, nawet u kobiet z bardziej agresywnymi guzami o wysokim stopniu złośliwości(Bjarnadottir et al., 2013, 2015; Feldt et al., 2015; Garwood et al., 2010).
w oparciu o te obiecujące wyniki, prowadzone są obecnie badania II Fazy badające statyny zapobiegające powstawaniu różnych rodzajów raka piersi, w tym raka piersi o trzech ujemnych wynikach. Badania te powinny pomóc w ustaleniu, w jaki sposób statyny mogą pomóc pacjentom z rakiem piersi.
Mebendazol i rak piersi
zainteresowanie mebendazolem potencjalnym leczeniem przeciwnowotworowym opiera się głównie na obiecujących mechanistycznych badaniach i przekonujących raportach ze studiów przypadków u pacjentów z rakiem (Nygren and Larsson,2014; Pantziarka et al., 2014).
Mebendazole uważa się, że zabija komórki nowotworowe częściowo przez zakłócenie specjalnych struktur wewnątrz komórki, zwanych mikrotubulami (Pantziarka et al.,2014). Działa w podobny sposób jak winkrystyna, lek do achemoterapii obecnie stosowany w leczeniu niektórych rodzajów raka, w tym zaawansowanego raka piersi (De Witt et al., 2017).
badania w komórkach raka piersi hodowanych w laboratorium pokazują, że mebendazol i powiązane leki z tej samej klasy (zwane benzimidazolami) mogą spowolnić wzrost i podział kilku różnych typów komórek raka piersi, w tym komórek opornych na chemioterapię (Coyne et al., 2013; Hou et al., 2015; Mukhopadhyay et al., 2002). W jednym badaniu mebendazol silnie zmniejszał przeżywalność komórek nowotworowych odpornych na chemioterapię aż o 63,1% (Coyne i wsp ., 2013).Badania wykazały również silne działanie przeciwnowotworowe benzimidazolazagainst potrójnie ujemnego raka piersi(Hou i wsp ., 2015; Zhang et al., 2015). Co ważne, w jednym z badań benzimidazol był również ukierunkowany bezpośrednio na komórki macierzyste raka piersi(Hou et al., 2015).
pojawiające się dowody laboratoryjne sugerują również, że benzimidazole mogą zwiększać aktywność standardowych metod leczenia raka piersi, takich jak doksorubicyna i fluorouracyl (Hou et al., 2015). W jednym badaniu laboratoryjnym mebendazol zwiększył skuteczność radioterapii na nieoperacyjnych komórkach raka piersi i zapobiegł rozwojowi oporności na leczenie (Zhang et al., 2019a). Ponadto seria badań wykorzystujących oporne na chemioterapię er / HER2 dodatnie komórki raka piersi hodowane w laboratorium, konsekwentnie wykazywały, że mebendazol nie tylko zmniejszał przeżywalność komórek nowotworowych, ale także pomagał uzupełniać i zwiększać aktywność specjalnie opracowanych form chemioterapii raka piersi epirubicyna i gemcytabina (Coyne et al., 2014,2012, 2013).
doksycyklina i rak piersi
jako skuteczny antybiotyk, doksycyklina posiada również inne niezwykle cenne właściwości, w tym działanie przeciwzapalne i przeciwnowotworowe. Daje to doksycyklinę prawdziwy potencjał terapeutyczny w leczeniu szeregu innych chorób, w tym raka (Bahrami et al., 2012).
badania laboratoryjne i badania na zwierzętach od dawna wykazały, że doksycyklina może blokować wzrost komórek raka piersi, podział i ruch (Duivenvoorden et al., 2002; Fife and Sledge, 1995, 1998).Nowsze badania pokazują również, że doksycyklina może powstrzymać komórki nowotworowe przed odbudową DNA, gdy zostanie uszkodzone, na przykład, przez chemioterapię (Peiris-Pagès et al.,2015). Rzeczywiście, badania laboratoryjne pokazują, że doksycyklina może pomóc poprawić skuteczność działania chemioterapii przeciwko komórkom raka piersi(Foroodi et al., 2009; Lamb et al., 2015a).
najchętniej skupiono się na zrozumieniu, w jaki sposób doksycyklina może blokować wzrost komórek macierzystych raka piersi (Ozsvari etal., 2017; Zhang et al., 2017). Niedawne badania Avery na komórkach hodowanych w laboratorium wykazały, że doksycyklina może blokować wzrost zarówno HER2 dodatnich, jak i potrójnie ujemnych komórek macierzystych raka piersi i pomogła poprawić zmiany związane z opornością wywołane standardową chemioterapią paklitakselem (Lin et al.,2018). W innym badaniu laboratoryjnym, kombinatoryczne podejście, w tym doksycyklina bardzo skutecznie zwalcza komórki macierzyste raka piersi (Fiorillo etal., 2019).
Doksycyklina właśnie dotarła do wczesnych badań klinicznych u pacjentów z rakiem piersi. Wyniki pierwszego małego badania, opublikowanego w październiku 2018 r., pokazują, że pacjentki z rakiem piersi w stadium zaawansowania, które przyjmowały doksycyklinę przez zaledwie 14 dni przed zabiegiem chirurgicznym, zmniejszyły poziom markerów molekularnych na obecność komórek macierzystych raka średnio o około 40%. Korzystne efekty odnotowano u wszystkich leczonych pacjentów z wyjątkiem jednego (8/9) (Scatena i wsp., 2018).Obecnie trwają większe badania kliniczne.
nasze własne dowody: badanie metryki
Co to jest metryka?
METRICS to nasz własny, wewnętrzny program badawczy. Wiele już wiadomo na temat bezpieczeństwa iskuteczności leków protokołu COC w raku. Ale jest również naszą odpowiedzialnością, aby przyznać, że nie mamy wszystkich odpowiedzi i że westill musi generować dobrej jakości badania kliniczne badające COCProtocol u pacjentów z rakiem, aby zapewnić, że protokół COC jest tak skuteczny i bezpieczny, jak to tylko możliwe.
aby umożliwić nam sfinansowanie tego badania, opracowaliśmy nowatorski, przystępny cenowo system, w którym nasze badania kliniczne, metryki, są zasadniczo „finansowane przez pacjentów”. Każdy chętny pacjent, który wchodzi do kliniki, jest zapisany w metrykach, a te opłaty pomagają sfinansować badanie. Jest to nowy model badań klinicznych, mający na celu pomostowanie luk w finansowaniu i danych, które obecnie utrudniają ponowne zastosowanie i dalszy rozwój kliniczny leków już licencjonowanych.
METRICS pierwsze wyniki
w pierwszej formie sukcesu wyniki naszych wstępnych badań pilotażowych zostały niedawno opublikowane w recenzowanym czasopiśmie naukowym Frontiers in Pharmacology. Papier można uzyskać bezpłatny dostęp online tutaj.
badanie pilotażowe METRICS było retrospektywnym badaniem obserwacyjnym, co oznacza, że nasi naukowcy spojrzeli Wstecz i przeanalizowali zapisy kliniczne pacjentów, aby dowiedzieć się, co się stało. Zebrali dane i zarejestrowali wyniki od 95 pacjentów z zaawansowanym typem raka mózgu zwanym glejakiem, którzy uczęszczali do Kliniki Onkologii Care i którzy zapoznali się z pełnym protokołem COC wraz ze zwykłymi standardowymi zabiegami. Badanie to nie miało grupy kontrolnej, więc nasi naukowcy porównali wyniki z metryk z wcześniej opublikowanymi wynikami wcześniejszych badań u pacjentów z tym samym typem raka, którzy również przyjmowali standardowe zabiegi pielęgnacyjne.
wstępne wyniki sugerują, żepacjenci, którzy uczęszczali do naszej kliniki i stosowali protokół COC jako część ich opieki, byli znacznie bardziej narażeni na przetrwanie co najmniej 2 lat (64.0% pacjentów w naszym badaniu przeżyło co najmniej 2 lata, w porównaniu do 27-29% pacjentów włączonych do wcześniej opublikowanych badań) i ogólnie miały tendencję do dłuższego czasu przeżycia niż zwykle można by się spodziewać u pacjentów z tym typem raka (pacjenci przeżyli średnio 27 miesięcy w naszym badaniu, w porównaniu do 15-16 miesięcy we wcześniejszych badaniach)(Agrawalet al., 2019).
te wyniki są niezwykle obiecujące, ale nadal są wstępne. Nie wiemy jeszcze dokładnie, w jaki sposób protokół COC może mieć wpływ na przykład na czas przeżycia lub w jaki sposób inne czynniki, takie jak pewne cechy pacjentów, mogły również wpłynąć na wyniki. Ale ten pierwszy, początkowy dowód jest z pewnością zachęcający i utwierdza nas w przekonaniu, że zmierzamy we właściwym kierunku. Naszym następnym zaplanowanym etapem jest przeprowadzenie większego, dobrze zaprojektowanego badania. Możesz dowiedzieć się więcej o przyszłych planach metrycznych, szukając online lub kontaktując się z kliniką.
więcej o protokole COC
co to jest protokół COC?
protokół COC jest schematem leczenia skojarzonego składającym się z licencjonowanych leków, specjalnie opracowanych przez Care Oncology do stosowania wspomagającego wraz z zwykłymi leczeniem pacjenta (tj. standardem opieki).
cztery leki zawarte w schemacie protokołu COC to: metformina, avery wspólny lek przeciwcukrzycowy; atorwastatyna, rodzaj statyny stosowany w chorobach sercowo-naczyniowych; doksycyklina, rodzaj antybiotykuczęsto stosowany w leczeniu przewlekłych infekcji, takich jak trądzik; i mebendazol, amedycyna powszechnie stosowana w leczeniu zakażeń pasożytami u dzieci i dorosłych.
wybraliśmy te 4medycje spośród tysięcy potencjalnych kandydatów, specjalnie ze względu na nasze z góry ustalone kryteria selekcji. Kryteria te obejmują solidne dowody skuteczności w walce z rakiem, spójny mechanizm działania oraz, co ważne, dobry profil bezpieczeństwa. Te trzy główne założenia ukształtowały nasze podejście od samego początku.
bezpieczeństwo jest najważniejsze
rak jest chorobą złożoną z kompleksowymi metodami leczenia i uważamy, że dodatkowe terapie obok standardowych metod leczenia powinny być bardzo starannie oceniane. Nie tylko z punktu widzenia skuteczności, ale także, co ważne, pod względem bezpieczeństwa. Dlatego całe nasze podejście opiera się na dowodach-głównie publikowanych badaniach naukowych, a także, coraz częściej, na własnych danych.
wiele różnych leków dostępnych na rynku ma co najmniej kilka opublikowanych dowodów potwierdzających ich stosunkowo skuteczne stosowanie w raku, ale niewiele z tych leków ma dowody zarówno bezpieczeństwa, jak i skuteczności, które wymagały protokołu COC. Istnieją już duże ilości szczegółowych danych dla każdego z leków protokołowych, pozyskanych z lat stosowania w ogólnej populacji-i to pomogło nam zapewnić kluczową przewagę podczas rozwoju.
skrupulatnie przeszukaliśmy dziesiątki lat opublikowanych danych na temat każdego z leków objętych protokołem CoC, badając, jak działają one w różnych populacjach pacjentów (w tym pacjentów z rakiem) oraz na modelach komórkowych i zwierzęcych w laboratorium. Dane te, wraz z naszym własnym doświadczeniem klinicznym, pomagają zapewnić, że mamy dobre zrozumienie tego, jak te leki będą zachowywać się u pacjentów z różnymi stadiami i rodzajami raka, zarówno w połączeniu ze sobą, jak i w połączeniu z wieloma innymi terapiami przeciwnowotworowymi. Ta wiedza jest ogromna, a z naszych badań wynika, że tego rodzaju dowody nie istnieją jeszcze w przypadku wielu innych kandydatów na leki przeciwnowotworowe-szczególnie w przypadku inkombinacji.
terapia Anantymetaboliczna, która może potencjalnie dotyczyć każdego raka
protokół COC jest zaprojektowany do działania poprzez ograniczenie ogólnej zdolności komórek nowotworowych do pobierania i wykorzystywania (tj. „metabolizowania”) energii.
komórki nowotworowe potrzebują ogromnych ilości energii, aby przetrwać, a zdecydowana większość nowotworów wykorzystuje proces adaptacyjny zwany glikolizą tlenową do generowania nadmiernej energii, której potrzebują (Kroemer andPouyssegur, 2008). Każdy z leków w protokole może celowaćróżne molekularne procesy metaboliczne zaangażowane w i otaczającą aerobikglykolizę, a to może pomóc obniżyć ogólne tempo metabolizmu komórki nowotworowej(Jang et al.,2013).
wierzymy, że leki COCProtocol mogą działać w połączeniu, aby konsekwentnie ograniczać dostarczanie energii i stosowanie, jednocześnie zapobiegając adaptacji i wykorzystaniu innych ścieżek do pobierania energii przez komórki nowotworowe (Jagust et al.,2019). W rezultacie komórki nowotworowe stają się coraz słabsze i mniej zdolne do przyjmowania i wykorzystywania składników odżywczych (np. takich jak glukoza i niezbędne aminokwasy glutamina i arginina), których potrzebują ze swojego otoczenia (Andrzejewski al., 2018; Liu et al., 2016).To sprawia, że trudniej ogólnie dla komórek nowotworowych przetrwać, rosnąć i rozprzestrzeniać się w organizmie. Stopniowo osłabione komórki (w tym bardziej odporne i previously komórki odporne na leczenie) stają się bardziej podatne na atak z innych terapii nowotworowych zabijających komórki, takich jak radioterapia,chemioterapia, terapia hormonalna i terapie celowane (Bradford andKhan, 2013; Chen et al., 2012; Lacerda et al., 2014; Lamb et al., 2015a; Pantziarka et al., 2014).
kierując się dostosowanymi mechanizmami metabolicznymi, które są wspólne dla większości nowotworów (ale zazwyczaj nie zdrowych komórek), uważamy, że protokół COC może być skuteczny i selektywny dla praktycznie każdego raka, niezależnie od konkretnego typu, stadium lub lokalizacji raka. Opublikowane badania epidemiologiczne i laboratoryjne zwiększają potencjalnie szeroki zakres tej terapii(Chae et al., 2015, 2016; Iliopoulos et al., 2011; Lamb et al., 2015b; Pantziarka et al.,2014).
Mechanistyczna koherencja w działaniu – Siła kombinacji
prawdziwa siła protokołu CoC leży w specyficznej kombinacji leków, których używamy. Opracowano protokół nie tylko jako schemat czterech indywidualnych zabiegów każdy z aktywnością przeciwnowotworową, ale także do pracy jako pojedyncze leczenie skojarzone – z potencjałem do wytworzenia potężnych efektów synergicznych (Mokhtari et al., 2017).
każda z leków zawartych w protokole COC w sposób wyraźny i uzupełniający celuje w metabolizm komórek nowotworowych, a działanie to nazwaliśmy „mechanistyczną koherencją”. Mówiąc najprościej, mechanistyczna koherencja opisuje, w jaki sposób każdy lek może atakować komórkę raka pod innym kątem. Na przykład, komórki macierzyste raka są wyjątkowo odporne typu komórek nowotworowych, a każdy lek celuje te komórki w inny sposób: metformina celuje w „baterie” komórki (zwane mitochondriami), bardzo utrudniając mitochondriom prowadzenie reakcji molekularnych, których potrzebują do produkcji energii, doksycyklina blokuje komórki-DNAmachinery, które mitochondria muszą replikować i naprawiać (Skoda et al., 2019), statinscan zmienia ekspresję genu komórek macierzystych raka, czyniąc komórki bardziej wrażliwymi na inne terapie nowotworowe (Kodach et al., 2011), andmebendazol może przerwać liczne procesy molekularne zaangażowane w podział komórek, aby pomóc blokować wzrost komórek macierzystych raka (Hothi et al., 2012; Hou et al., 2015).
poprzez połączenie wszystkich czterech czynników, protokół COC może uderzyć w komórki macierzyste raka (i inne komórki nowotworowe) w wiele „słabych punktów”, i jak cios jeden-dwa, powoduje to, że komórki są mniej zdolne do uniku i powrotu do zdrowia.
badania laboratoryjne zaczynają podkreślać skuteczność tego podejścia przy użyciu kombinacji leków COCprotocol. W jednym z badań mechanistycznych połączenie statyny i metforminy znacznie zmniejszyło wzrost komórek raka prostaty bardziej niż sam środek (Wang et al., 2017). Badania obserwacyjne wykazały również potencjalnie „synergiczne” działanie tych leków na różne nowotwory (Babcook etal., 2014; Danzig et al., 2015; Lehman et al., 2012; Nimako et al., 2017). Badanie kliniczne badające metforminę i doksycyklinę w raku piersi jest już prowadzone (nct02874430), a nasz własny program badawczy, METRICS, również zaczyna opracowywać obiecujące dane.
długotrwała terapia wspomagająca
protokół COC jest przede wszystkim zaprojektowany jako długoterminowa terapia wspomagająca, aby pomóc zoptymalizować standardowe metody leczenia. Jednakże, ponieważ leczenie metaboliczne Kokprotokolem ma być prowadzone długotrwale, pacjenci mogą również przyjąć protokół jako system podtrzymujący po zakończeniu standardowego leczenia lub podczas przerw z leczenia standardowego oraz jako część długoterminowej strategii mającej na celu złagodzenie ryzyka nawrotu lub przerzutów. Z tego powodu warto również zauważyć, że każdy z leków protokołu COC zgłosił również korzystne mechanizmy działania w raku, które nie są zależne od jednoczesnego podawania standardowych leków i które mogą niezależnie pomóc zmniejszyć ryzyko nawrotu i rozprzestrzeniania się raka.
model opieki onkologicznej
aktywny nadzór medyczny nad każdym pacjentem
chociaż leki COCProtocol są bezpiecznie stosowane w populacji ogólnej od wielu lat, każdy pacjent, który do nas przychodzi, jest wyjątkowy. Dlatego każdy pacjent, który opiekuje się kliniką opieki onkologicznej, znajduje się pod bezpośrednią opieką lekarzy ze specjalistyczną wiedzą na temat przepisywania leków w protokole COC w związku z chorobą nowotworową. Nasi lekarze indywidualnie oceniają potencjalne korzyści i ryzyko związane z przyjęciem protokołu COC u każdego pacjenta. Zalecają pacjentom protokół COC tylko wtedy, gdy uważają, że będzie to bezpieczne i korzystne. Każda recepta na protokół COC jest dostosowana do potrzeb pacjenta, a dawki i schematy są dokładnie sprawdzane i dostosowywane w zależności od postępów pacjenta.
dlatego ważne jest, aby pacjenci przyjmowali protokół COC tylko podczas starannego monitorowania w naszej klinice przez czas ich leczenia.
*********************************************************************************
ważna informacja
cel tego artykułu
artykuł ten jest przeglądem niektórych opublikowanych naukowo-medycznychliteratur dotyczących leków, które zawierają opatentowany Care Oncologyprotocol. Dołożono starań, aby wybrać odpowiednie artykuły wspierające stosowanie tych leków na etykiecie w warunkach klinicznych do wspomagającego leczenia raka. Ten artykuł nie ma być kompleksowym przeglądem wszystkich dowodów, ani nie wychwytuje wszystkich potencjalnych skutków ubocznych takiego leczenia.
niniejszy artykuł ma charakter wyłącznie informacyjny i nie stanowi porady medycznej. Leki omawiane w niniejszym dokumencie są dostępne wyłącznie na receptę i nie powinny być przyjmowane bez konsultacji z lekarzem lub innym profesjonalnym dostawcą usług zdrowotnych. Lekarze Care Oncology omówią z Tobą przydatność tych leków i skontaktują się z lekarzem lub onkologiem, aby ustalić ich przydatność dla Ciebie.
nie musisz polegać na informacjach zawartych w tym artykule jako alternatywy dla porady medycznej od lekarza lub innego profesjonalnego dostawcy opieki zdrowotnej. Jeśli masz jakieś konkretne pytania dotyczące jakiejkolwiek kwestii medycznej, powinieneś skonsultować się z lekarzem lub innym profesjonalnym dostawcą opieki zdrowotnej. Jeśli uważasz, że możesz cierpieć z powodu jakiegokolwiek schorzenia, powinieneś natychmiast zwrócić się o pomoc lekarską. Nigdy nie należy zwlekać z zasięgnięciem porady lekarskiej, lekceważeniem porady lekarskiej lub kontynuowaniem leczenia ze względu na informacje zawarte w tym artykule.
Prawa autorskie
prawa autorskie zawarte w niniejszym artykule są własnością Health Clinics LLC i jej licencjodawców.
Patent
protokół Care Oncology(„COC”) jest chroniony patentem Stanów Zjednoczonych US9622982B2 oraz dodatkowymi międzynarodowymi patentami.
*********************************************************************************
Agrawal,S., Vamadevan, P., Mazibuko, N., Bannister, R., Swery, R., Wilson, S., andEdwards, S. (2019). Nowa metoda tworzenia etycznych i skutecznych dowodów na stosowanie leków poza etykietą w onkologii (studium przypadku w Glejaku). Przód.Pharmacol. 10.
Ahern, T. P., Lash, T. L., Damkier, P., Christiansen,P. M., and Cronin-Fenton, D. P. (2014). Statyny a rokowanie raka piersi: dowody i możliwości. Lancet Oncol. 15, e461-468.
Aksoy, S., Sendur, M. A. n., and Altundag, K. (2013).Charakterystyka demograficzna i kliniczno-patologiczna u pacjentów z rakiem inwazyjnym, otrzymujących metforminę. Med. Oncol. Northwood Lond. Engl. 30, 590.
Alarcon Martinez, T., Zeybek, N. D., and Müftüoğlu, S. (2018). Ocena cytotoksycznego i Autofagicznego wpływu atorwastatyny na komórki raka piersi MCF-7. Balk. Med. J. 35, 256-262.
Alimova, I. N., Liu, B., Fan, Z., Edgerton, S. M.,Dillon, T., Lind, S. E., and Thor, A. D. (2009). Metformina hamuje wzrost komórek nowotworowych piersi, tworzenie kolonii i indukuje zatrzymanie cyklu komórkowego in vitro. CellCycle 8, 909-915.
Andrzejewski, S., Siegel, p. m., and St-Pierre, J.(2018). Profile metaboliczne związane ze skutecznością metforminy w leczeniu nowotworów. Przód.Endokrynol. 9.
Babcook, M. A., Shukla, S., Fu, P., Vazquez, E. J., Puchowicz, M. A., Molter, J. P., Oak, C. Z., MacLennan, G. T., Flask,C. A., Lindner, D. J., et al. (2014). Synergistyczne połączenie symwastatyny i metforminy w leczeniu opornego na kastrację raka prostaty z przerzutami kostnymi. Mol.Rak. 13, 2288–2302.
Bahrami, F., Morris, D. L., and Pourgholami, M. H. (2012). Tetracykliny: leki o ogromnym potencjale terapeutycznym. Mini Rev.Med.Chem. 12, 44–52.
Bao, B., Azmi, A. S., Ali, S., Zaiem, F., and Sarkar,F. H. (2014). Metformina może działać jako lek przeciwnowotworowy poprzez celowanie w komórki nowotworowe: potencjalne znaczenie biologiczne nowotworów Mirna związanych z rakiem wsobnym i rakiem trzustki. Ann. Transl. Med. 2.
Bjarnadottir, O., Romero, Q., Bendahl, P.-O., Jirström, K., Rydén, L., Loman, N., Uhlén, M., Johannesson, H., Rose, C., Grabau, D., etal. (2013). Ukierunkowanie reduktazy HMG-CoA na statyny w badaniu oportunitybreast cancer. Rak Piersi Res.Treat. 138, 499–508.
Bjarnadottir, O., Kimbung, S., Johansson, I., Veerla, S., Jönsson, M., Bendahl, P.-O., Grabau, D., Hedenfalk, I., and Borgquist, S. (2015). Globalne zmiany transkrypcyjne po leczeniu statynami w raku piersi. Clin. Cancer Res. Off. J. Am. Assoc. Cancer Res. 21, 3402-3411.
Bonanni, B., Puntoni, M., Cazzaniga, M., Pruneri, G., Serrano, D., Guerrieri-Gonzaga, A., Gennari, A., Trabacca, M. S., Galimberti, V., Veronesi, P., et al. (2012). Podwójny wpływ metforminy na raka piersiproliferacja w randomizowanym badaniu przedoperacyjnym. J. Clin. Oncol. Wyłącz. J. Am.Soc. Clin. Oncol. 30, 2593–2600.
Indywidualizingchemotherapy using the anty-Diabetic Drug, Metformin, as an Anxploratory Study. J. Rak Sci. Ther. 5.
Brewer, T. M., Masuda, H., Liu, D. D., Shen, Y., Liu,P., Iwamoto, T., Kai, K., Barnett, C. M., Woodward, W. A., Reuben, J. M., et al.(2013). Zastosowanie statyny w pierwotnym zapalnym raku piersi: badanie kohortowe. Br.J. Rak 109, 318-324.
Camacho, L., Dasgupta, A., and Jiralerspong, S.(2015). Metformina w raku piersi-rozwijająca się tajemnica. Rak piersi Res. BCR 17, 88.
(2006). Zapobieganie wzrostowi raka piersi przez statyny. Rak Res. 66,8707-8714.
Cazzaniga, M., DeCensi, A., Pruneri, G., Puntoni, M.,Bottiglieri, L., Varricchio, C., Guerrieri-Gonzaga, A., Gentilini, O. D., Pagani, G., Dell ’ Orto, P., et al. (2013). Wpływ metforminy na apoptozyzynę w badaniu przedoperacyjnym raka piersi. Br. J. Rak 109, 2792-2797.
Chae, Y. K., Valsecchi, M. E., Kim, J., Bianchi, A. L.,Khemasuwan, D., Desai, A., and Tester, W. (2011). Zmniejszone ryzyko raka Piersiwystępowanie u pacjentów stosujących inhibitory ACE, ARB i (lub) statyny. CancerInvest. 29, 585–593.
Chae, Y. K., Yousaf, M., Malecek, M.-K., Carneiro, B.,Chandra, S., Kaplan, J., Kalyan, A., Sassano, A., Platanias, L. C., and Giles,F. (2015). Statyny jako terapia przeciwnowotworowa; Czy możemy przełożyć dane przedkliniczne andepidemiologiczne na korzyści kliniczne? Discov. Med. 20, 413–427.
Chae, Y. K., Arya, A., Malecek, M.-K., Shin, D. S.,Carneiro, B., Chandra,S., Kaplan, J., Kalyan, A., Altman, J. K., Platanias, L., et al. (2016). Zmiana przeznaczenia metforminy do leczenia raka: aktualne badania kliniczne. Oncotarget 7, 40767-40780.
Chen, J., Lan, T., Hou, J., Zhang, J., An, Y., Tie,L., Pan, Y., Liu, J., and Li, X. (2012). Atorwastatyna uwrażliwia humannon-drobnokomórkowe raki płuc na karboplatynę poprzez zahamowanie aktywacji AKT i zwiększenie regulacji TIMP-1. Int. J. Biochem. Cell Biol. 44, 759–769.
Chen, L., Chubak, J., Boudreau, D. M., Barlow, W. E.,Weiss, N. S., and Li, C. I. (2017). Leczenie cukrzycy i ryzyko wystąpienia nowotworów złośliwych wśród pacjentów z rakiem piersi we wczesnym stadium: analiza SEER-MedicareAnalysis. Cancer Res. 77, 6033-6041.
Chen, T., Liang, Y., Feng, D., Tao, L., Qi, K., Zhang,H., Wang, H., Lin, Q., and Kong, H. (2013). Metformina hamuje proliferację i promuje apoptozę HER2 dodatnich komórek raka piersi poprzez obniżanie hsp90. J. BUON Off. J. Balk. Union Oncol. 18, 51–56.
Coyne, C., Jones, T., And Bear, R. (2014).Przeciwnowotworowe działanie cytotoksyczne gemcytabiny – (C4-amidu) – inDual-w połączeniu z Epirubicyną – (C3-amidu)-przeciw Opornemu na chemioterapię Gruczolakorakowi sutka (SKBr-3) i uzupełniającemu działaniu mebendazolu. J. Cancer Res.Ther. Oncol. 2.
Coyne, C. P., Jones, T., And Bear, R. (2012). Wpływ alternatywnych inhibitorów tubuliny na siłę działania aepirubicyny-Immunochemioterapeutycznego syntetyzowanego Z Ultra-Wioletowym aktywowanym półproduktem. Rak Clin. Oncol. 1, 49–80.
Coyne, C. P., Jones, T., And Bear, R. (2013).Gemcitabine-(C4-amide)- Anti-Neoplastic Cytotoxicity in DualCombination with Mebendazole against Chemotherapeutic-Resistant MammaryAdenocarcinoma. J. Clin. Exp. Oncol. 2.
Cufi, S., Corominas-Faja, B., Vazquez-Martin, A.,Oliveras-Ferraros, C., Dorca, J., Bosch-Barrera, J., Martin-Castillo, B., andMenendez, J.A. (2012). Metformin-induced preferential killing of breast cancerinitiating CD44+CD24-/low cells is sufficient to overcome primary resistance totrastuzumab in HER2+ human breast cancer xenografts. Oncotarget 3, 395–398.
Danzig, M.R., Kotamarti, S., Ghandour, R.A., Rothberg, M. B., Dubow, B. P., Benson, M. C., Badani, K. K., and McKiernan, J. M. (2015).Synergizm między metforminą i statynami w zmniejszaniu ryzyka wystąpienia objawów biochemicznych po radykalnej prostatektomii u mężczyzn z cukrzycą. ProstateCancer Prostatic Dis. 18, 63–68.
Davies, G., Lobanova, L., Dawicki, W., Groot, G.,Gordon, J. R., Bowen, M., Harkness, T., and Arnason, T. (2017). Metforminin hamuje rozwój i promuje resensytyzację, opornego na leczenie raka piersi. PLoS ONE 12.
De Witt, M., Gamble, A., Hanson, D., Markowitz, D., Powell, C., Al Dimassi, S., Atlas, M., Boockvar, J., Ruggieri, R.,and Symons, M. (2017). Zmiana przeznaczenia mebendazolu jako zamiennika winkrystyny w leczeniu guzów mózgu. Mol. Med. 23, 50–56.
DeCensi, A., Puntoni, M., Gandini, S.,Guerrieri-Gonzaga, A., Johansson, H. A., Cazzaniga, M., Pruneri, G., Serrano,D., Schwab, M., Hofmann, U., et al. (2014). Różnicowe efekty proliferacji raka piersi metforminonu według markerów insulinooporności i podtypu nowotworu w randomizowanym badaniu przedoperacyjnym. Rak Piersi Res.Treat. 148,81–90.
DeCensi, A., Puntoni, M., Guerrieri-Gonzaga, A.,Cazzaniga, M., Serrano, D., Lazzeroni, M., Vingiani, A., Gentilini, O., Petrera, M., Viale, G., et al. (2015). Wpływ metforminy na proliferację kanalika piersiowego In Situ w randomizowanym badaniu przedoperacyjnym. Rak Prev.Res.Phila. Pa 8, 888-894.
Deng, X.-S., Wang, S., Deng, A., Liu, B., Edgerton,S. M., Lind, S. E., Wahdan-Alaswad, R., and Thor, A. D. (2012). Metformina celuje w hamowanie wzrostu komórek i indukowanie apoptozy u osób z potrójnym ujemnym wynikiem. Cykl Komórkowy Georget. Tex 11, 367-376.
Dowling, R. J., Parulekar, W. R., Gelmon, K. A.,Shepherd, L. E., Virk, S., Ennis, M., Mao, F., Ligibel, J. A., Hershman, D. L., Rastogi, P., et al. (2018). CA15-3 / MUC1 w CCTG MA-32 (NCT01101438): phaseIII RCT wpływu metforminy w porównaniu z placebo na inwazyjne przeżycie wolne od choroby i ogólne przeżycie we wczesnym stadium raka piersi (BC). J. Clin. Oncol.
Duivenvoorden, W. C. M., Popović, S. V., Lhoták, S., Seidlitz,E., Hirte, H. W., Tozer, R. G., and Singh, G. (2002). Doksycyklina zmniejsza obciążenie nowotworowe w modelu przerzutów do kości ludzkiego raka piersi. Rak Res. 62,1588–1591.
El-Benhawy, S. A., and El-Sheredy, H. G. (2014).Metformina i przeżycie u pacjentów z cukrzycą i rakiem piersi. J. Egipt.Zdrowie Publiczne Assoc. 89, 148–153.
Feldt, M., Bjarnadottir, O., Kimbung, S., Jirström,K., Bendahl, P.-O., Veerla, S., Grabau, D., Hedenfalk, I., and Borgquist, S.(2015). Anty-proliferacyjne działanie wywołane przez statyny poprzez cyklinę D1 i p27 w badaniu raka piersi, który jest możliwy do wykrycia. J. Transl. Med. 13, 133.
Fife, R. S., and Sledge, G. W. (1995). Wpływ doksycykliny na wzrost in vitro, migrację i aktywność żelatynazy w komórkach raka piersi. J. Lab. Clin. Med. 125, 407–411.
Fife, R. S., and Sledge, G. W. (1998). Wpływdoksycykliny na komórki nowotworowe in vitro i In vivo. ADV. Dent. Res. 12, 94-96.
Fiorillo, M., Tóth, F., Sotgia, F., And Lisanti, M. P. (2019). Doksycyklina, azytromycyna i witamina C (DAV): silne połączenie terapii ukierunkowanej na mitochondria i eliminację nowotworowych komórek macierzystych (CSCs).11, 2202-2216.
Forodi, F., Duivenvoorden, W. C., and Singh, G.(2009). Interakcje doksycykliny z chemioterapeutykami w komórkach gruczolakoraka u ludzi MDA-MB-231. Przeciwnowotworowe. Narkotyki 20, 115-122.
Garwood, E. R., Kumar, A. S., Baehner, F. L. 2010-02-12 12: 40: 40 (2010). Fluwastatyna zmniejsza proliferację i zwiększa apoptozę u kobiet z rakiem o wysokim stopniu zaawansowania. Rak Piersi Res.Treat. 119, 137–144.
Giles, E. D., Jindal, S., Wellberg, E. A., Schedin, T., Anderson, S. M., Thor, A. D., Edwards, D. P., MacLean, P. S., and Schedin, P. (2018). Metformina hamuje ekspresję aromatazy zrębowej i progresję nowotworu w modelu gryzoni pomenopauzalnego raka piersi. Rak piersi Res. BCR 20.
Goodwin, P. J., Parulekar, W. R., Gelmon, K. A.,Shepherd, L. E., Ligibel, J. A., Hershman, D. L., Rastogi, P., Mayer,I. A., Hobday, T. J., Lemieux, J., et al. (2015). Wpływ metforminy w porównaniu z placebo na czynniki andmetaboliczne w NCIC CTG MA.32. J. Natl. Inst.Nowotworowe 107.
Hadad, S., Iwamoto, T., Jordan, L., Purdie, C., Bray,S., Baker, L., Jellema, G., Deharo, S., Hardie, D. G., Pusztai, L., et al.(2011). Dowody na biologiczne działanie metforminy w operacyjnym raku piersi: przedoperacyjne, randomizowane badanie kliniczne. Rak Piersi Res.Treat. 128, 783–794.
Hadad, S. M., Hardie, D. G., Appleyard, V., andThompson, A. M. (2014). Wpływ metforminy na proliferację komórek raka piersi, szlak AMPK i cykl komórkowy. Clin. Transl. Oncol. Wyłącz.Publ. Fed. Span. Oncol. Soc. Natl. Inst.Nowotworowe Mex. 16, 746–752.
Hatoum, D., and McGowan, E. M. (2015). Najnowsze postępy w stosowaniu metforminy: czy leczenie cukrzycy może zapobiegać rakowi piersi? BioMedRes. Int. 2015, 548436.
Hirsch, H. A., Iliopoulos, D., Tsichlis, P. N., andStruhl, K. (2009). Metformina selektywnie celuje w nowotworowe komórki macierzyste i działa wraz z chemioterapią w celu zablokowania wzrostu guza i przedłużenia remisji. CancerRes. 69, 7507–7511.
Hothi, P., Martins, TJ, Chen, L., Deleyrolle, L., Yoon, J.-G., Reynolds, B., and Foltz, G. (2012). Wysokowydajne ekrany chemiczne identyfikują Disulfiram jako Inhibitor ludzkich komórek macierzystych glejaka.Oncotarget 3, 1124-1136.
Hou, Z.-J., Luo, X., Zhang, W., Peng, F., Cui, B., Wu,S.-J., Zheng, F.-M., Xu, J., Xu, L.-Z., Long, Z.-J., et al. (2015).Flubendazol, zatwierdzony przez FDA środek przeciwrobaczy, celuje w komórki macierzyste raka piersi.Oncotarget 6, 6326-6340.
Iliopoulos, D., Hirsch, H. A., and Struhl, K. (2011).Metformina zmniejsza dawkę chemioterapii w celu przedłużenia remisji nowotworu w przeszczepach wewnętrznych z udziałem wielu typów komórek nowotworowych. Rak Res. 71,3196-3201.
Jacob, L., Kostev, K., Rathmann, W., and Kalder, M. (2016). Wpływ metforminy na przerzuty u pacjentów z rakiem piersi i cukrzycą typu 2. J. Cukrzyca Powikłania 30, 1056-1059.
Jagust, P., de Luxán-Delgado, B., Parejo-Alonso, B.,and Sancho, P. (2019). Strategie Terapeutyczne Oparte Na Metabolizmie Ukierunkowane Na Komórki Nowotworowe. Przód. Pharmacol. 10.
Jang, M., Kim, S. S., and Lee, J. (2013). Nowotwór komórkowymmetabolizm: implikacje dla celów terapeutycznych. Exp. Mol. Med. 45, e45.
Jiralerspong, S., Palla, S. L., Giordano, S. H.,Meric-Bernstam, F., Liedtke, C., Barnett, C. M., Hsu, L., Hung, M.-C.,Hortobagyi, G. N., and Gonzalez-Angulo, A. M. (2009). Metformina i patologia pełna odpowiedź na chemioterapię Neoadiuwantową u pacjentów z cukrzycą i rakiem piersi. J. Clin. Oncol. 27, 3297–3302.
Kalinsky, K., Crew, K. D., Refice, S., Xiao, T., Wang,A., Feldman, S. M., Taback, B., Ahmad, A., Cremers, S., Hibshoosh, H., et al.(2014). Przedoperacyjne badanie metforminy u pacjentów z nadwagą i otyłością z nowo zdiagnozowanym rakiem piersi. Cancer Invest. 32, 150–157.
Kanugula, A. K., Gollavilli, p. n., Vasamsetti, S. B.,Karnewar, S., Gopoju, R., Ummanni, R., and Kotamraju, S. (2014). Hamowanie proliferacji i inwazji raka piersi wywołane statynami polega na tłumieniu transportu żelaza: pośredniej aktywności tlenku azotu i mechanizmów obronnych przeciwutleniaczy. FEBS J. 281, 3719-3738.
Kim, H. J., Kwon, H., Lee, J. W., Kim, H. J., Lee, S. B.,Park, H. S., Sohn, G., Lee, Y., Koh, B. S., Yu, J. H., et al. (2015). Metforminina zwiększa przeżywalność w nowotworach piersi z receptorem hormonalnym, HER2-dodatnim rakiem piersipacjenci z cukrzycą. Rak piersi Res. BCR 17, 64.
Kim, J., Lim, W., Kim, E.-K., Kim, M.-K., Paik, N.-S.,Jeong, S.-S., Yoon, J.-H., Park, C. H., Ahn, S. H., Kim, L. S., et al. (2014).Randomizowane badanie fazy II z zastosowaniem neoadiuwantowej metforminy i letrozolu w porównaniu z placebo letrozolem w przypadku pozytywnego dla receptora estrogenowego raka piersi po menopauzie (METEOR). Rak BMC 14, 170.
Kodach, L. L., Jacobs, R. J., Voorneveld, P. W., Wildenberg, M. E., Verspaget, H. W., van Wezel, T., Morreau, H., Hommes, D. W., Peppelenbosch, M. P., van den Brink, G. R., et al. (2011). Statyny zwiększają wrażliwość komórek raka jelita grubego, indukując przeprogramowanie epigenetyczne i zmniejszając „stemness” komórek raka jelita grubego poprzez szlak morfogenetyczny kości. Gut 60, 1544-1553.
Kozar, K., Kamiński, R., Legat, M., Kopec, M., Nowis,D., Skierski, J., Koronkiewicz, M., Jakóbisiak, M., and Golab, J. (2004).Ceriwastatyna wykazuje zwiększoną aktywność przeciwnowotworową wobec linii komórkowych raka piersi u ludzi, gdy jest stosowana w skojarzeniu z doksorubicyną lub cisplatyną. Int.J. Oncol.
Kroemer, G., and Pouyssegur, J. (2008). Tumor CellMetabolism: pięta achillesowa raka. Cancer Cell 13, 472-482.
Kwan, M. L., Habel, L. A., Flick, E. D., Quesenberry,C. P., and Caan, B. (2008). Stosowanie statyn po diagnozie i rak piersiwprowadzenie w prospektywnym badaniu kohortowym z rakami piersi we wczesnym stadium. Rak Piersi Res.Treat. 109, 573–579.
Lacerda, L., Reddy, J. P., Liu, D., Larson, R., Li, L., Masuda, H., Brewer, T., Debeb,B. G., Xu, W., Hortobágyi, G. N., et al. (2014).Symwastatyna radiosensybilizuje zróżnicowane i przypominające łodygi linie komórkowe raka piersi i jest związana z poprawą kontroli miejscowej u pacjentów z zapalnym rakiem piersi leczonych radiotektomią po wycięciu. Komórki Macierzyste Transl. Med.3, 849–856.
Lamb, R., Fiorillo, M., Chadwick, A., Ozsvari, B.,Reeves, K. J., Smith, D. L., Clarke, R. B., Howell, S. J., Cappello, A. R.,Martinez-Outschoorn, U. E., et al. (2015a). Doxycycline down-reguluje DNA-PKand radiosensybilizuje komórki inicjujące nowotwór: implikacje dla skuteczniejszej terapii przeciwradiacyjnej. Oncotarget 6, 14005-14025.
Lamb, R., Ozsvari, B., Lisanti, C. L., Tanowitz, H. B., Howell, A., Martinez-Outschoorn, U. E., Sotgia, F., And Lisanti, M. P. (2015b).Antybiotyki, które celują w mitochondria skutecznie eliminują komórki macierzyste raka, w wielu typach nowotworów: leczenie raka jak choroby zakaźnej.Oncotarget 6, 4569-4584.
Lehman, D. M., Lorenzo, C., Hernandez, J., and Wang, C.(2012). Stosowanie statyny jako moderatora wpływu metforminy na ryzyko raka gruczołu krokowego u pacjentów z cukrzycą typu 2. Diabetes Care 35, 1002-1007.
Lin, C., Lo, M., Moody, R., Stevers, N., Tinsley, S.,and Sun, D. (2018). Doksycyklina celuje w komórki rakowe piersi z dodatnim dehydrogenazą aldehydową. Oncol. REP.
Liu, B., Yi, Z., Guan, X., Zeng, Y.-X., And Ma, F.(2017). Związek między statynami a prognozowaniem raka piersi różni się rodzajem bystatyny i czasem ekspozycji: metaanaliza. Rak Piersi Res.Treat. 164,1–11.
Liu, H., Scholz, C., Zang, C., Schefe, J. H., Habbel,P., Regierer, A.-C., Schulz, C.-O., Possinger, K., and Eucker, J. (2012).Metformina i inhibitor mTOR ewerolimus (RAD001) uczulają komórki nowotworowe piersi na cytotoksyczne działanie leków chemioterapeutycznych in vitro. AnticancerRes. 32, 1627–1637.
Liu, X., Romero, I. L., Litchfield, L. M., Lengyel, E.,and Locasale, J. W. (2016). Metformina wpływa na centralny metabolizm węgla i zmniejsza zapotrzebowanie mitochondrialne w nowotworach u ludzi. Cell Metab. 24, 728–739.
Ma, J., Guo, Y., Chen, S., Zhong, C., Xue, Y.,Zhang, Y., Lai, X., Wei, Y., Yu, S., Zhang, J. i in. (2014). Enhancestamoksyfen hamowanie wzrostu guza w raku piersi ER-dodatnim. BMCCancer 14, 172.
Manthravadi, S., Shrestha, A., and Madhusudhana, S. (2016). Wpływ stosowania statyny na nawrót raka i śmiertelność u raka piersi: przegląd systematyczny i metaanaliza. Int. J. Rak 139, 1281-1288.
Mark, M., Klingbiel, D., Mey, U., Winterhalder, R., Rothermundt, C., Gillessen, S., von Moos, R., Pollak,M., Manetsch, G., Strebel, R., et al. (2019). Wpływ dodania metforminy do abirateronu u pacjentów z rakiem gruczołu krokowego opornym na kastrację Metastatyczną z postępującą chorobą podczas leczenia Abirateronem (MetAb-Pro): badanie pilotażowe Fazy 2. Clin. Genitourin. Rak 17, e323–e328.
Martin-Castillo, B., Pernas, S., Dorca, J., Alvarez, I., Martinez, S., Perez-Garcia, J. M., Batista-Lopez, N., Rodriguez-Sanchez, K. A., Amigliano, K., Dominguez, S. i in. (2018). Faza 2 trial ofneoadjuvant metformin in combination with trastuzumab and chemotherapy in Women ’ s early HER2-positive breast cancer: the Metten study. Oncotarget 9,35687-35704.
Mokhtari, R. B., Homayouni, T. S., Baluch, N., Morgatskaya, E., Kumar, S., Das, B., and Yeger, H. (2017). Combination therapyin combating cancer. Oncotarget 8, 38022-38043.
Mück, A. O., Seeger, H., and Wallwiener, D. (2004).Hamujący wpływ statyn na proliferację raka piersi u ludzi cells.Int. J. Clin Pharmacol. Ther. 42, 695–700.
Mukhopadhyay, T., Sasaki, J., Ramesh, R., and Roth,J. A. (2002). Mebendazol wywołuje silne działanie przeciwnowotworowe na ludzkie komórki nowotworowe zarówno in Vitro, jak i In Vivo. Clin. Cancer Res. 8, 2963-2969.
Murtola, T. J., Visvanathan, K., Artama, M., Vainio,H., and Pukkala, E. (2014). Stosowanie statyny i przeżycie raka piersi: badanie ogólnokrajowe z Finlandii. PloS One 9, e110231.
Nanni, O., Amadori, D., De Censi, A., Rocca, A., Freschi, A., Bologna, A., Gianni, L., Rosetti, F., Amaducci, L., Cavanna, L., et al. (2019). Metformina w skojarzeniu z chemioterapią w porównaniu z samą chemioterapią w leczeniu pierwszego rzutu raka piersi z przerzutami HER2-ujemnymi. MYMErandomized, Faza 2 badanie kliniczne. Rak Piersi Res.Treat. 174, 433–442.
Nimako, G. K., Wintrob, Z. A. P., Sulik, D. A., Donato,J. L., and Ceacareanu, A. C. (2017). Synergistyczna korzyść ze statyny i nowotworów złośliwych przewodu pokarmowego Metformininy. J. Pharm. Pract. 30, 185–194.
Niraula, S., Dowling, R. J. O., Ennis, M., Chang, M. C., Done, S. J., Hood, N., Escallon, J., Leong, W. L., McCready, D. R., Reedijk, M., et al. (2012). Metformina we wczesnym raku piersi: prospektywne okno badania neoadiuwantowego. Rak Piersi Res.Treat. 135, 821–830.
Nygren, P., and Larsson, R. (2014). Zmiana położenia leku z ławki do łóżka: remisja guza przez lek przeciwrobaczy mebendazolein oporny na raka jelita grubego z przerzutami. Acta Oncol. 53, 427–428.
Orecchioni, S., Reggiani, F., Talarico, G., Mancuso,P., Calleri, A., Gregato, G., Labanca, V., Noonan, D. M., Dallaglio, K., Albini,A., et al. (2015). Biguanidy, metformina i fenformina hamują itangiogenezę, lokalny i przerzutowy wzrost raka piersi poprzez celowanie zarówno w komórki neoplastyczne, jak i mikrośrodowiskowe. Int. J. Rak 136, E534-544.
Ozsvari, B., Sotgia, F., And Lisanti, M. P. (2017). Nowe, niezależne od mutacji podejście do terapii nowotworowej: hamowanie onkogennego RAS andMYC, poprzez ukierunkowanie na biogenezę mitochondrialną. / Align = „left” / 209821
Pantziarka, P., Bouche, G., Meheus, L., Sukhatme, V.,and Sukhatme, V. P. (2014). Repurposing leki w onkologii (ReDO) – mebendazol asan środek przeciwnowotworowy. Ecancermedicalscience 8.
Peiris-Pagès, M., Sotgia, F., And Lisanti, M. P.(2015). Doksycyklina i terapeutyczne ukierunkowanie odpowiedzi na uszkodzenia dna w komórkach nowotworowych: stary lek, nowy cel. Oncoscience 2, 696-699.
Rahmani, J., Manzari, N., Thompson, J., Gudi, S. K., Chhabra, M., Naik, G., Mousavi, S. M., Varkaneh, H. K., Clark, C., and Zhang, Y. (2019). Wpływ metforminy na biomarkery związane z rakiem piersi: systematyczny przegląd, metaanaliza i odpowiedź na dawkę w randomizowanych badaniach klinicznych. Clin. Transl. Oncol.
Scatena, C., Roncella, M., Di Paolo, A., Aretini, P., Menicagli, M., Fanelli, G., Marini, C., Mazzanti, C. M., Ghilli, M., Sotgia, F., et al. (2018). Doksycyklina, Inhibitor mitochondrialnej biogenezy, Skutecznie redukuje nowotworowe komórki macierzyste (CSCs) u pacjentów z wczesnym rakiem piersi: kliniczne badanie pilotażowe. Przód. Oncol. 8.
Seeger, H., Wallwiener, D., and Mueck, A. O. (2003).Statyny mogą hamować proliferację ludzkich komórek raka piersi in vitro. Exp.Clin. Endokrynol. Cukrzyca Wyłączona. J. Ger. Soc. Endokrynol. Ger. Cukrzyca Assoc.111, 47–48.
Skoda, J., Borankova, K., Jansson, P. J., Huang,M. L.-H., Veselska, R., and Richardson, D. R. (2019). Farmakologiczne ukierunkowanie mitochondriów w komórkach macierzystych raka: starożytne organelle na styku nowoczesnych terapii przeciwnowotworowych. Pharmacol. Res. 139, 298-313.
Sonnenblick, A., Agbor-Tarh, D., Bradbury, I., DiCosimo, S., Azim, H. A., Fumagalli, D., Sarp, S., Wolff, A. C., Andersson, M.,Kroep, J., et al. (2017). Wpływ stosowania cukrzycy, insuliny i metforminy na pacjentów z dodatnim receptorem 2 ludzkiego naskórkowego czynnika wzrostu pierwotnego raka piersi: analiza z randomizowanego badania fazy III ALTTO. J. Clin. Oncol. 35, 1421–1429.
Van Wyhe, R. D., Rahal, O. M., and Woodward, W. A.(2017). Wpływ statyn na nawrót raka piersi i śmiertelność: przegląd.Rak Piersi Celuje W Nią. 9, 559–565.
Vazquez-Martin, A., Oliveras-Ferraros, C., Cufí, S.,Del Barco, S., Martin-Castillo, B., Lopez-Bonet, E., and Menendez, J. A. (2011).Lek przeciwcukrzycowy metformina hamuje proteinCD24 związane z przerzutami w potrójnie ujemnych komórkach raka piersi MDA-MB-468. Oncol. REP.25.135–140.
Vintonenko, N., Jais, J.-P., Kassis, N., Abdelkarim,M., Perret, G.-Y., Lecouvey, M., Crepin, M., and Di Benedetto, M. (2012).Analiza transkryptomowa i aktywność in vivo fluwastatyny w porównaniu z zoledronikacidem w modelu mysich przerzutów raka piersi. Mol. Pharmacol. 82, 521–528.
Wahdan-Alaswad, R. S., Cochrane, D. R., Spoelstra, N. S.,Howe, E. N., Edgerton, S. M., Anderson, S. M., Thor, A. D., and Richer, J. K. (2014). Indukowane metforminą zabijanie potrójnie ujemnych komórek raka piersi jest wywoływane przez redukcję syntazy kwasów tłuszczowych poprzez miRNA-193b. Rak 5,374-389.
Wang, Z.-S., Huang, H.-R., Zhang, L.-Y., Kim, S., He, Y., Li, D.-L., Farischon, C., Zhang, K., Zheng, X., Du, Z.-Y., et al. (2017).Mechanistyczne badanie działania hamującego Inkombinacji metforminy i atorwastatyny na komórki raka gruczołu krokowego in Vitro i In Vivo. Biol. Pharm. Bzdura.40, 1247–1254.
Wolfe, A. R., Debeb, B. G., Lacerda, L., Larson, R.,Bambhroliya, A., Huang, X., Bertucci, F., Finetti, P., Birnbaum, D., Van Laere,S., et al. (2015). Simwastatyna zapobiega potrójnie ujemnemu rakowi piersi w modelach przedklinicznych poprzez regulację FOXO3a. Poczęstuj się. 154, 495–508.
Xu, H., Chen, K., Jia, X., Tian, Y., Dai, Y., Li, D.,Xie, J., Tao, M., and Mao, Y. (2015). Stosowanie metforminy jest związane z Lepszymprzysięciem u pacjentów z rakiem piersi z cukrzycą: metaanaliza. TheOncologist 20, 1236-1244.
Yam, C., Esteva, F. J., Patel, M. M., Raghavendra, A. S.,Ueno, N. T., Moulder, S. L., Hess, K. R., Shroff, G. S., Hodge, S., Koenig, K. H. i in. (2019). Skuteczność i bezpieczeństwo leczenia skojarzonego metforminą, ewerolimusem i eksemestanem u pacjentów z nadwagą i otyłością po menopauzie z przerzutowym rakiem piersi z dodatnim receptorem hormonalnym i ujemnym receptorem HER2: badanie II Fazy.Inwestuj. New Drugs 37, 345-351.
Yao, H., He, G., Yan, S., Chen, C., Song, L., Rosol, T.J., and Deng, X. (2017). Potrójnie ujemny rak piersi: czy jest leczenie na horyzoncie? Oncotarget 8, 1913-1924.
Zhang, L., Guo, M., Li, J., Zheng, Y., Zhang, S., Xie,T., and Liu, B. (2015). Oparte na biologii systemowej odkrycie potencjalnego Atg4bagonisty (Flubendazolu), który indukuje autofagię w raku piersi. Mol. Biosyst.11, 2860–2866.
Zhang, L., Xu, L., Zhang, F., and Vlashi, E. (2017).Doksycyklina hamuje fenotyp komórek macierzystych raka andepitelialnego do mezenchymalnego przejścia w raku piersi. Cykl Komórkowy Georget. Tex16, 737-745.
Zhang, L., Bochkur, M., Yazal, T.,Dong, K., Nguyen, A., Yu, G., Dao, A., Bochkur Dratver, M., Duhachek-Muggy, S.,Bhat, K., et al. (2019a). Mebendazol nasila radioterapię w potrójnie Ujemnychnowotworowy. Int. J. Radiat. Oncol. Biol. Phys. 103, 195–207.
Zhang, Y., Storr, S. J., Johnson, K., Green, A. R.,Rakha, E. A., Ellis, I. O., Morgan, D. A. L., and Martin, S. G. (2014). Udział metforminy i AMPK w radioterapii i rokowaniu raka piersi podobnego do Luminal versusbasal leczonych radioterapią. Oncotarget 5, 12936-12949.
Zhang, Z.-J., Yuan, J., Bi, Y., Wang, C., and Liu, Y.(2019b). Wpływ metforminy na biomarkery i przeżywalność raka piersi-przegląd systematyczny i metaanaliza randomizowanych badań klinicznych. Pharmacol.Res. 141, 551-555.
Zhong, S., Zhang, X., Chen, L., Ma, T., Tang, J., andZhao, J. (2015). Stosowanie i śmiertelność statyn u chorych na raka: przegląd systematyczny i metaanaliza badań obserwacyjnych. Leczenie Raka. Rev. 41, 554-567.
