de empirische formule van een verbinding vertelt u de kleinste gehele getalverhouding tussen de elementen waaruit deze verbinding bestaat.
Dit betekent dat je de empirische formule kunt zien als een soort bouwsteen voor het molecuul.
kijkend naar de empirische formule voor uw verbinding #”CH”_2″O”#, weet u dat u
- één koolstofatoom
- twee waterstofatomen
- één zuurstofatoom
nodig hebt om dit molecuul te kunnen opbouwen. Jouw taak is nu om te bepalen hoeveel van deze bouwstenen nodig zijn om de moleculaire formule van de verbinding te krijgen.
merk op dat u de molaire massa van de verbinding kent. De molaire massa vertelt je wat de totale massa van een mol van de verbinding is.
Dit betekent dat als je de molaire massa van een bouwsteen berekent, je de totale Molaire massa van het molecuul kunt gebruiken om te bepalen hoeveel bouwstenen je nodig hebt.
Voor de molaire massa van de empirische formule, het gebruik van de molaire massa ‘ s van elk atoom bevat
#overbrace(1 xx “12.011 g/mol”)^(kleur(blauw)(“een mol C”)) + overbrace(2 xx “1.00794 g/mol”)^(kleur(groen)(“twee mol H”)) + overbrace(1 xx “15.9994 g/mol”)^(color(red)(“een mol O”)) = “30.03 g / mol” #
dus één bouwsteen heeft een Molaire massa van #” 30.03 g/mol”#, en de molaire massa van het molecuul is #”180.2 g/mol”#. Dit betekent dat u
# 30.03 color (red) (cancel(color (black) (“g/mol”))) * color(blue) (n) = 180.2 color(red) (cancel(color (black) (“g/mol”)))#
#color(blue) (n) = 180.2/30.03 = 6.0007 ~~ 6#
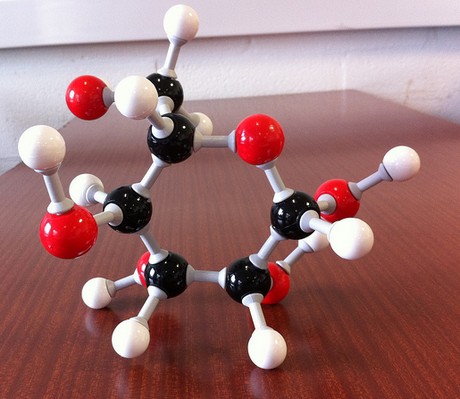
The molecular formula of the compound will thus be
#(“CH”_2″O”)_color(blue)(6) implies “C”_6″H”_12″O”_6 -># glucose