en forbindelses empiriske formel forteller deg det minste hele tallforholdet mellom elementene som utgjør forbindelsen er.
Dette betyr at du kan tenke på den empiriske formelen som en slags byggestein for molekylet.
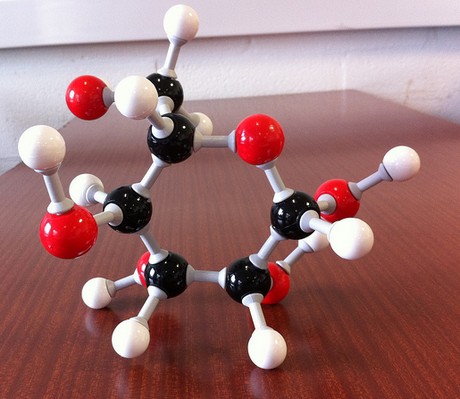
Ser du på den empiriske formelen for forbindelsen din, #»CH»_2″O»#, vet du at du trenger
- ett karbonatom
- to hydrogenatomer
- ett oksygenatom
for å begynne å bygge dette molekylet. Din jobb nå er å finne ut hvor mange av disse byggesteinene er nødvendig for å få molekylformelen av forbindelsen.
Legg Merke til at du kjenner den molare massen av forbindelsen. Molarmassen forteller deg hva den totale massen av en mol av forbindelsen er.
Dette betyr at hvis du finner ut molarmassen til en byggestein, kan du bruke molekylets totale molmasse til å bestemme hvor mange bygninger blokker du trenger.
for å få molarmassen til den empiriske formelen, bruk molarmassene til hvert atom den inneholder
#overbrace(1 xx «12.011 g/mol»)^(farge(blå)(«en mol C»)) + overbrace(2 xx «1.00794 g/mol»)^(farge(grønn)(«to mol H»))) + overbrace(1 xx «15.9994 g / mol»)^(farge(rød) («en mol o»)) = «30.03 g/mol»#
så, en byggestein har en molar masse på # «30,03 g / mol»#, og molarmassen av molekylet er # «180,2 g / mol»#. Dette betyr at du har
# 30.03 farge(rød)(avbryt(farge(svart)(«g/mol»))) * farge(blå)(n) = 180.2 farge(rød)(avbryt(farge(svart)(«g/mol»)))#
#farge(blå)(n) = 180.2/30.03 = 6.0007 ~~ 6#
The molecular formula of the compound will thus be
#(«CH»_2″O»)_color(blue)(6) implies «C»_6″H»_12″O»_6 -># glucose