The COC Protocol™ in Breast Cancer
Questo documento è un riassunto della logica e di alcune delle prove scientifiche attuali che supportano l’uso dei farmaci del protocollo COC insieme ai trattamenti standard di cura per il cancro al seno. Siamo consapevoli che il cancro è una condizione molto personale, e ogni paziente ha una serie unica di sfide. Per ulteriori informazioni riguardanti la propria situazione personale si prega di mettersi in contatto con la cura Oncology Clinic a 800-392-1353 negli Stati Uniti, o visitare il sito web all’indirizzo https://careoncology.com.
Se siete nuovi a cura di Oncologia si prega di notare quanto segue:
- Non è necessario viaggiare. Puoi incontrare il nostro team di oncologi e infermieri oncologici attraverso video sicuri per un supporto continuo.
- I farmaci Care Oncology adjunct protocol vengono spediti direttamente a casa tua dalle nostre farmacie partner statunitensi e possono essere utilizzati insieme al tuo trattamento di cura standard.
- Siamo incredibilmente orgogliosi di annunciare che abbiamo superato il processo di validazione estremamente rigoroso dell’Istituto di validazione dell’analisi dei dati, dei reclami sui risultati e del calcolo del valore. Abbiamo lavorato duramente per arrivare a questo punto. All’inizio, abbiamo riconosciuto l’enorme valore che un programma di farmaci riproposti offerto responsabilmente ai malati di cancro, tuttavia, non veniva offerto in scala. Quattro anni fa, abbiamo deciso di cambiare questo sapendo che era una maratona, non uno sprint.
Il COC Protocollo e cancro al seno: i punti Chiave
- Il COCProtocol è una combinazione di quattro comunemente prescritti farmaci(atorvastatina, la metformina, mebendazole, e doxiciclina) con il potenziale totarget cancro al seno e contribuire a migliorare l’efficacia della norma anticancertherapies.
- Un numero di studi osservazionali ha collegato l’uso di metformina o statina a miglioramenti nei pazienti con cancro al seno.
- Laboratoriostudi sulle cellule del cancro al seno coltivate in piatti mostrano che la metformina e le statine possono colpire direttamente e danneggiare le cellule del cancro al seno, indebolendole e rendendole più vulnerabili ai trattamenti standard.
- I risultati di piccoli studi clinici “finestra di opportunità” in pazienti affetti da carcinoma mammario operatoriin genere mostrano che l’assunzione di metformina o statina prima dell’intervento chirurgico può portare a cambiamenti potenzialmente positivi nei marcatori molecolari del cancro, compresi quelli che regolano la crescita e la divisione delle cellule del carcinoma mammario. Sono in corso ulteriori studi per verificare se la metformina o le statine possono influenzare la risposta alla malattia.
- La doxiciclinapuò bloccare la crescita di cellule staminali di cancro al seno HER2 positive e triple negative incubate in piatti in laboratorio e ha contribuito a migliorare i cambiamenti legati alla resistenza indotti dalla chemioterapia standard paclitaxel.
- Doxiciclina ha appena raggiunto i primi studi clinici in pazienti con cancro al seno. I risultati del primo piccolo studio mostrano che i pazienti con carcinoma mammario in fase iniziale che hanno assunto doxiciclina per soli 14 giorni prima dell’intervento chirurgico hanno ridotto i livelli di marcatori molecolari per la presenza di cellule staminali tumorali di una media di circa il 40%. Sono stati osservati effetti benefici per tutti i pazienti trattati, tranne uno(8/9).
- Mebendazolopuò rallentare la crescita e la divisione delle cellule tumorali della mammella coltivate in laboratorio,comprese le cellule tumorali della mammella che sono più resistenti alla chemioterapia. Sono necessari ulteriori studi umani.
Il protocollo COC e il cancro al seno: Evidenza pubblicata
Il protocollo COC è un regime combinato di quattro farmaci comunemente prescritti, ciascuno con evidenza di attività antitumorale metabolicamente basata e profili di sicurezza ben compresi. Questi farmaci sono: metformina, atorvastatina, doxiciclina e mebendazolo. Alcuni degli studi che sostengono l’uso del protocollo di theCOC come terapia aggiuntiva accanto ai trattamenti standard correnti del cancro del forbreast sono presentati qui sotto. Questa prova pricipalmente viene dai laboratorystudies, dai grandi studi epidemiologici (che indagano i collegamenti fra takingmedications ed i risultati del cancro al seno in gruppi di individui) e dalle prove cliniche del earlystage.
Si può notare che molti degli studi di seguito si concentrano solo su singoli protocolli COC. Siamo i primi a progettare una terapia aggiuntiva che combina allfour. Noi crediamo che la combinazione di questi farmaci raggiungerà il greatestresults, e il nostro programma di ricerca, chiamato METRICHE, sta già producendo moreof le prove necessarie per mostrare questo. Lei può leggere più su perché noi believethese medicazioni lavorano insieme così bene per aiutare cancro di bersaglio, e su programma di theMETRICS stesso, in ulteriori sezioni sotto.
Metformina e cancro al seno
Metforminusa legata ai potenziali benefici del cancro al seno
Molti studi osservazionali ora forniscono prove a sostegno dell’uso di metformina nel cancro al seno. La metformina è autorizzata a trattare il diabete di tipo 2, e gli studi osservazionali in gruppi di pazienti con diabete tendono a dimostrare che quelli che assumono metformina hanno maggiori possibilità di un risultato migliore se sviluppano il cancro al seno (Aksoy et al. Nel 2013, El-Benhawy e El-Sheredy, 2014; Sonnenblick et al., 2017).L’uso di metformina è stato collegato a una migliore sopravvivenza in pazienti con cancro al seno (Kim et al., 2015; Xuet al., 2015), migliore risposta al trattamento del cancro al seno (Jiralerspong et al., 2009), e meno possibilità di diffusione del cancro al seno andrelapse (Chen et al., 2017; Jacob et al., 2016).
È molto probabile che alcuni degli effetti benefici della metformina trovati in questi studi siano dovuti alla capacità della metformina di migliorare il diabete e / o il peso di un paziente riducendo i livelli di glucosio, che possono aiutare a ridurre il rischio di sviluppare il cancro al seno, e migliorare la salute di un paziente e la capacità di affrontare il cancro al seno Ma gli studi di laboratorio mostrano anche che la metformina sta facendo più di questo. In effetti la metformina può lavorare attivamente direttamente contro le cellule tumorali del seno, riducendo la loro capacità di assorbire e utilizzare energia e bloccando la loro capacità di crescere, diffondersi, sopravvivere e ricadere (Alimova et al., 2009; Hadad et al., 2014; Orecchini et al., 2015).
Diversii tipi di cancro al seno richiedono trattamenti diversi. Trastuzumab, ad esempio, è specificamente usato per trattare il cancro al seno positivo al recettore del fattore di crescita epidermico umano 2 (HER2). Il tamoxifene è efficace contro il cancro al seno positivo del recettore dell’estrogeno (ER). È importante sottolineare che gli studi sulle cellule tumorali in laboratorio dimostrano che la metformina ha attività antitumorale contro molti diversi tipi di cellule di cancro al seno, tra cui ER positivo (Giles et al., 2018), HER2 positivo (Chen et al., 2013), e sottotipi potenzialmente più difficili da trattare come le cellule tumorali triple-negative (Deng et al., 2012; Vazquez-Martin et al., 2011; Wahdan-Alaswad et al., 2014).Ciò significa che la metformina ha il potenziale per lavorare efficacemente insieme ai trattamenti standard per il cancro al seno, indipendentemente dal sottotipo di cancro.
Metformintargets breast cancer stem cells
Metforminha anche dimostrato di colpire le cellule staminali del cancro al seno (Bao et al., 2014; Cufiet al., 2012; Hirsch et al., 2009).Questa attività contro le cellule staminali del cancro al seno, insieme alla sua capacità di ottenere diversi sottotipi di cancro al seno, aiuta a spiegare perché gli studi di labcome può funzionare in combinazione con una serie di trattamenti standard, tra cutrastuzumab (Cufi et al., 2012), tamoxifene (Ma et al., 2014), eagenti chemioterapici standard (Iliopoulos et al.,2011). Studi su animali e cellule dimostrano che la metformina entrambiaiuta a migliorare l’efficacia dei trattamenti standard (Bradford e Khan,2013; Liu et al., 2012; Zhang et al., 2014) e ritarda anche la ricaduta di tumori che sono stati trattati con queste terapie (Iliopoulos et al.,2011).
Inoltre, studi di laboratorio mostrano anche che la metformina può anche aiutare a prevenire che le cellule tumorali del seno diventino resistenti alla chemioterapia e migliorare la sensibilità delle cellule tumorali già resistenti al trattamento (Davies et al., 2017).
La metformina migliora i marcatori del carcinoma mammario nei primi studi clinici
Come risultato della grande quantità di dati di supporto per la metformina nel carcinoma mammariogenerato da studi osservazionali e di laboratorio, sono attualmente in corso vari trial clinici per l’individuazione della metformina nel carcinoma mammario (Camacho et al., 2015).Nel complesso, le analisi collettive dei risultati di questi studi in fase iniziale(meta-analisi) stanno iniziando a suggerire un effetto generalmente positivo quando la metformina viene aggiunta alle terapie standard per il cancro (Rahmani etal., 2019; Zhang et al., 2019b).
Una serie di sperimentazioni “finestra di opportunità” stanno studiando se l’assunzione di metforminfor circa due settimane prima dell’intervento chirurgico può contribuire a migliorare i marcatori molecolari della malattia in pazienti con carcinoma mammario operabile in fase iniziale. I risultati di questi studi suggeriscono generalmente che l’assunzione di metformina può portare a cambiamenti potenzialmente positivi nei marcatori molecolari del cancro, compresi quelli che regolano la crescita e la divisione delle cellule tumorali del seno (Bonanni et al., 2012; Cazzaniga et al., 2013; Hadad et al., 2011; Kalinsky et al., 2014; Niraula etal., 2012), oltre a migliorare potenzialmente la regolazione diormoni e altri fattori per alcuni pazienti (Kalinsky et al., 2014; Niraula et al., 2012). Questi studi stanno ora aiutando gli scienziati a capire esattamente come e quando la metformina potrebbe aiutare i pazienti con cancro al seno (Bonanni etal., 2012; DeCensi et al., 2014, 2015; Rahmani et al., 2019).
Phase2 Gli studi “neoadiuvanti” sono generalmente studi più lunghi e complessi che esaminano la metformina insieme a cicli di trattamenti standard per trattare diversi tipi di cancro al seno. Lo scopo di questi studi è stabilire se la metformina aiuta davvero a migliorare l’efficacia dei trattamenti standard, suggeriscono gli studi aslab (Kim et al., 2014). In uno studio recente (lo studio METTEN) (Martin-Castillo etal., 2018), nelle donne con carcinoma mammario in stadio precoce HER2 positivo, più pazienti che assumevano metformina hanno risposto bene alla chemioterapia/trattamento mirato (65,5%) rispetto ai pazienti che non assumevano metformina (58,6%). Questa differenza non era statisticamente significativa; il che significa che questo risultato poteva essere raggiunto per caso. Tuttavia, gli studi di fase 2 sono generalmente sottodotati per raggiungere la significatività statistica in questo modo, e i ricercatori hanno chiesto la progressione verso studi di fase 3 più ampi che possono essere progettati correttamente per determinare quanto sia reale questo effetto (Martin-Castillo etal., 2018). Sono stati riportati anche risultati potenzialmente incoraggianti da altri triali di fase 2, come uno in individui in sovrappeso con carcinoma mammario metastatico (Yam et al.,2019). Vale anche la pena notare che, come previsto, non tuttigli studi sul cancro alla metformina hanno riportato risultati positivi. Ad esempio, altri studi di fase 2 hanno riscontrato che la metformina con terapia standard non aveva alcuna differenza reale rispetto alla terapia standard da sola in determinate circostanze (Mark et al.,2019; Nanni et al., 2019). Crediamo che la metformina sarà più efficace in qualsiasi ambiente quando somministrata in combinazione con altri farmaci anti-metabolici.
Sono necessari studi più ampi per aiutare a risolvere questi problemi e ora è in corso uno studio di fase 3 per studiare la metformina nel cancro al seno. Sebbene il trial non debba essere completato fino al 2020, i risultati iniziali dei primi 6 mesi di trial hanno mostrato che i pazienti che hanno iniziato a prendere metformina immediatamente dopo il completamento della chirurgia e dei cicli chemioterapici standard avevano favorablechanges in un marker molecolare del cancro al seno (Dowling et al., 2018), andimproved metabolic factors (Goodwin et al., 2015).
Statine e cancro al seno
Studi osservativi collegano le statine a migliori risultati di cancro al seno
Le statine vengono solitamente somministrate per aiutare a gestire le malattie cardiovascolari. Tuttavia, studi osservazionali su grandi gruppi di persone che assumono statine hanno anche scoperto che gli individui con cancro al seno che assumono statine possono anche avere un rischio ridotto del loro cancro ricorrente dopo il trattamento, rispetto ai pazienti che non assumono statine (Ahern et al., 2014; Manthravadi et al., 2016). Ad esempio, in uno studio su quasi 2000 sopravvissuti al cancro al seno, coloro che hanno iniziato a prendere macchie entro tre anni dalla diagnosi hanno avuto una ridotta possibilità che il loro cancro tornasse indietro (Kwan et al., 2008). In un altro studio, solo 6 mesi di utilizzo di statine post-diagnosi sono stati collegati a tassi di recidiva migliorati (Chae et al., 2011).
È importante sottolineare che l’effetto benefico delle statine in questi e in altri studi è stato più fortemente collegato a statine “lipofile” più liposolubili (come l’atorvastatina). In alcuni studi di laboratorio, le statine lipofile hanno anche dimostrato di avere effetti antitumorali superiori a livello cellulare rispetto alle statine meno liposolubili (Liu et al., 2017).
Studi osservativi collegano anche l’uso di statine a una migliore risposta della malattia al trattamento e alla sopravvivenza in pazienti con cancro al seno, anche per pazienti con tipi di cancro al seno che possono essere più aggressivi (Manthravadi et al., 2016; Murtola et al., 2014; Zhong et al., 2015). Per esempio, in uno studio in pazienti con carcinoma mammario infiammatorio, i pazienti che assumevano atorvastatina durante il trattamento per il cancro avevano un periodo di tempo più lungo prima che la loro malattia progredisse, rispetto a quelli che non assumevano una statina (Brewer et al., 2013).
Statinstarget cellule di cancro al seno
le Statine,in particolare solubili nei grassi lipofile statine come atorvastatina, ridurre alla crescita e all’divisione di cellule di cancro al seno e aumento di cellule di cancro al seno morte inlaboratory studi
tedesco Associazione diabetici”,”page”:”47-48″,”volume”:”111″,”numero”:”1″,”source”:”PubMed”,”abstract”:”Theeffect di cinque statine, cioè atorvastatina, fluvastatina, lovastatina, pravastatinand simvastatin è stato studiato sulla proliferazione di umano breastcancer linea cellulare MCF-7. Tutte le statine ad eccezione della pravastatina sono state in grado di inibire la proliferazione cellulare fino al 90% ad una concentrazione di 50 micro M. Tra le statine efficaci non è stata osservata alcuna differenza significativa che indicasse un effetto specifico della classe. Questi dati suggeriscono che le statine possono avere clinicalsignificance nella prevenzione primaria di cancro al seno umano oltre il loro effetto di abbassamento del colesterolo. Tuttavia, la prova clinica deve essere attesa primadisegnando ulteriori conclusioni.”, “DOI”:”10.1055/s-2003-37501″,”ISSN”:”0947-7349″,”note”:”PMID: 12605351″,”journalAbbreviation”: “Exp. Clin. Endocrinolo.Diabetes”, “language”: “eng”,”author”:,”issued”: {“date-parts”:]}}}],”schema”:”https://github.com/citation-style-language/schema/raw/master/csl-citation.json”} (Alarcon Martinez etal., 2018; Mück et al., 2004; Seeger et al., 2003).Gli studi dimostrano anche che le statine possono potenzialmente bloccare l’invasività delle cellule del cancro al seno in laboratorio, suggerendo che possono anche aiutare a rallentare la diffusione del cancro in altre parti del corpo (Kanugula et al., 2014; Wolfe et al., 2015). In un modello murino di carcinoma mammario metastatico, lo statintreatment ha ritardato la crescita del cancro che si era già diffuso fino all ‘ 80%, con attività benefica notata entro una settimana dall’inizio del trattamento (Vintonenko et al.,2012).
Altri studi mostrano anche che le statine possono aiutare a sensibilizzare le cellule del cancro al seno ai trattamenti standard di radioterapia e chemioterapia (Kozar et al., 2004; Van Wyhe et al., 2017). Uno studio ha trovatoimvastatina potrebbe sensibilizzare cellule di cancro al seno triple negative o infiammatorie alla radioterapia in laboratorio. Lo stesso studio ha continuato a osservare in una popolazione di pazienti che le donne con cancro al seno infiammatorio che assumevano statine durante il loro trattamento avevano meno possibilità che il loro cancro tornasse entro 3 anni (Lacerda et al., 2014).
Simile alla metformina, le statine possono produrre questi effetti antitumorali attraverso diversi tipi di cancro al seno, tra cui ER positivo, HER2 positivo e triplo-negativocancro al seno. In effetti alcuni studi di laboratorio mostrano che le statine sono particolarmente efficaci contro le cellule di cancro al seno triple negative (Campbell et al., 2006; Yao et al., 2017).
Clinicaltrials che studiano le statine in cancro al seno sono ora in corso
Un fewearly-fase di studi clinici ora mostrano risultati decisamente positivi in termini di statine nel cancro al seno. Gli studi “finestra di opportunità” di fase iniziale hannoinvestigato se le statine precoci e pre-chirurgiche possono contribuire a migliorare i marcatori molecolari della malattia nei pazienti con malattia operabile. Finora questi studi hanno dimostrato che i profili molecolari del cancro migliorati in pazienti con trattamento con statine, suggerendo che atorvastatina e altre statine in questo contesto possono avere effetti benefici sulla crescita e sulla divisione delle cellule tumorali e sulla morte cellulare, anche nelle donne con tumori più aggressivi di alto grado (Bjarnadottir et al., 2013, 2015; Feldt et al., 2015; Garwood et al., 2010).
Sulla base di questi risultati promettenti, sono in corso una serie di studi di fase 2 che indagano statine articolari per una varietà di diversi tipi di cancro al seno, incluso il cancro al seno triplice-negativo. Questi studi dovrebbero aiutarestabilire come le statine possono aiutare i pazienti con cancro al seno.
Mebendazolo e cancro al seno
Interesse per mebendazolacome un potenziale trattamento antitumorale si basa principalmente su promettenti studi meccanici e rapporti convincenti da casi di studio in pazienti oncologici (Nygren e Larsson,2014; Pantziarka et al., 2014).
Si pensa che Mebendazolo uccida le cellule tumorali in parte interrompendo strutture speciali all’interno della cellula, chiamate microtubuli (Pantziarka et al.,2014). Funziona in modo simile alla vincristina, farmaco di achemoterapia attualmente utilizzato per il trattamento di alcuni tipi di cancro,tra cui il cancro al seno in stadio avanzato (De Witt et al., 2017).
Studi sulle cellule tumorali al seno coltivate in laboratorio mostrano che il mebendazolo e i farmaci correlati della stessa classe (chiamati benzimidazoli) possono rallentare la crescita e la divisione di diversi tipi di cellule tumorali al seno, comprese le cellule resistenti alla chemioterapia (Coyne et al., 2013; Hou et al., 2015; Mukhopadhyay et al., 2002). In uno studio, il mebendazolo ha potentemente ridotto la sopravvivenza delle cellule tumorali del seno resistenti alla chemioterapia di ben il 63,1% (Coyne et al., 2013).Gli studi hanno anche dimostrato una robusta attività antitumorale dei benzimidazoli contro il carcinoma mammario triplo negativo (Hou et al., 2015; Zhang et al., 2015). È importante sottolineare che in uno studio è stato anche rilevato un benzimidazolo per colpire direttamente le cellule staminali del cancro al seno(Hou et al., 2015).
Emerginglaboratory-based evidence also suggests that benzimidazoles can enhance theactivity of standard breast cancer treatments such as doxorubicin andfluorouracil(Hou et al., 2015). In uno studio di laboratorio, il mebendazolo ha aumentato l’efficacia della radioterapia sulle cellule tumorali al seno triple-negative e ha impedito la resistenza allo sviluppo del trattamento (Zhang et al.,2019a). Inoltre, una serie di studi utilizzando cellule di cancro al seno ER/HER2 positive resistenti alla chemioterapia coltivate in laboratorio, ha costantemente dimostrato che il mebendazolo non solo ha ridotto la sopravvivenza delle cellule tumorali, ma ha anche contribuito a integrare e migliorare l’attività di forme mirate di chemioterapia per il cancro al seno epirubicina e gemcitabina (Coyne et al., 2014,2012, 2013).
Doxiciclina e cancro al seno
Asidefrom essendo un antibiotico efficace, doxiciclina possiede anche altre proprietà estremamente preziose, tra cui attività anti-infiammatoria e antitumorale. Thisgives doxiciclina reale potenziale terapeutico nel trattamento di una serie di otherdiseases, compreso il cancro (Bahrami et al., 2012).
Studi di laboratorio e studi sugli animali hanno da tempo dimostrato che la doxiciclina può bloccare la crescita, la divisione e il movimento delle cellule del seno (Duivenvoorden et al., 2002; Fife e slitta, 1995, 1998).Studi più recenti mostrano anche che la doxiciclina può impedire alle cellule tumorali di riparare il loro DNA quando viene danneggiato, ad esempio, dalla chemioterapia (Peiris-Pagès et al.,2015). In effetti, studi di laboratorio dimostrano che la doxiciclina può aiutaremigliorare l’efficacia dell’attività chemioterapica contro le cellule del cancro al seno (Foroodi et al., 2009; Lamb et al., 2015a).
Più di recente, l’attenzione è caduta sulla comprensione di come la doxiciclina possa bloccare la crescita delle cellule staminali del cancro al seno (Ozsvari etal., 2017; Zhang et al., 2017). Avery recente studio sulle cellule coltivate in laboratorio ha dimostrato che doxiciclina canblock crescita di cellule staminali cancro al seno sia HER2 positivo e triplo-negativo, e ha contribuito a migliorare i cambiamenti legati alla resistenza indotti dalla paclitaxel standardchemotherapy (Lin et al.,2018). In un diverso studio di laboratorio, un approccio combinatorialecompresa la doxiciclina ha sradicato molto efficacemente le cellule staminali del cancro al seno (Fiorillo etal., 2019).
La doxiciclina ha appena raggiunto i primi studi clinici in pazienti affetti da cancro al seno. I risultati del primo piccolo studio, pubblicato nell’ottobre 2018, mostrano che i pazienti con carcinoma mammario in fase iniziale che hanno assunto doxiciclina per soli 14 giorni prima della chirurgia hanno ridotto i livelli di marcatori molecolari per la presenza di cellule staminali tumorali in media di circa il 40%. Gli effetti benefici sono stati notati per tutti, tranne uno dei pazienti trattati (8/9) (Scatena et al., 2018).Sono ora in corso studi clinici più ampi.
Le nostre prove: Lo studio delle METRICHE
Che cosa sono le METRICHE?
METRICS è il nostro programma di ricerca interno. Molto è già noto sulla sicurezza eefficacia dei farmaci del protocollo COC nel cancro. Ma è anche nostra responsabilità riconoscere che non abbiamo tutte le risposte e che dobbiamo ancora generare una ricerca clinica di buona qualità che indaghi il COCProtocol nei pazienti con cancro, per garantire che il protocollo COC sia il più efficace e sicuro possibile.
Per permetterci di finanziare questa ricerca, abbiamo sviluppato un nuovo sistema economico in cui il nostro studio clinico, le METRICHE, è essenzialmente “finanziato dal paziente”. Ogni paziente consenziente che entra nella clinica èiscritto in METRICHE e queste tasse stanno aiutando a finanziare lo studio. Si tratta di un nuovo modello di ricerca clinica, volto a colmare le lacune di finanziamento e di dati che attualmente ostacolano il riutilizzo e l’ulteriore sviluppo clinico di farmaci già autorizzati.
METRICHE primi risultati
In un primo successo forMETRICS, i risultati del nostro studio pilota iniziale sono stati recentemente pubblicati sulla rivista scientifica Frontiers in Pharmacology. Il papercan è accessibile liberamente online qui.
Lo studio pilota METRICS era uno studio retrospettivo osservazionale, il che significa che i nostri ricercatori hanno guardato indietro e analizzato le cartelle cliniche dei pazienti per scoprire cosa è successo. Hanno raccolto dati e registrato i risultati di 95 pazienti con un tipo avanzato di cancro al cervello chiamato glioblastoma che hanno frequentato la clinica oncologica di cura e che hanno preso il protocollo COC completo insieme ai loro soliti trattamenti standard. Questo studio non aveva un gruppo di controllo, quindi i nostri ricercatori hanno confrontato i risultatida METRICHE con risultati precedentemente pubblicati da studi precedenti in pazienticon lo stesso tipo di cancro e che hanno anche preso trattamenti standard di cura.
I risultati iniziali suggeriscono che i pazienti che hanno frequentato la nostra clinica e hanno preso il protocollo COC come parte della loro assistenza abituale avevano molte più probabilità di sopravvivere almeno 2 anni (64.lo 0% dei pazienti nel nostro studio è sopravvissuto ad almeno 2 anni, rispetto al 27-29% per i pazienti inclusi negli studi pubblicati in precedenza), e tendeva ad avere tempi di sopravvivenza più lunghi nel complesso di quelli normalmente previsti per i pazienti con questo tipo di cancro (i pazienti sono sopravvissuti in media a 27 mesi nel nostro studio, rispetto a 15-16 mesi negli studi precedenti) (Agrawalet al., 2019).
Questi risultati sono estremamente promettenti, ma sono anche ancora preliminari. Non sappiamo ancora esattamente come il protocollo COC possa aver influito sui tempi di sopravvivenza, ad esempio, o come altri fattori come alcune caratteristiche del paziente possano aver influenzato anche questi risultati. Ma questa prima prova iniziale è certamente incoraggiante e ci suggerisce che stiamo andando nella giusta direzione. Il nostro prossimo plannedstage è quello di condurre uno studio più ampio e ben progettato. Puoi saperne di più supiani di METRICHE future guardando online o contattando la clinica.
Maggiori informazioni sul protocollo COC
Che cos’è il protocollo COC?
Il protocollo COC è un regime di trattamento combinato composto da farmaci autorizzati, specificallydesigned by Care Oncology per uso aggiuntivo accanto ai trattamenti usuali di un paziente (cioè standard-of-care).
I quattro farmaci inclusi nel regime del protocollo COC sono: metformina, un farmaco anti-diabete molto comune; atorvastatina, un tipo di statina usata per gestire le condizioni cardiovascolari; doxiciclina, un tipo di antibiotico spesso usato per trattare infezioni croniche come l’acne; e mebendazolo, amedicina comunemente usata per trattare le infezioni parassitarie nei bambini e negli adulti.
Abbiamo scelto questi fourmedications da migliaia di candidati potenziali specificamente perché theyfit i nostri criteri di selezione predeterminati. Questi criteri includono prove solide dell’efficacia contro il cancro, un meccanismo d’azione coerente e, in particolare, un buon profilo di sicurezza. Questi tre principi centrali hanno plasmato il nostroapproccio fin dall’inizio.
La sicurezza è fondamentale
Il cancroè una malattia complessa con trattamenti complessi e crediamo che l’aggiunta di ulteriori terapie accanto ai trattamenti standard debba essere valutata con molta attenzione. Non solo dal punto di vista dell’efficacia, ma anche,soprattutto, in termini di sicurezza. Questo è il motivo per cui tutto il nostro approccio si basa su prove – studi scientifici per lo più pubblicati, e anche, sempre più, i nostri dati.
Molti farmaci diversi sul mercato hanno almeno alcune prove pubblicate a sostegno del loro uso relativamente efficace nel cancro, ma pochi di questi farmaci hanno il livello di prove sia di sicurezza che di efficacia che erano richieste per il protocollo COC. Esistono già grandi quantità di dati dettagliati per ciascuno dei farmaci del protocollo, raccolti da anni di utilizzo nella popolazione generale – e questo ha contribuito a darci un vantaggio cruciale durante lo sviluppo.
Abbiamo accuratamente cercato attraverso decenni di dati pubblicati su ciascuno dei farmaci del protocollo COC, esplorando come funzionano in diverse popolazioni di pazienti (compresi i pazienti con cancro) e su modelli cellulari e animali in laboratorio. Questi dati, insieme alla nostra esperienza clinica, aiutano a garantire che abbiamo una buona comprensione di come questi farmaci si comporteranno in pazienti con diversi stadi e tipi di cancro, entrambi in combinazione tra loro e anche in combinazione con numerose altre terapie antitumorali. Questa conoscenza isparamount, e dai nostri studi, questo tipo di prove non è solo lì yetfor molti altri candidati di farmaci antitumorali off‑label – soprattutto quando dato incombination.
Terapia anti-metabolica che può potenzialmente colpire qualsiasi cancro
Il protocollo COC è progettato per funzionare limitando la capacità complessiva delle cellule tumorali di assorbire e utilizzare (cioè “metabolizzare”) energia.
Le cellule tumorali hanno bisogno di enormi quantità di energia per sopravvivere e la stragrande maggioranza dei tumori utilizza un processo adattivo chiamato glicolisi aerobica per generare l’energia eccessiva di cui hanno bisogno (Kroemer andPouyssegur, 2008). Ciascuno dei farmaci nel protocollo può indirizzare i vari processi metabolici molecolari coinvolti nella glicolisi aerobica e circostante, e questo può aiutare a ridurre il tasso metabolico complessivo del cancercell (Jang et al.,2013).
Crediamo che i farmaci COCProtocol possano funzionare in combinazione per limitare costantemente l’offerta e l’uso di energia, impedendo allo stesso tempo alle cellule tumorali di adattarsi e utilizzare altri percorsi per assorbire energia (Jagust et al.,2019). Di conseguenza, le cellule tumorali diventano sempre più deboli e meno in grado di assorbire e utilizzare i nutrienti (ad es. come glucosio ed essenzialeammino acidi glutammina e arginina) di cui hanno bisogno dall’ambiente circostante (Andrzejewskiet al., 2018; Liu et al., 2016).Questo rende più difficile nel complesso per le cellule tumorali di sopravvivere, crescere, e spreadin il corpo. A poco a poco, le cellule indebolite (comprese le cellule più resistenti e precedentemente resistenti al trattamento) diventano più vulnerabili all’attacco daaltre terapie antitumorali che uccidono le cellule come radioterapia,chemioterapia, terapia ormonale e terapie mirate (Bradford andKhan, 2013; Chen et al., 2012; Lacerda et al., 2014; Lamb et al., 2015a; Pantziarka et al., 2014).
Considerando i meccanismi metabolici adattati che sono comuni alla maggior parte dei tumori(ma di solito non le cellule sane), riteniamo che il protocollo COC possa essere efficace e selettivo per praticamente qualsiasi cancro indipendentemente dal tipo specifico,dallo stadio o dalla posizione del cancro. Studi epidemiologici e di laboratorio pubblicati supportano sempre più la gamma potenzialmente ampia di questa terapia (Chae et al.,2015, 2016; Iliopoulos et al., 2011; Lamb et al., 2015b; Pantziarka et al.,2014).
Coerenza meccanicistica in azione – il potere della combinazione
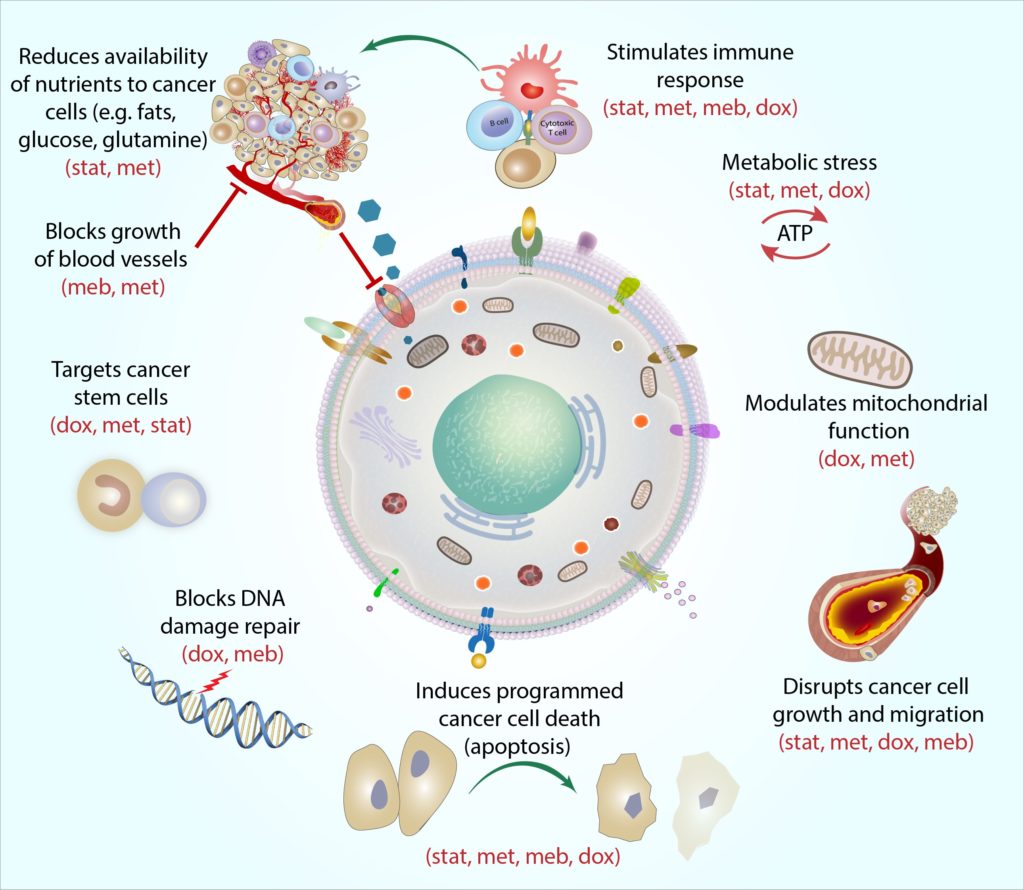
Il vero potere del Protocollo COC risiede nella specifica combinazione di farmaci che usiamo. Abbiamo sviluppato il protocollo non solo come un regime di quattro trattamenti individuali ciascuno con attività antitumorale, ma anche per lavorare come un singolo trattamento combinato – con il potenziale di produrre potenti effetti sinergici (Mokhtari et al., 2017).
Ogni farmaco nel Protocollo COC mira al metabolismo delle cellule tumorali in modo distinto e complementare, e abbiamo definito questa azione “coerenza meccanicistica”. Putsimply, la coerenza meccanicistica descrive come ogni farmaco può attaccare la cellula del cancro da una diversa angolazione. Per esempio, le cellule staminali del cancro sono aparticularly resiliente tipo di cellule di cancro, e ogni farmaco obiettivi thesecells in un modo diverso: la metformina obiettivi della cella ‘batterie’ (calledmitochondria), rendendo molto difficile per i mitocondri per eseguire il molecularreactions di cui hanno bisogno per produrre energia, doxycycline blocchi il cell-DNAmachinery che i mitocondri hanno bisogno di replicare e di riparazione (Skoda et al., 2019), le statinipuò alterare l’espressione genica delle cellule staminali del cancro, rendendo le cellule più sensibili ad altre terapie contro il cancro (Kodach et al., 2011), andmebendazole può interrompere numerosi processi molecolari coinvolti nella divisione cellulare per aiutare a bloccare la crescita delle cellule staminali del cancro (Hothi et al., 2012; Hou et al., 2015).
Combinando insieme tutti e quattro gli agenti, il protocollo COC può colpire le cellule staminali tumorali (e altre cellule tumorali) su più “punti deboli”, e come un pugno uno-due, questo lascia le cellule meno in grado di schivare e recuperare.
Gli studi di laboratorio stanno iniziando a evidenziare l’efficacia di questo approccio utilizzando combinazioni di farmaci COCprotocol. In uno studio meccanicistico, la combinazione di statinae metformina ha notevolmente ridotto la crescita delle cellule tumorali della prostata più dell’agente da solo (Wang et al., 2017). Studi osservazionali hanno anche riportato effetti potenzialmente ‘sinergici’ di questi farmaci contro vari tipi di cancro (Babcook etal., 2014; Danzig et al., 2015; Lehman et al., 2012; Nimako et al., 2017). Aclinical trial indagare metformina e doxiciclina nel cancro al seno è nowunderway (NCT02874430), e il nostro programma di ricerca, METRICS, è ora alsobeginning per produrre dati promettenti.
Una terapia aggiuntiva a lungo termine
Il protocollo COC è progettato principalmente per essere una terapia aggiuntiva a lungo termine, per aiutare a ottimizzare i trattamenti standard. Tuttavia, poiché il trattamento metabolico con il Cocprotocolo è destinato a durare a lungo termine, i pazienti possono anche assumere il protocollo come regime di mantenimento dopo che il trattamento standard è stato completato o durante le pause dal trattamento standard e come parte di una strategia a lungo termine per mitigare il rischio di recidiva o metastasi. Per questo motivo, vale anche la pena notare cheognuno dei farmaci del protocollo COC ha anche riportato meccanismi benefici di azione nel cancro che non dipendono dalla co-somministrazione di terapie standard e che possono aiutare indipendentemente a ridurre il rischio di recidiva e diffusione metastatica.
Il modello Care Oncology
Controllo medico attivo di ciascun paziente
Sebbene i farmaci COCProtocol siano stati usati in modo sicuro nella popolazione generale per moltianni, ogni paziente che viene da noi è unico. Questo è il motivo per cui ogni paziente cheattende la clinica oncologica di cura è posto sotto la cura diretta dei clinicicon conoscenze specialistiche di prescrivere i farmaci del protocollo COC nelcontesto del cancro. I nostri medici valutano individualmente i potenziali benefitsand rischi coinvolti nel prendere il protocollo COC con ogni paziente. Raccomanderanno solo il protocollo COC ai pazienti quando ritengono che sarà sicuro e utile farlo. Ogni prescrizione del protocollo COC è adattata alle esigenze del paziente, e le dosi e i regimi sono attentamente esaminati e regolati in base al modo in cui il paziente progredisce.
È quindi essenziale che i pazienti assumano solo il protocollo COC mentre vengono attentamente monitorati presso la nostra clinica per tutta la durata del loro trattamento.
*********************************************************************************
Avviso Importante
Scopo di questo articolo
Thisarticle è una panoramica di alcune delle informazioni scientifiche e mediche publishedliterature riguardanti i farmaci che compongono il sistema brevettato di Cura Oncologyprotocol. La cura è stata presa per selezionare gli articoli pertinenti che sostengono l’uso del theoff-label di questi medicinali in una regolazione clinica per il trattamento di adjuncttreatment del cancro. Questo articolo non pretende di essere una revisione completa di tutte le prove, né cattura tutti i potenziali effetti collaterali di tale trattamento.
Questo articolo è solo a scopo informativo e NON costituisce medicaladvice. Le medicine discusse qui sono disponibili su prescrizione-soltanto andshould non è preso senza consultazione con il Suo dottore o altro fornitore di assistenza sanitaria professionale. I medici di Oncologia di cura discuteranno l’idoneità di questi farmaci con Lei e si metteranno in contatto con il Suo dottore o oncologo todiscuss la loro idoneità per Lei.
NON devi fare affidamento sulle informazioni contenute in questo articolo come alternativa a medicaladvice dal tuo medico o altro fornitore di assistenza sanitaria professionale. Se hai domande specifiche su qualsiasi questione medica, dovresti consultare il tuo medico o un altro operatore sanitario professionale. Se si pensa che si può essere sufferingfrom qualsiasi condizione medica si dovrebbe consultare immediatamente un medico. Yousshould mai ritardare la ricerca di un consiglio medico, ignorare il consiglio medico, ordiscontinue trattamento medico a causa delle informazioni contenute in questo articolo.
Copyright
Il copyright in questoarticolo è di proprietà di Health Clinics LLC e dei suoi licenziatari.
Brevetto
Il protocollo Care Oncology(“COC”) è protetto dal brevetto statunitense US9622982B2 e da vari brevetti internazionali aggiuntivi.
*********************************************************************************
Agrawal,S., Vamadevan, P., Mazibuko, N., Bannister, R., Swery, R. Wilson, S., andEdwards, S. (2019). Un nuovo metodo per la generazione di prove etiche ed efficientiper l’uso di farmaci off-label in oncologia (un caso di studio nel glioblastoma). Anteriore.Pharmacol. 10.
Ahern, TP, Lash, TL, Damkier, P., Christiansen,P. M., e Cronin-Fenton, DP (2014). Statine e prognosi del cancro al seno: prove e opportunità. Lancet Oncol. 15, e461-468.
Aksoy, S., Sendur, M. A. N., e Altundag, K. (2013).Caratteristiche demografiche e clinico-patologiche in pazienti con cancro al seno invasivo che ricevono metformina. Med. Oncol. Northwood Lond. Ingl. 30, 590.
Alarcon Martinez, T., Zeybek, ND, e Müftüoğlu, S.(2018). Valutazione degli effetti citotossici e autofagici dell’atorvastatina sulle cellule tumorali mammarie MCF-7. Esitano. Med. J. 35, 256-262.
Alimova, I. N., Liu, B., Fan, Z., Edgerton, S. M.,Dillon, T., Lind, S. E., e Thor, A. D. (2009). La metformina inibisce la crescita delle cellule del cancro al seno, la formazione di colonie e induce l’arresto del ciclo cellulare in vitro. Cella 8, 909-915.
Andrzejewski, S., Siegel, p. M., e St-Pierre, J. (2018). Profili metabolici associati all’efficacia della metformina nel cancro. Anteriore.Endocrinolo. 9.
Babcook, M. A., Shukla, S., Fu, P., Vazquez, E. J.,Puchowicz, M. A., Molter, J. P., Oak, C. Z., MacLennan, G. T., Flask, C. A.,Lindner, D. J., et al. (2014). Combinazione sinergica di simvastatina e metforminachemoterapia per carcinoma prostatico metastatico resistente alla castrazione ossea. Mol.Cancro Ther. 13, 2288–2302.
Bahrami, F., Morris, DL, e Pourgholami, MH(2012). Tetracicline: farmaci con enorme potenziale terapeutico. Mini Rev. Med.Chimica. 12, 44–52.
Bao, B., Azmi, AS, Ali, S., Zaiem, F., e Sarkar,F. H. (2014). La metformina può funzionare come agente antitumorale tramite il targeting delle cellule del cancro: il potenziale significato biologico dei miRNA associati al tumore nei tumori del seno e del pancreas. Ann. Trasl. Med. 2.
Bjarnadottir, O., Romero, Q., Bendahl, P.-O., Jirström, K., Rydén, L., Loman, N., Uhlén, M., Johannesson, H., Rose, C., Grabau, D., etal. (2013). Mirare alla HMG-CoA reduttasi con statine in uno studio sul cancro al seno. Cancro al seno Res. Treat. 138, 499–508.
Bjarnadottir, O., Kimbung, S., Johansson, I., Veerla,S., Jönsson, M., Bendahl, P.-O., Grabau, D., Hedenfalk, I., e Borgquist, S.(2015). Cambiamenti trascrizionali globali dopo il trattamento con statine in BreastCancer. Clin. Cancer Res. Off. J. Am. Assoc. Cancro Res. 21, 3402-3411.
Bonanni, B., Puntoni, M., Cazzaniga, M., Pruneri, G., Serrano, D., Guerrieri-Gonzaga, A., Gennari,A., Trabacca, M. S., Galimberti, V., Veronesi, P., et al. (2012). Doppio effetto della metformina sul cancro al senoproliferazione in uno studio presurgico randomizzato. J. Clin. Oncol. Fuori. J. Am.Soc. Clin. Oncol. 30, 2593–2600.
Bradford, SA, e Khan, A. (2013). Il nostro sito utilizza cookie tecnici e di terze parti per migliorare la tua esperienza di navigazione. J. Cancro Sci. Ther. 5.
Brewer, T. M., Masuda, H., Liu, D. D., Shen, Y., Liu,P., Iwamoto, T., Kai, K., Barnett, C. M., Woodward, W. A., Reuben, J. M., et al.(2013). Uso di statine nel carcinoma mammario infiammatorio primario: uno studio di coorte. Fr.J. Cancro 109, 318-324.nel 2015 è stato pubblicato il primo album in studio della band. Metformina nel cancro al seno-un mistero in evoluzione. Cancro al seno Res. BCR 17, 88.
Campbell, M. J., Esserman, L. J., Zhou, Y., Calzolaio,M., Lobo, M., Borman, E., Baehner, F., Kumar, AS, Adduci, K., Marx, C., etal. (2006). Prevenzione della crescita del cancro al seno da parte delle statine. Cancro Res. 66,8707–8714.
Cazzaniga, M., DeCensi, A., Pruneri, G., Puntoni, M., Bottiglieri, L., Varricchio, C., Guerrieri-Gonzaga, A., Gentilini, O. D., Pagani, G., Dell’Orto, P., et al. (2013). L’effetto della metformina sull’apoptosiin uno studio pre-chirurgico per il cancro al seno. Fr. J. Cancro 109, 2792-2797.
Chae, YK, Valsecchi, M. E., Kim, J., Bianchi, A. L.,Khemasuwan, D., Desai, A., e Tester, W. (2011). Riduzione del rischio di cancro al senoricorrenza in pazienti che usano ACE-inibitori, ARB e/o statine. CancerInvest. 29, 585–593.
Chae, YK, Yousaf, M., Malecek, M.-K., Carneiro, B.,Chandra, S., Kaplan, J., Kalyan, A., Sassano, A., Platanias, L. C., e Giles,F. (2015). Statine come terapia anti-cancro; Possiamo tradurre i dati preclinici ed epidemiologici in benefici clinici? Discov. Med. 20, 413–427.
Chae, YK, Arya, A., Malecek, M.-K., Shin, DS,Carneiro, B., Chandra, S., Kaplan, J., Kalyan, A., Altman, JK, Platanias, L.,et al. (2016). Riproporre la metformina per il trattamento del cancro: studi clinici attuali. Oncotarget 7, 40767-40780.
Chen, J., Lan, T., Hou, J., Zhang, J., An, Y., Tie,L., Pan, Y., Liu, J., e Li, X. (2012). Atorvastatin sensibilizza i carcinomi del polmone di humannon-piccole cellule a carboplatino via la soppressione di upregulation e di activationand di AKT di TIMP-1. Int. J. Biochimica. Biol cellulare. 44, 759–769.
Chen, L., Chubak, J., Boudreau, D. M., Barlow, W. E.,Weiss, N. S., e Li, CI (2017). Trattamenti per il diabete e rischi di esiti di cancro AdverseBreast tra i pazienti con cancro al seno in fase iniziale: un VEGGENTE-MedicareAnalysis. Cancro Res. 77, 6033-6041.
Chen, T., Liang, Y., Feng, D., Tao, L., Qi, K., Zhang,H., Wang, H., Lin, Q., e Kong, H. (2013). Metformina inibisce proliferationand promuove l’apoptosi delle cellule di cancro al seno HER2 positivi da downregulatingHSP90. J. BUON Via. J. Balk. Unione Oncol. 18, 51–56.
Coyne, C., Jones, T., e Bear, R. (2014).Citotossicità anti-neoplastica di gemcitabina – (C4-ammide)-induale-combinazione con epirubicina – (C3-ammide)-contro adenocarcinoma mammario resistente alla chemioterapia (SKBr-3) e ileffetto complementare di mebendazolo. J. Cancer Res. Ther. Oncol. 2.
Coyne, CP, Jones, T., e Orso, R. (2012). Influenza degli inibitori alternativi della tubulina sulla potenza di aepirubicina-Immunochemotherapeutic sintetizzato con un intermedio Ultra VioletLight attivato. Cancro Clin. Oncol. 1, 49–80.
Coyne, CP, Jones, T. e Orso, R. (2013).Gemcitabine-(C4-amide)- Anti-Neoplastic Cytotoxicity in DualCombination with Mebendazole against Chemotherapeutic-Resistant MammaryAdenocarcinoma. J. Clin. Exp. Oncol. 2.
Cufi, S., Corominas-Faja, B., Vazquez-Martin, A.,Oliveras-Ferraros, C., Dorca, J., Bosch-Barrera, J., Martin-Castillo, B., andMenendez, J.A. (2012). Metformin-induced preferential killing of breast cancerinitiating CD44+CD24-/low cells is sufficient to overcome primary resistance totrastuzumab in HER2+ human breast cancer xenografts. Oncotarget 3, 395–398.
Danzig, M.R., Kotamarti, S., Ghandour, R.A. Nel 2015 è stato pubblicato il primo album in studio della band, “The World”.Sinergismo tra metformina e statine nel modificare il rischio di biochemicalrecurrence a seguito di prostatectomia radicale negli uomini con diabete. ProstateCancer Prostatic Dis. 18, 63–68.Nel 2017 è stato pubblicato il primo album in studio della band, “The World”, pubblicato nel 2017. Metformininibisce lo sviluppo e promuove la resensibilizzazione del cancro al seno resistente al trattamento. PLoS UNO 12.
De Witt, M., Gamble, A., Hanson, D., Markowitz, D., Powell, C., Al Dimassi, S., Atlas, M., Boockvar, J., Ruggieri, R.,e Symons, M. (2017). Riproporre il mebendazolo come sostituto della vincristina per iltrattamento dei tumori cerebrali. Mol. Med. 23, 50–56.
DeCensi, A., Puntoni, M., Gandini, S.,Guerrieri-Gonzaga, A., Johansson, H. A., Cazzaniga, M., Pruneri, G., Serrano,D., Schwab, M., Hofmann, U., et al. (2014). Effetti differenziali della proliferazione del cancro al seno metforminon secondo marcatori di insulino-resistenza e sottotipo tumorale in uno studio presurgico randomizzato. Cancro al seno Res. Treat. 148,81–90.
DeCensi, A., Puntoni, M., Guerrieri-Gonzaga, A., Cazzaniga, M., Serrano, D., Lazzeroni, M., Vingiani, A., Gentilini, O., Petrera, M., Viale, G., et al. (2015). Effetto della metformina sulla proliferazione in situ del DuttalCarcinoma mammario in uno studio presurgico randomizzato. Cancro Indietro.Res. Phila. Papà 8, 888-894.
Deng, X.-S., Wang, S., Deng, A., Liu, B., Edgerton, S. M., Lind, S. E., Wahdan-Alaswad, R., e Thor, A. D. (2012). La metformina mira a Stat3 per inibire la crescita cellulare e indurre apoptosi in mammelle triple negative. Ciclo cellulare Georget. Tex 11, 367-376.
Dowling, R. J., Parulekar, W. R., Gelmon, K. A.,Shepherd, L. E., Virk, S., Ennis, M., Mao, F., Ligibel, J. A., Hershman, DL, Rastogi, P., et al. (2018). CA15-3 / MUC1 in CCTG MA-32 (NCT01101438): Una fase III RCT dell’effetto della metformina rispetto al placebo sulla sopravvivenza invasiva libera da malattia e globale nel carcinoma mammario in fase iniziale (BC). J. Clin. Oncol.
Duivenvoorden, W. C. M., Popović, S. V., Lhoták, S., Seidlitz,E., Hirte, H. W., Tozer, R. G., e Singh, G. (2002). La doxiciclina riduce il carico tumorale in un modello di metastasi ossee del cancro al seno umano. Cancro Res. 62,1588–1591.nel 2014 è stato pubblicato il primo album in studio del gruppo musicale statunitense El-Benhawy, pubblicato nel 2014.Metformina e sopravvivenza in pazienti diabetici con cancro al seno. J. Egitto.Salute Pubblica Assoc. 89, 148–153.
Feldt, M., Bjarnadottir, O., Kimbung, S., Jirström,K., Bendahl, P.-O., Veerla, S., Grabau, D., Hedenfalk, I. e Borgquist, S.(2015). Effetti anti-proliferativi indotti da statine tramite ciclina D1 e p27 in uno studio sul cancro al seno di una certa opportunità. J. Trasl. Med. 13, 133.
Fife, RS, e Sledge, GW (1995). Effetti didossiciclina sulla crescita in vitro, sulla migrazione e sull’attività della gelatinasi delle cellule del carcinoma mammario. J. Lab. Clin. Med. 125, 407–411.
Fife, R. S., e Sledge, GW (1998). Effetti didossiciclina sulle cellule tumorali in vitro e in vivo. Adv. Dent. Res. 12, 94-96.
Fiorillo, M., Tóth, F., Sotgia, F., e Lisanti, M. P.(2019). Doxiciclina, azitromicina e vitamina C (DAV): una potente terapia combinata per mirare ai mitocondri e sradicare le cellule staminali tumorali (CSCs).Invecchiamento 11, 2202-2216.
Foroodi, F., Duivenvoorden, W. C., e Singh, G. (2009). Interazioni di doxiciclina con agenti chemioterapici in cellule di adenocarcinoma MDA-MB-231 del seno umano. Antitumorale. Droga 20, 115-122.
Garwood, E. R., Kumar, AS, Baehner, F. L., Moore, D. H., Au, A., Hylton, N., Fiori, CI, Garber, J., Lesnikoski, B.-A., Hwang, E. S., et al. (2010). Fluvastatina riduce la proliferazione e aumentaapoptosi nelle donne con alto gradocancro al seno. Cancro al seno Res. Treat. 119, 137–144.
Giles, E. D., Jindal, S., Wellberg, E. A., Schedin, T.,Anderson, S. M., Thor, A. D., Edwards, D. P., MacLean, PS, e Schedin, P.(2018). La metformina inibisce l’espressione stromale dell’aromatasi e la progressione tumorale in un modello di roditore del cancro al seno postmenopausale. Cancro al seno Res. BCR 20.
Goodwin, P. J., Parulekar, W. R., Gelmon, K. A.,Shepherd, L. E., Ligibel, J. A., Hershman, DL, Rastogi, P., Mayer, IA, Hobday, T. J., Lemieux, J., et al. (2015). Effetto della metformina vs placebo su fattori etabolici in NCIC CTG MA.32. J. Natl. Cancro Inst. 107.
Hadad, S., Iwamoto, T., Jordan, L., Purdie, C., Bray,S., Baker, L., Jellema, G., Deharo, S., Hardie, D. G., Pusztai, L., et al.(2011). Prove per gli effetti biologici della metformina nel cancro al seno operabile: uno studio preoperatorio, finestra di opportunità, randomizzato. Cancro al seno Res. Treat. 128, 783–794.
Hadad, S. M., Hardie, D. G., Appleyard, V., andThompson, A. M. (2014). Effetti della metformina sulla proliferazione cellulare del cancro al seno, sulla via AMPK e sul ciclo cellulare. Clin. Trasl. Oncol. Fuori.Publ. Stufo. Campata. Oncol. Soc. Natl. Cancro Inst. Mex. 16, 746–752.
Hatoum, D., e McGowan, E. M. (2015). Recenti avanzinell’uso di metformina: il trattamento del diabete può prevenire il cancro al seno? Biomedri. Int. 2015, 548436.
Hirsch, H. A., Iliopoulos, D., Tsichlis, P. N., andStruhl, K. (2009). La metformina mira selettivamente alle cellule staminali del cancro e ageinsieme alla chemioterapia per bloccare la crescita del tumore e prolungare la remissione. CancerRes. 69, 7507–7511.
Hothi, P., Martins, TJ, Chen, L., Deleyrolle, L., Yoon, J.-G., Reynolds, B., e Foltz, G. (2012). Chimica ad alto rendimento Gli schermi identificano il Disulfiram come inibitore delle cellule staminali di glioblastoma umano.Oncotarget 3, 1124-1136.
Hou, Z.-J., Luo, X., Zhang, W., Peng, F., Cui, B., Wu,S.-J., Zheng, F.-M., Xu, J., Xu, L.-Z., Long, Z.-J., et al. (2015).Flubendazole, antielmintico approvato dalla FDA, mira alle cellule staminali del cancro al seno.Oncotarget 6, 6326-6340.
Iliopoulos, D., Hirsch, H. A., e Struhl, K. (2011).Metformina diminuisce la dose di chemioterapia per prolungare la remissione del tumore inmouse xenotrapianti che coinvolgono più tipi di cellule tumorali. Cancro Res. 71,3196–3201.
Jacob, L., Kostev, K., Rathmann, W. e Kalder, M.(2016). Impatto della metformina sulle metastasi in pazienti con cancro al seno egabete di tipo 2. J. Complicazioni del diabete 30, 1056-1059.
Jagust, P., de Luxán-Delgado, B., Parejo-Alonso, B.,e Sancho, P. (2019). Strategie terapeutiche basate sul metabolismo mirate alle cellule tumorali. Anteriore. Pharmacol. 10.nel 2013 si trasferisce in Italia. Cellule canceremetabolismo: implicazioni per gli obiettivi terapeutici. Scad. Mol. Med. 45, e45.
Jiralerspong, S., Palla, S. L., Giordano, S. H.,Meric-Bernstam, F., Liedtke, C., Barnett, C. M., Hsu, L., Hung, M.-C.,Hortobagyi, G. N., e Gonzalez-Angulo, A. M. (2009). Metformina e risposte patologiche complete alla chemioterapia neoadiuvante in pazienti diabetici con cancro al seno. J. Clin. Oncol. 27, 3297–3302.
Kalinsky, K., Crew, K. D., Refice, S., Xiao, T., Wang,A., Feldman, S. M., Taback, B., Ahmad, A., Cremers, S., Hibshoosh, H., et al.(2014). Trial presurgico di metformina in pazienti in sovrappeso e obesi concancro al seno appena diagnosticato. Cancro Investire. 32, 150–157.
Kanugula, A. K., Gollavilli, P. N., Vasamsetti, S. B.,Karnewar, S., Gopoju, R., Uchanni, R., e Kotamraju, S. (2014). L’inibizione indotta da statina della proliferazione e dell’invasione del cancro al seno comporta l’attenuazione del trasporto di ferro: intermediazione dell’ossido nitrico e meccanismi di difesa antiossidanti. FEBS J. 281, 3719-3738.Per questo motivo, è stato creato un sito web dedicato alla creazione di siti web e di siti web. (2015). Metforminaaumenta la sopravvivenza nel cancro al seno positivo al recettore ormonale, HER2-positivopazienti con diabete. Cancro al seno Res. BCR 17, 64.
Kim, J., Lim, W., Kim, E.-K., Kim, M.-K., Paik, N.-S.,Jeong, S.-S., Yoon, J.-H., Park, C. H., Ahn, S. H., Kim, L. S., et al. (2014).Fase II studio randomizzato di neoadiuvante metformina più letrozolo contro placeboplus letrozolo per il recettore degli estrogeni positivo postmenopausa cancro al seno (METEOR). Cancro BMC 14, 170.
Kodach, L. L., Jacobs, R. J., Voorneveld, P. W.,Wildenberg, M. E., Verspaget, H. W., van Wezel, T., Morreau, H., Hommes, D. W., Peppelenbosch, MP, van den Brink, GR, et al. (2011). Le statine aumentano la chemosensibilità delle cellule tumorali del colon-retto inducendo la riprogrammazione epigenetica e riducendo la “stemness” delle cellule tumorali del colon-retto attraverso la via morfogenetica delle proteine ossee. Gut 60, 1544-1553.
Kozar, K., Kaminski, R., Legat, M., Kopec, M., Nowis,D., Skierski, J., Koronkiewicz, M., Jakóbisiak, M., e Golab, J. (2004).Cerivastatina dimostra una maggiore attività antitumorale contro le linee cellulari del cancro al seno umano quando usato in combinazione con doxorubicina o cisplatino. Int.J. Oncol.Kroemer, G., e Pouyssegur, J. (2008). Tumor CellMetabolism: il tallone d’Achille del cancro. Cellula tumorale 13, 472-482.nel 2008 è stato pubblicato il primo album in studio del gruppo. Post-diagnosi uso di statine e cancro al senorecurrence in uno studio prospettico di coorte di cancro al seno in fase precoce. Cancro al seno Res. Treat. 109, 573–579.
Lacerda, L., Reddy, J. P., Liu, D., Larson, R., Li, L.,Masuda, H., Brewer, T., Debeb, B. G., Xu, W., Hortobágyi, G. N., et al. (2014).La simvastatina radiosensibilizza le linee cellulari differenziate e simili a staminali del cancro al seno ed è associata a un migliore controllo locale in pazienti con cancro al seno infiammatorio trattati con radiazioni postmastectomia. Cellule staminali Transl. Med.3, 849–856.
Lamb, R., Fiorillo, M., Chadwick, A., Ozsvari, B.,Reeves, K. J., Smith, DL, Clarke, R. B., Howell, S. J., Cappello, A. R.,Martinez-Outschoorn, U. E., et al. (2015a). Doxiciclina down-regola il DNA-PKand radiosensibilizza le cellule che iniziano il tumore: implicazioni per una terapia di irradiazione più efficace. Oncotarget 6, 14005-14025.
Lamb, R., Ozsvari, B., Lisanti, C. L., Tanowitz, H. B., Howell, A., Martinez-Outschoorn, U. E., Sotgia, F., e Lisanti, MP (2015b).Gli antibiotici che mirano ai mitocondri sradicano efficacemente le cellule staminali tumorali, attraverso più tipi di tumore: trattare il cancro come una malattia infettiva.Oncotarget 6, 4569-4584.Lehman, D. M., Lorenzo, C., Hernandez, J., e Wang, C. (2012). Uso della statina come moderatore dell’effetto della metformina sul rischio di ProstateCancer tra i pazienti diabetici di tipo 2. Diabetes Care 35, 1002-1007.
Lin, C., Lo, M., Moody, R., Stevers, N., Tinsley, S.,e Sun, D. (2018). La doxiciclina si rivolge al cancro al seno positivo all’aldeide deidrogenasi. Oncol. Il suo nome deriva dal greco antico, che significa “Liu”, “Liu”, “Liu”, “Liu”, “Liu”, “Liu”, “Liu”, “Liu”, “Liu”, “Liu”, “Liu”, “Liu”, “Liu”, “Liu”, “Liu”, “Liu”, “Liu”, “Liu”, “Liu”, “Liu”, “Liu”. La relazione tra statine e prognosi del cancro al seno varia datipo di statina e tempo di esposizione: una meta-analisi. Cancro al seno Res. Treat. 164,1–11.
Liu, H., Scholz, C., Zang, C., Schefe, JH, Habbel,P., Regierer, A.-C., Schulz, C.-O., Possinger, K., e Eucker, J. (2012).La metformina e l’inibitore mTOR everolimus (RAD001) sensibilizzano il cancro al senole cellule all’effetto citotossico dei farmaci chemioterapici in vitro. AnticancerRes. 32, 1627–1637.
Liu, X., Romero, I. L., Litchfield, L. M., Lengyel, E.,e Locasale, J. W. (2016). La metformina si rivolge al metabolismo centrale del carbonio e soddisfa i requisiti mitocondriali nei tumori umani. Metab cellulare. 24, 728–739.
Ma, J., Guo, Y., Chen, S., Zhong, C., Xue, Y., Zhang,Y., Lai, X., Wei, Y., Yu, S., Zhang, J., et al. (2014). Metformina enhancestamoxifen-mediata inibizione della crescita tumorale nel carcinoma mammario ER-positivo. BMCCancer 14, 172.
Manthravadi, S., Shrestha, A. e Madhusudhana, S.(2016). Impatto dell’uso di statine sulla recidiva del cancro e sulla mortalità nel senocancro: una revisione sistematica e meta-analisi. Int. J. Cancro 139, 1281-1288.
Mark, M., Klingbiel, D., Mey, U., Winterhalder, R.,Rothermundt, C., Gillessen, S., von Moos, R., Pollak, M., Manetsch, G.,Strebel, R., et al. (2019). Impatto dell’aggiunta di metformina ad Abiraterone in pazienti affetti da carcinoma prostatico metastatico resistente alla castrazione con progressione della malattia durante il trattamento con Abiraterone (MetAb-Pro): Fase 2 Pilotstudia. Clin. Genitourina. Cancro 17, e323–e328.
Martin-Castillo, B., Pernas, S., Dorca, J., A. S., A. S., A. S., A. S., A. S.,A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., A. S., et al. (2018). Uno studio di fase 2 di metformina neoadiuvante in combinazione con trastuzumab e chemioterapia in donne con carcinoma mammario precoce HER2-positivo: lo studio METTEN. Oncotarget 9.35687-35704.Mokhtari, R. B., Homayouni, T. S., Baluch, N.,Morgatskaya, E., Kumar, S., Das, B., e Yeger, H. (2017). Terapia combinata che combatte il cancro. Oncotarget 8, 38022-38043.Mück, A. O., Seeger, H., e Wallwiener, D. (2004).Effetto inibitorio delle statine sulla proliferazione del cancro al seno umano cells.Int J. Clin. Pharmacol. Ther. 42, 695–700.
Mukhopadhyay, T., Sasaki, J., Ramesh, R., e Roth,J. A. (2002). Mebendazole suscita un potente effetto antitumorale sulle cellule tumorali umane Sia in vitro che in vivo. Clin. Cancro Res. 8, 2963-2969.
Murtola, TJ, Visvanathan, K., Artama, M., Vainio,H., e Pukkala, E. (2014). Uso di statine e sopravvivenza del cancro al seno: uno studio a livello nazionalecohort dalla Finlandia. PLoS Uno 9, e110231.
Nanni, O., Amadori, D., De Censi, A., Rocca, A., Freschi, A., Bologna, A., Gianni, L., Rosetti, F., Amaducci, L., Cavanna,L., et al. (2019). Metformina più chemioterapia rispetto alla chemioterapia da sola nel trattamento di prima linea del carcinoma mammario metastatico HER2-negativo. Lo studio clinico MYMErandomized, fase 2. Cancro al seno Res. Treat. 174, 433–442.
Nimako, GK, Wintrob, ZAP, Sulik, DA, Donato,JL, e Ceacareanu, A. C. (2017). Beneficio sinergico delle neoplasie gastrointestinali di statina e metforminina. J. Pharm. Pratt. 30, 185–194.
Niraula, S., Dowling, R. J. O., Ennis, M., Chang, M. C.,Done, S. J., Hood, N., Escallon, J., Leong, W. L., McCready, DR, Reedijk, M., et al. (2012). Metformina nel cancro al seno precoce: una finestra prospettica diopportunità studio neoadiuvante. Cancro al seno Res. Treat. 135, 821–830.
Nygren, P., e Larsson, R. (2014). Riposizionamento del farmacodal banco al capezzale: remissione del tumore da parte del farmaco antielmintico mebendazolein tumore metastatico refrattario al colon. Acta Oncol. 53, 427–428.
Orecchini, S., Reggiani, F., Talarico, G., Mancuso,P., Calleri, A., Gregato, G., Labanca, V., Noonan, D. M., Dallaglio, K., Albini,A., et al. (2015). Le biguanidi metformina e fenformina inibitangiogenesi, crescita locale e metastatica del cancro al seno prendendo di mira le cellule bothneoplastic e microenvironment. Int. J. Cancro 136, E534-544.
Ozsvari, B., Sotgia, F., e Lisanti, MP (2017). Nuovo approccio mutation-independent alla terapia del cancro: Inibendo RAS oncogenici e MYC, mirando alla biogenesi mitocondriale. Invecchiamento 9, 2098-2116.
Pantziarka, P., Bouche, G., Meheus, L., Sukhatme,V., e Sukhatme, V.P. (2014). Repurposing Farmaci in Oncologia (ReDO)—mebendazole asan agente anti-cancro. Ecancermedicalscience 8.
Peiris-Pagès, M., Sotgia, F., e Lisanti, M. P. (2015). Doxiciclina e targeting terapeutico della risposta al danno del DNA inle cellule tumorali: vecchio farmaco, nuovo scopo. Oncoscience 2, 696-699.Nel 2019 è stato pubblicato il primo album in studio della band, “The World”, pubblicato nel 2019. L’effetto della metformina sui biomarcatori associati al cancro al senosi verifica: una revisione sistematica, meta-analisi e dose–risposta di studi clinici randomizzati. Clin. Trasl. Oncol.
Scatta, C., Roncella, M., Di Paolo, A., Aretini, P., Menicagli, M., Fanelli, G., Marini, C., Mazzanti, C. M., Ghilli, M., Sotgia,F., et al. (2018). Doxiciclina,un inibitore della biogenesi mitocondriale, riduce efficacemente le cellule staminali tumorali (CSCs) nei pazienti con cancro al seno precoce: Studio pilota aclinico. Anteriore. Oncol. 8.
Seeger, H., Wallwiener, D., e Mueck, A. O. (2003).Le statine possono inibire la proliferazione delle cellule di cancro al seno umano in vitro. Scad.Clin. Endocrinolo. Diabete spento. J. Ger. Soc. Endocrinolo. Ger. Diabetes Assoc.111, 47–48.nel 2019 è stato pubblicato il primo album in studio della band, intitolato””, pubblicato nel 2019. Obiettivo farmacologico dei mitocondri nelle cellule staminali tumorali: un antico organello al crocevia delle nuove terapie anticancro. Pharmacol. Res. 139, 298-313.
Sonnenblick, A., Agbor-Tarh, D., Bradbury, I., DiCosimo, S., Azim, H. A., Fumagalli, D., Sarp, S., Wolff, A. C., Andersson, M.,Kroep, J., et al. (2017). Impatto del diabete, dell’insulina e dell’uso di metformina sull’uscita dei pazienti con cancro al seno del recettore del fattore di crescita epidermico umano 2–PositivePrimary: Analisi dallo studio randomizzato di fase III di ALTTO. J. Clin. Oncol. 35, 1421–1429.
Van Wyhe, R. D., Rahal, O. M., e Woodward, W. A. (2017). Effetto delle statine sulla recidiva e sulla mortalità del cancro al seno: una revisione.Il cancro al seno si rivolge a Ther. 9, 559–565.
Vazquez-Martin, A., Oliveras-Ferraros, C., Cufí, S.,Del Barco, S., Martin-Castillo, B., Lopez-Bonet, E., e Menendez, J. A. (2011).La metformina della droga antidiabetica sopprime il proteinCD24 metastasi-associato in MDA-MB-468 cellule di cancro al seno triplo-negative. Oncol. Rep. 25.135–140.
Vintonenko, N., Jais, J.-P., Kassis, N., Abdelkarim,M., Perret, G.-Y., Lecouvey, M., Crepin, M., e Di Benedetto, M. (2012).Analisi del trascrittoma e attività in vivo di fluvastatina rispetto a zoledronicacid in un modello di metastasi del carcinoma mammario murino. Mol. Pharmacol. 82, 521–528.
Wahdan-Alaswad, R. S., Cochrane, D. R., Spoelstra, N. S.,Howe, E. N., Edgerton, S. M., Anderson, S. M., Thor, A. D., e Richer, J. K.(2014). L’uccisione indotta da metformina delle cellule di cancro al seno triple-negative è mediata dalla riduzione della sintasi degli acidi grassi tramite miRNA-193b. Horm. Cancro 5.374–389.
Wang, Z.-S., Huang, H.-R., Zhang, L.-Y., Kim, S., Lui,Y., Li, D.-L., Farischon, C., Zhang, K., Zheng, X., Du, Z.-Y., et al. (2017).Studio meccanicistico degli effetti inibitori di metformina e atorvastatina incombinazione sulle cellule tumorali della prostata in vitro e in Vivo. Biol. Farmaceutica. Toro.40, 1247–1254.
Wolfe, A. R., Debeb, B. G., Lacerda, L., Larson, R.,Bambhroliya, A., Huang, X., Bertucci, F., Finetti, P., Birnbaum, D., Van Laere,S., et al. (2015). Simvastatina previene il cancro al seno triplo negativometastasi nei modelli pre-clinici attraverso la regolazione di FOXO3a. Cancro al seno. Trattare. 154, 495–508.
Xu, H., Chen, K., Jia, X., Tian, Y., Dai, Y., Li,D., Xie, J., Tao, M., e Mao, Y. (2015). L’uso di metformina è associato a megliosupervival dei pazienti con cancro al seno con diabete: una meta-analisi. TheOncologist 20, 1236-1244.
Yam, C., Esteva, F. J., Patel, M. M., Raghavendra, AS,Ueno, N. T., Moulder, S. L., Hess, K. R., Shroff, G. S., Hodge, S., Koenig, K. H.,et al. (2019). Efficacia e sicurezza della combinazione di metformina, everolimusand exemestane in pazienti postmenopausali sovrappeso e obesi con carcinoma mammario metastatico, positivo al recettore ormonale, HER2-negativo: uno studio di fase II.Investire. Nuovi farmaci 37, 345-351.
Yao, H., Lui, G., Yan, S., Chen, C., Song, L., Rosol, T.J., e Deng, X. (2017). Cancro al seno triplo negativo: c’è un trattamentosull’orizzonte? Oncotarget 8, 1913-1924.nel 2015 è stato pubblicato il primo album in studio della cantante. Scoperta basata sulla biologia dei sistemi di un potenziale atg4bagonista (Flubendazolo) che induce l’autofagia nel cancro al seno. Mol. Biosist.11, 2860–2866.
Zhang, L., Xu, L., Zhang, F., e Vlashi ,E. (2017).La doxiciclina inibisce il fenotipo delle cellule staminali del cancro e la transizione epiteliale-mesenchimale nel cancro al seno. Ciclo cellulare Georget. Tex16, 737-745.
Zhang, L., Bochkur Dratver, M., Yazal, T., Dong, K., Nguyen, A., Yu, G., Dao, A., Bochkur Dratver, M., Duhachek-Afoso, S., Bhat,K., et al. (2019a). Mebendazolo potenzia la radioterapia nel triplo negativocancro al seno. Int. J. Radiat. Oncol. Biol. Phys. 103, 195–207.
Zhang, Y., Storr, S. J., Johnson, K., Verde, A. R.,Rakha, EA, Ellis, I. O., Morgan, D. A. L., e Martin, S. G. (2014). Coinvolgimento di metformina e AMPK nella risposta radiologica e nella prognosi del carcinoma mammario luminal versusbasal-simile trattato con radioterapia. Oncotarget 5, 12936-12949.
Zhang, Z.-J., Yuan, J., Bi, Y., Wang, C., e Liu, Y.(2019b). L’effetto della metformina sui biomarcatori e sulle sopravvivenze per il cancro al seno-una revisione sistematica e una meta-analisi di studi clinici randomizzati. Pharmacol.Res. 141, 551-555.
Zhong, S., Zhang, X., Chen, L., Ma, T., Tang, J., andZhao, J. (2015). Uso di statine e mortalità nei pazienti oncologici: revisione sistematicae meta-analisi di studi osservazionali. Trattamento del cancro. Apoc 41, 554-567.
