egy vegyület empirikus képlete megmondja a legkisebb egész szám arányt az említett vegyületet alkotó elemek között.
Ez azt jelenti, hogy az empirikus képletre úgy gondolhatunk, mint a molekula egyfajta építőelemére.
a vegyület empirikus képletét tekintve, # ” CH ” _2 “O”#, tudod, hogy szükséged van
- egy szénatom
- két hidrogénatom
- egy oxigénatom
ahhoz, hogy elkezdhesd építeni ezt a molekulát. Az Ön feladata most annak meghatározása, hogy hány ilyen építőelemre van szükség a vegyület molekuláris képletének megszerzéséhez.
vegye figyelembe, hogy ismeri a vegyület moláris tömegét. A moláris tömeg megmondja, hogy mekkora a vegyület egy móljának teljes tömege.
Ez azt jelenti, hogy ha kiszámítja az építőelem moláris tömegét, akkor a molekula teljes moláris tömegével meghatározhatja, hogy hány épületblokkra van szüksége.
az empirikus képlet Moláris tömegének megszerzéséhez használja az egyes atomok moláris tömegét
#overbrace(1 xx “12,011 g/mol”)^(Szín(Kék)(“egy mol C”)) + overbrace(2 xx “1,00794 g/mol”)^(Szín(Zöld)(“két MOL H”)) + overbrace(1 xx “15,9994 g/mol”)^(Szín(Piros)(“egy mol o”)) = “30.03 g / mol” #
tehát egy építőelem moláris tömege #” 30,03 g/mol”#, a molekula moláris tömege pedig #”180,2 g/mol”#. Ez azt jelenti, hogy van
# 30.03 Szín(Piros)(Mégse(Szín(Fekete) (“g/mol”))) * szín(kék)(n) = 180.2 Szín(Piros)(Mégse(Szín(Fekete) (“g/mol”)))#
#szín(kék)(n) = 180.2/30.03 = 6.0007 ~~ 6#
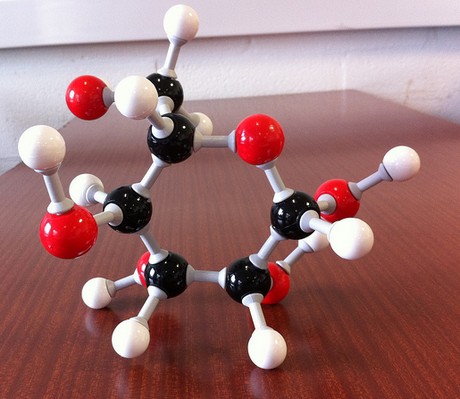
The molecular formula of the compound will thus be
#(“CH”_2″O”)_color(blue)(6) implies “C”_6″H”_12″O”_6 -># glucose