The COC Protocol™ in Breast Cancer
Este documento es un resumen de los fundamentos y algunas de las pruebas científicas actuales que respaldan el uso de los medicamentos del Protocolo de COC junto con los tratamientos estándar de atención para el cáncer de mama. Entendemos que el cáncer es una condición muy personal, y cada paciente tiene un conjunto único de desafíos. Para obtener más información sobre su situación personal, comuníquese con la Clínica de Oncología de Care al 800-392-1353 en los Estados Unidos, o visite el sitio web en https://careoncology.com.
Si es nuevo en Care Oncology, tenga en cuenta lo siguiente:
- No necesita viajar. Puede reunirse con nuestro equipo de oncólogos y enfermeras oncológicas a través de un video seguro para obtener apoyo continuo.
- Los medicamentos de protocolo adjunto de Oncología de atención se envían directamente a su hogar desde nuestras farmacias asociadas en Estados Unidos y se pueden usar junto con su tratamiento de atención estándar.
- Estamos increíblemente orgullosos de anunciar que hemos superado el proceso de validación extremadamente riguroso del Instituto de Validación de análisis de datos, declaraciones de resultados y cálculo de valor. Hemos trabajado duro para llegar a este punto. Al principio, reconocimos el enorme valor de un programa entregado responsablemente de medicamentos reutilizados que se ofrecía a los pacientes con cáncer, sin embargo, no se ofrecía a escala. Hace cuatro años, nos propusimos cambiar esto sabiendo que era un maratón, no un sprint.
El Protocolo COC y el cáncer de mama: Puntos clave
- El COCProtocol es una combinación de cuatro medicamentos recetados comúnmente(atorvastatina, metformina, mebendazol y doxiciclina) con el potencial de apuntar al cáncer de mama y ayudar a mejorar la eficacia de las terapias anticancerosas estándar.
- Varios estudios observacionales han relacionado el uso de metformina o estatina para mejorar los resultados en pacientes con cáncer de mama.
- Los estudios de laboratorio sobre células de cáncer de mama cultivadas en platos muestran que la metformina y las estatinas pueden atacar y dañar directamente las células de cáncer de mama, debilitándolas y haciéndolas más vulnerables a los tratamientos estándar.
- Los resultados de pequeños ensayos clínicos de «ventana de oportunidad» en pacientes con cáncer de mama operable generalmente muestran que tomar metformina o estatinas antes de la cirugía puede provocar cambios potencialmente positivos en los marcadores moleculares de cáncer, incluidos los que regulan el crecimiento y la división de las células cancerosas de mama. Se están realizando más ensayos para investigar si la metformina o las estatinas pueden afectar la respuesta a la enfermedad.
- La doxiciclina puede bloquear el crecimiento de células madre de cáncer de mama tanto HER2 positivo como triple negativo incubadas en platos en el laboratorio, y ayudó a mejorar los cambios relacionados con la resistencia inducidos por la quimioterapia estándar paclitaxel.
- La doxiciclina acaba de llegar a los primeros ensayos clínicos en pacientes con cáncer de mama. Los resultados del primer estudio pequeño muestran que las pacientes con cáncer de mama en estadio temprano que tomaron doxiciclina durante solo 14 días antes de la cirugía redujeron los niveles de marcadores moleculares de la presencia de células madre cancerosas en un promedio de alrededor del 40%. Se observaron efectos beneficiosos para todos menos uno de los pacientes tratados (8/9).
- El mebendazolecano ralentiza el crecimiento y la división de las células de cáncer de mama que crecen en el laboratorio,incluidas las células de cáncer de mama que son más resistentes a la quimioterapia. Se necesitan más estudios humanos.
El protocolo de AOC y el cáncer de mama: Pruebas publicadas
El Protocolo COC es un régimen combinado de cuatro medicamentos recetados comúnmente,cada uno con pruebas de actividad anticancerígena de base metabólica y perfiles de seguridad bien entendidos. Estos medicamentos son: metformina, atorvastatina,doxiciclina y mebendazol. A continuación se presentan algunos de los estudios que apoyan el uso del Protocolo de la OCC como terapia adyuvante junto con los tratamientos estándar actuales para el cáncer de mama. Esta evidencia proviene principalmente de estudios de laboratorio, estudios epidemiológicos grandes (que investigan los vínculos entre la toma de medicamentos y los resultados del cáncer de mama en grupos de individuos) y ensayos clínicos en etapas tempranas.
Puede notar que muchos de los estudios a continuación solo se centran en las Medicaciones individuales del Protocolo COC. Somos los primeros en diseñar una terapia complementaria que combina cuatro. Creemos que la combinación de estos medicamentos logrará los mayores resultados, y nuestro propio programa de investigación, llamado MÉTRICAS, ya está produciendo más de la evidencia necesaria para demostrar esto. Puede leer más sobre por qué creemos que estos medicamentos funcionan tan bien juntos para ayudar a combatir el cáncer, y sobre el programa de medición en sí, en las secciones siguientes.
Metformina y cáncer de mama
Metformina asociada a posibles beneficios para el cáncer de mama
En la actualidad, muchos estudios de observación proporcionan pruebas que respaldan el uso de metformina en el cáncer de mama. La metformina está autorizada para tratar la diabetes tipo 2, y los estudios observacionales en grupos de pacientes con diabetes tienden a mostrar que los que toman metformina tienen mejores probabilidades de un mejor resultado si desarrollan cáncer de mama (Aksoy et al., 2013; El-Benhawy y El-Sheredy, 2014; Sonnenblick et al., 2017).El uso de metformina se ha relacionado con una mejor supervivencia en pacientes con cáncer de mama (Kim et al., 2015; Xuet al., 2015), mejor respuesta al tratamiento del cáncer de mama (Jiralerspong et al.,2009), y menos probabilidades de que el cáncer de mama se propague y recaiga (Chen et al., 2017; Jacob et al., 2016).
Es probable que parte del efecto beneficioso de la metformina encontrado en estos estudios se deba a la capacidad de la metformina para mejorar la diabetes y/o el peso de una paciente al reducir los niveles de glucosa, lo que puede ayudar a reducir el riesgo de desarrollar cáncer de mama, y mejorar la salud y la capacidad de una paciente para abordar el cáncer de mama si lo tiene (Hatoum y McGowan,2015). Pero los estudios de laboratorio también muestran que la metformina está haciendo más que esto. De hecho, la metformina puede actuar directamente contra las células cancerosas de mama, reduciendo su capacidad de absorber y utilizar energía, y bloqueando su capacidad de crecer, diseminarse, sobrevivir y recaer (Alimova et al., 2009; Hadad et al., 2014; Orecchioni et al., 2015).
Los diferentes tipos de cáncer de mama requieren diferentes tratamientos. El trastuzumab, por ejemplo, se usa específicamente para tratar el cáncer de mama positivo al receptor 2 del factor de crecimiento epidérmico humano (HER2). El tamoxifeno es eficaz contra el cáncer de mama positivo a receptores de estrógeno (ER). Es importante destacar que los estudios de células cancerosas en el laboratorio demuestran que la metformina tiene actividad anticancerígena contra muchos tipos de células de cáncer de mama diferentes, incluso el ER positivo (Giles et al., 2018), HER2 positivo (Chen et al., 2013), y subtipos potencialmente más difíciles de tratar, como las células cancerosas triple negativas (Deng et al., 2012; Vázquez-Martin et al., 2011; Wahdan-Alaswad et al., 2014).Esto significa que la metformina tiene el potencial de funcionar eficazmente junto con tratamientos estándar para el cáncer de mama, independientemente del subtipo de cáncer.
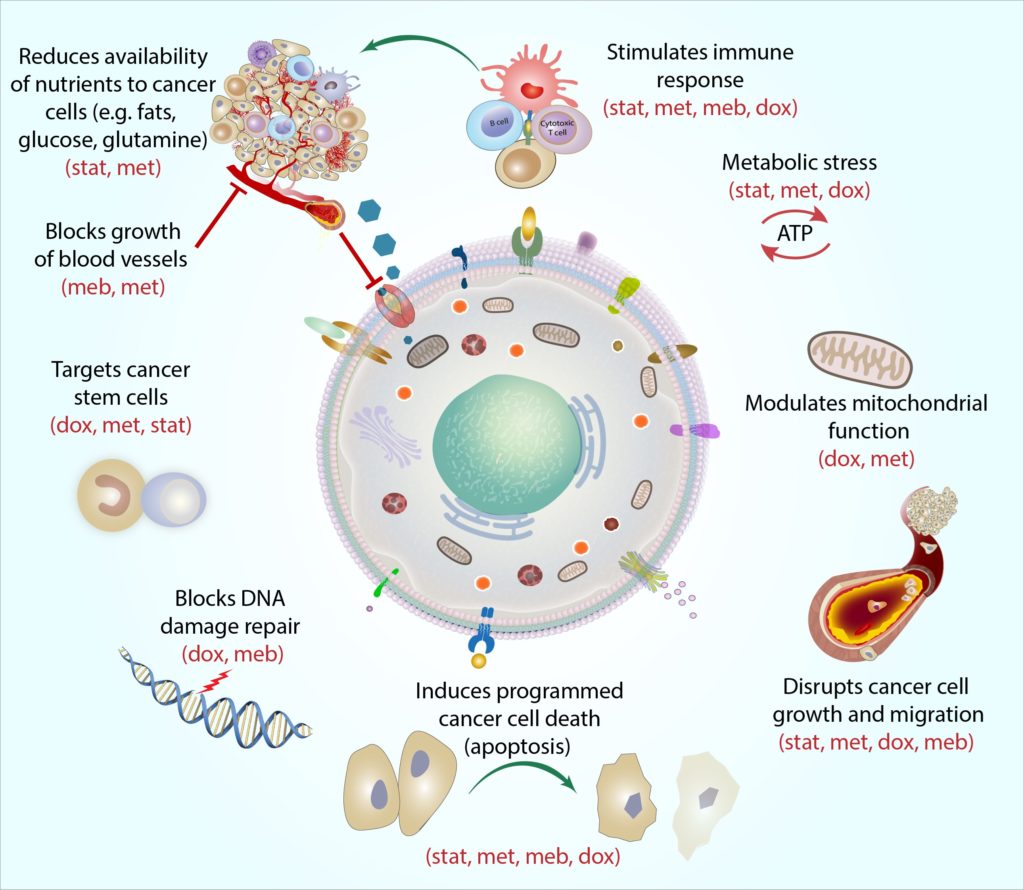
Metformin también se ha demostrado que se dirige a las células madre del cáncer de mama (Bao et al., 2014; Cufiet al., 2012; Hirsch et al., 2009).Esta actividad contra las células madre del cáncer de mama, junto con su capacidad para seleccionar diferentes subtipos de cáncer de mama, ayudan a explicar por qué los estudios de laboratorio muestran que puede funcionar en combinación con una serie de tratamientos estándar, incluido el trastuzumab (Cufi et al., 2012), tamoxifeno (Ma et al., 2014), y agentes quimioterapéuticos estándar (Iliopoulos et al.,2011). Los estudios en animales y células muestran que la metformina ayuda a mejorar la eficacia de los tratamientos estándar (Bradford y Khan,2013; Liu et al., 2012; Zhang et al., 2014) y también retrasa la recaída de cánceres que han sido tratados con estas terapias (Iliopoulos et al.,2011).
Además, los estudios de laboratorio también muestran que la metformina también puede ayudar a evitar que las células del cáncer de mama se vuelvan resistentes a la quimioterapia y mejorar la sensibilidad de las células cancerosas ya resistentes al tratamiento (Davies et al., 2017).
La metformina mejora los marcadores del cáncer de mama en los primeros estudios clínicos
Como resultado de la gran cantidad de datos de apoyo para la metformina en el cáncer de mamagenerados por estudios observacionales y de laboratorio, se están llevando a cabo varios ensayos clínicos de investigación de la metformina en el cáncer de mama (Camacho et al., 2015).En general, los análisis colectivos de los resultados de estos ensayos en estadio inicial(metanálisis) están comenzando a sugerir un efecto generalmente positivo cuando se agrega metformina a las terapias estándar para el cáncer (Rahmani etal., 2019; Zhang et al., 2019b).
Una serie de ensayos de «ventana de oportunidad» están investigando si tomar metformina durante unas dos semanas antes de la cirugía puede ayudar a mejorar los marcadores moleculares de la enfermedad en pacientes con cáncer de mama en estadio temprano operable. Los resultados de estos estudios generalmente sugieren que la ingesta de metformina puede producir cambios potencialmente positivos en los marcadores moleculares del cáncer, incluidos los que regulan el crecimiento y la división de las células cancerosas más recientes (Bonanni et al., 2012; Cazzaniga et al., 2013; Hadad et al., 2011; Kalinsky et al., 2014; Niraula etal., 2012), así como mejorar potencialmente la regulación de hormonas y otros factores para algunos pacientes (Kalinsky et al., 2014; Niraula et al., 2012). Estos estudios están ayudando a los científicos a comprender exactamente cómo y cuándo la metformina podría ayudar a los pacientes con cáncer de mama(Bonanni etal., 2012; DeCensi et al., 2014, 2015; Rahmani et al., 2019).
Fase 2 Los ensayos «neoadyuvantes» generalmente son ensayos más largos y complejos que investigan la metformina junto con ciclos de tratamientos estándar para tratar diferentes tipos de cáncer de mama. El objetivo de estos ensayos es establecer si la metformina realmente ayuda a mejorar la eficacia de los tratamientos estándar, según sugieren estudios de laboratorio (Kim et al., 2014). En un estudio reciente (el estudio METTEN) (Martin-Castillo etal., 2018), en mujeres con cáncer de mama en estadio temprano HER2 positivo, más pacientes que tomaron metformina respondieron bien a la quimioterapia/tratamiento objetivo (65,5%) en comparación con pacientes que no tomaron metformina (58,6%). Esta diferencia no fue estadísticamente significativa, lo que significa que este resultado podría haberse alcanzado por casualidad. Sin embargo, los ensayos de fase 2 generalmente no tienen suficiente potencia para alcanzar la significación estadística de esta manera, y los investigadores llamaron para la progresión a ensayos de fase 3 más grandes que se pueden diseñar adecuadamente para determinar cuán real es este efecto (Martin-Castillo etal., 2018). También se han notificado resultados potencialmente alentadores de otras pruebas de fase 2, como una en individuos con sobrepeso con cáncer de mama metastásico (Yam et al.,2019). También vale la pena señalar que, como se esperaba, no todos los ensayos de cáncer de metformina han reportado resultados positivos. Por ejemplo, en otros ensayos de la fase 2 se encontró que la metformina con terapia estándar no tenía diferencia real en comparación con la terapia estándar sola en ciertas circunstancias (Mark et al.,2019; Nanni et al., 2019). Creemos que la metformina será más efectiva en cualquier entorno cuando se administra en combinación con otros medicamentos anti-metabólicos.
Se necesitan estudios más amplios para ayudar a resolver estos problemas, y ahora se está llevando a cabo un ensayo de fase 3 para investigar la metformina en el cáncer de mama. Aunque el ensayo no se completará hasta 2020, los resultados iniciales de los primeros 6 meses del ensayo mostraron que las pacientes que comenzaron a tomar metformina inmediatamente después de completar los ciclos de cirugía y quimioterapia estándar tuvieron cambios favorables en un marcador molecular de cáncer de mama (Dowling et al., 2018), y factores metabólicos mejorados (Goodwin et al., 2015).
Las estatinas y el cáncer de mama
Los estudios de observación vinculan las estatinas con mejores resultados del cáncer de mama
Las estatinas generalmente se administran para ayudar a controlar la enfermedad cardiovascular. Sin embargo, los estudios de observación en grandes grupos de personas que toman estatinas también han encontrado que los individuos con cáncer de mama que toman estatinas también pueden reducir el riesgo de recurrencia de su cáncer después del tratamiento, en comparación con los pacientes que no toman estatinas (Ahern et al., 2014; Manthravadi et al., 2016). Por ejemplo, en un estudio realizado en casi 2000 sobrevivientes de cáncer de mama, aquellos que comenzaron a tomar tinciones dentro de los tres años posteriores al diagnóstico tuvieron una probabilidad reducida de que su cáncer volviera a aparecer (Kwan et al., 2008). En otro estudio, solo 6 meses de uso de estatinas después del diagnóstico se relacionaron con tasas mejoradas de recaída (Chae et al., 2011).
Es importante destacar que el efecto beneficioso de las estatinas en estos y otros estudios se relacionó más fuertemente con estatinas lipofílicas solubles en grasa (como la atorvastatina). En algunos estudios de laboratorio, también se ha demostrado que las estatinas lipofílicas tienen efectos superioranticantes a nivel celular en comparación con las estatinas menos solubles en grasa (Liu et al., 2017).
Los estudios de observación también vinculan el uso de estatinas con una mejor respuesta de la enfermedad al tratamiento y la supervivencia en pacientes con cáncer de mama, incluso en pacientes con tipos de cáncer de mama que pueden ser más agresivos (Manthravadi et al., 2016; Murtola et al., 2014; Zhong et al., 2015). Por ejemplo, en un estudio en pacientes con cáncer de mama inflamatorio, los pacientes que tomaban una orvastatina mientras recibían tratamiento para el cáncer tuvieron un período de tiempo más largo antes de que su enfermedad progresara, en comparación con aquellos que no tomaban estatinas (Brewer et al., 2013).
Estatinas Destinadas a las células de cáncer de mama
Las estatinas,en particular las lipofílicas liposolubles en grasa, como la atorvastatina, reducen el crecimiento y la división de las células de cáncer de mama y aumentan la muerte de las células de cáncer de mama en los estudios de laboratorio
Asociación Alemana de Diabetes»,»página»:»47-48″,»volumen»:»111″,»número»:»1″,»fuente»:»PubMed»,»resumen»:»El efecto de cinco estatinas, es decir, atorvastatina, fluvastatina, lovastatina, pravastatina y simvastatina se investigaron en la proliferación de la línea celular de cáncer de mama humano MCF-7. Todas las estatinas, excepto la pravastatina, fueron capaces de inhibir la proliferación de células hasta un 90% a una concentración de 50 micro M. Entre las estatinas efectivas no se observaron diferencias significativas que indicaran un efecto específico de la clase. Estos datos sugieren que las estatinas pueden tener significación clínica en la prevención primaria del cáncer de mama humano más allá de su efecto reductor del colesterol. Sin embargo, debe esperarse una prueba clínica antes de extraer cualquier conclusión adicional.», «DOI»: «10.1055 / s-2003-37501», «ISSN»: «0947-7349», «note»: «PMID: 12605351», «journalAbbreviation»: «Exp. Clin. Endocrinol.Diabetes»,»language»:»eng»,»author»:,»issued»:{«date-parts»:]}}}],»schema»:»https://github.com/citation-style-language/schema/raw/master/csl-citation.json»}(Alarcon Martinez etal., 2018; Mück et al., 2004; Seeger et al., 2003).Los estudios también muestran que las estatinas pueden bloquear potencialmente la invasividad de las células del cáncer de mama en el laboratorio, lo que sugiere que también pueden ayudar a retrasar la propagación del cáncer a otras partes del cuerpo (Kanugula et al., 2014; Wolfe et al., 2015). En un modelo de ratón de cáncer de mama metastásico, el tratamiento con estatotratamiento retrasó el crecimiento del cáncer que ya se había diseminado hasta en un 80%,y se observó actividad beneficiosa a la semana de comenzar el tratamiento (Vintonenko et al.,2012).
Otros estudios también muestran que las estatinas pueden ayudar a sensibilizar a las células de cáncer de mama para los tratamientos estándar de radioterapia y quimioterapia (Kozar et al., 2004; Van Wyhe et al., 2017). Un estudio encontró que la simvastatina podría sensibilizar a las células de cáncer de mama triple negativo o inflamatorio a la radioterapia en el laboratorio. El mismo estudio observó en una población de pacientes que las mujeres con cáncer de mama inflamatorio que tomaron estatinas durante su tratamiento tenían menos probabilidades de que su cáncer reapareciera en 3 años (Lacerda et al., 2014).
Al igual que la metformina, las estatinas pueden producir estos efectos anticancerosos en diferentes tipos de cáncer de mama, como el cáncer de mama positivo para sala de emergencias, positivo para HER2 y triple negativo. De hecho, algunos estudios de laboratorio muestran que las estatinas son particularmente efectivas contra las células de cáncer de mama triple negativo (Campbell et al., 2006; Yao et al., 2017).
Los ensayos clínicos que investigan las estatinas en el cáncer de mama ya están en marcha
Los ensayos clínicos en etapas intermedias ahora muestran resultados positivos sólidos en términos de estatinas en el cáncer de mama. Los ensayos «ventana de oportunidad» de fase temprana han investigado si las estatinas prequirúrgicas pueden ayudar a mejorar los marcadores moleculares de la enfermedad en pacientes con enfermedad operable. Hasta ahora,estos estudios muestran perfiles moleculares de cáncer mejorados en pacientes con tratamiento con estatinas, lo que sugiere que la orvastatina y otras estatinas en este contexto pueden tener efectos beneficiosos sobre el crecimiento y la división de las células cancerosas y la muerte celular, incluso en mujeres con tumores de alto grado más agresivos (Bjarnadottir et al., 2013, 2015; Feldt et al., 2015; Garwood et al., 2010).
Sobre la base de estos prometedores resultados, se están llevando a cabo varios estudios de fase 2 que investigan estatinas inyectables para una variedad de tipos diferentes de cáncer de mama, incluido el cáncer de mama triple negativo. Estos estudios deberían ayudar a establecer cómo las estatinas pueden ayudar a las pacientes con cáncer de mama.
Mebendazol y cáncer de mama
El interés en el mebendazol como posible tratamiento contra el cáncer se basa principalmente en estudios mecánicos prometedores e informes convincentes de estudios de casos en pacientes con cáncer (Nygren y Larsson,2014; Pantziarka et al., 2014).
Se cree que la mebendazol destruye las células cancerosas en parte al interrumpir estructuras especiales internas de la célula, llamadas microtúbulos (Pantziarka et al.,2014). Funciona de manera similar a la vincristina, un fármaco de quimioterapia que se usa actualmente para el tratamiento de algunos tipos de cáncer,incluido el cáncer de mama en estadio avanzado (De Witt et al., 2017).
Los estudios sobre células de cáncer de mama cultivadas en el laboratorio muestran que el mebendazol y los medicamentos relacionados de la misma clase (llamados bencimidazoles) pueden retrasar el crecimiento y la división de varios tipos diferentes de células de cáncer de mama, incluidas las células resistentes a la quimioterapia (Coyne et al., 2013; Hou et al., 2015; Mukhopadhyay et al., 2002). En un estudio, el mebendazol redujo de manera potente la supervivencia de las células cancerosas de mama resistentes a la quimioterapia hasta en un 63,1% (Coyne et al., 2013).Los estudios también han demostrado una sólida actividad anticancerígena de los bencimidazol contra el cáncer de mama triple negativo (Hou et al., 2015; Zhang et al., 2015). Es importante destacar que en un estudio también se descubrió un bencimidazol para atacar directamente las células madre del cáncer de mama (Hou et al., 2015).
Las pruebas de laboratorio emergentes también sugieren que los bencimidazoles pueden mejorar la actividad de los tratamientos estándar para el cáncer de mama, como la doxorrubicina y el fluorouracilo (Hou et al., 2015). En un estudio de laboratorio, el mebendazol aumentó la eficacia de la radioterapia en células de cáncer de mama triple negativo y previno la resistencia al desarrollo del tratamiento (Zhang et al.,2019a). Además, una serie de estudios que utilizaron células de cáncer de mama ER/HER2 positivas resistentes a la quimioterapia cultivadas en el laboratorio,mostraron consistentemente que el mebendazol no solo redujo la supervivencia de las células cancerosas,sino que también ayudó a complementar y mejorar la actividad de formas específicas especialmente desarrolladas de medicamentos de quimioterapia para el cáncer de mama, epirrubicina y gemcitabina (Coyne et al., 2014,2012, 2013).
Doxiciclina y cáncer de mama
Además de ser un antibiótico eficaz, la doxiciclina también posee otras propiedades extremadamente valiosas, incluida la actividad antiinflamatoria y anticancerígena. Esto le da a la doxiciclina un potencial terapéutico real en el tratamiento de una variedad de otras enfermedades, incluido el cáncer (Bahrami et al., 2012).
Los estudios de laboratorio y los estudios en animales han demostrado durante mucho tiempo que la doxiciclina puede bloquear el crecimiento, la división y el movimiento de las células del cáncer de mama (Duivenvoorden et al., 2002; Fife and Sledge, 1995, 1998).Estudios más recientes también muestran que la doxiciclina puede impedir que las células cancerosas repiensen su ADN cuando se daña, por ejemplo, a causa de la quimioterapia (Peiris-Pagès et al.,2015). De hecho, los estudios de laboratorio muestran que la doxiciclina puede ayudar a mejorar la eficacia de la actividad de quimioterapia contra las células cancerosas de mama (Foroodi et al., 2009; Lamb et al., 2015a).
Más recientemente, la atención se ha centrado en comprender cómo la doxiciclina puede bloquear el crecimiento de células madre del cáncer de mama (Ozsvari etal., 2017; Zhang et al., 2017). Un estudio muy reciente sobre células cultivadas en el laboratorio ha demostrado que la doxiciclina puede bloquear el crecimiento de células madre de cáncer de mama positivo para HER2 y triple negativo, y ayudó a mejorar los cambios relacionados con la resistencia inducidos por el paclitaxel de quimioterapia estándar (Lin et al.,2018). En un estudio de laboratorio diferente, un enfoque combinatorio que incluía doxiciclina erradicó muy eficazmente las células madre del cáncer de mama (Fiorillo etal., 2019).
La doxiciclina acaba de llegar a los primeros ensayos clínicos en pacientes con cáncer de mama. Los resultados del primer estudio pequeño, publicado en octubre de 2018, muestran que las pacientes con cáncer de mama en estadio temprano que tomaron doxiciclina durante solo 14 días antes de la cirugía redujeron los niveles de marcadores moleculares de la presencia de células madre cancerosas en un promedio de alrededor del 40%. Se observaron efectos beneficiosos para todos menos uno de los pacientes tratados (8/9) (Scatena et al., 2018).Se están llevando a cabo ensayos clínicos más grandes.
Nuestra propia evidencia: El estudio de MÉTRICAS
¿Qué son las MÉTRICAS?
METRICS es nuestro propio programa de búsqueda interno. Ya se sabe mucho sobre la seguridad y la eficacia de los medicamentos del Protocolo de AOC en el cáncer. Pero también es nuestra responsabilidad reconocer que no tenemos todas las respuestas, y que aún necesitamos generar investigación clínica de buena calidad que investigue el protocolo de COC en pacientes con cáncer, para garantizar que el Protocolo de COC sea lo más efectivo y seguro posible.
Para poder financiar esta investigación, hemos desarrollado un sistema novedoso y asequible en el que nuestro estudio clínico, METRICS, está esencialmente «financiado por el paciente». Cada paciente que accede a la clínica está inscrito en MÉTRICAS, y estas tarifas están ayudando a financiar el estudio. Se trata de un nuevo modelo de investigación clínica, destinado a tender un puente entre la financiación y los gaps de datos que actualmente obstaculizan la reutilización y el desarrollo clínico de medicamentos ya autorizados.
Primeros resultados de MÉTRICAS
En un primer éxito de Métricas, los resultados de nuestro estudio piloto inicial se publicaron recientemente en la revista científica Frontiers in Pharmacology, revisada por el Peer. El documento puede consultarse gratuitamente en línea aquí.
El estudio piloto de MÉTRICAS fue un estudio retrospectivo observacional, lo que significa que nuestros investigadores miraron hacia atrás y analizaron los registros clínicos de los pacientes para averiguar qué sucedió. Recopilaron datos y registraron los resultados de 95 pacientes con un tipo avanzado de cáncer de cerebro llamado glioblastoma que asistieron a la Clínica de Oncología Care y que tomaron el Protocolo completo de AOC junto con sus tratamientos estándar habituales. Este estudio no tenía un grupo de control, por lo que nuestros investigadores compararon los resultados de las MÉTRICAS con resultados publicados previamente de estudios anteriores en pacientes con el mismo tipo de cáncer y que también tomaron tratamientos de atención estándar.
Los resultados iniciales sugieren que los pacientes que asistieron a nuestra clínica y tomaron el Protocolo de AOC como parte de su atención habitual tenían muchas más probabilidades de sobrevivir al menos 2 años (64.el 0% de los pacientes de nuestro estudio sobrevivieron al menos 2 años, en comparación con el 27-29% de los pacientes incluidos en estudios publicados previamente), y tendieron a tener una supervivencia global más prolongada de lo que normalmente se esperaría para los pacientes con este tipo de cáncer (los pacientes sobrevivieron un promedio de 27 meses en nuestro estudio, en comparación con 15-16 meses en estudios anteriores)(Agrawalet al., 2019).
Estos resultados son extremadamente prometedores, pero también son preliminares. Todavía no sabemos exactamente cómo el Protocolo de AOC puede haber impactado los tiempos de supervivencia, por ejemplo, o cómo otros factores, como ciertas características de los pacientes, también pueden haber influido en estos resultados. Pero esta primera evidencia inicial es ciertamente alentadora, y nos sugiere que vamos en la dirección correcta. Nuestro próximo escenario planificado es llevar a cabo un estudio más grande y bien diseñado. Puede obtener más información sobre los futuros planes de métricas consultando en línea o contactando con la clínica.
Más información sobre el Protocolo COC
¿Qué es el Protocolo COC?
El Protocolo COC es un régimen de tratamiento combinado compuesto por medicamentos autorizados, específicamente diseñados por Care Oncology para uso complementario junto con los tratamientos habituales del paciente (es decir, estándar de atención).
Los cuatro medicamentos incluidos en el régimen del Protocolo de AOC son: metformina, un medicamento antidiabético muy común; atorvastatina, un tipo de estatina que se usa para tratar afecciones cardiovasculares; doxiciclina, un tipo de antibiótico que a menudo se usa para tratar infecciones crónicas como el acné; y mebendazol, un medicamento que se usa comúnmente para tratar infecciones parasitarias en niños y adultos.
Elegimos estas cuatro solicitudes entre miles de candidatos potenciales específicamente porque se ajustan a nuestros criterios de selección predeterminados. Estos criterios incluyen pruebas sólidas de eficacia contra el cáncer, un mecanismo de acción coherente y, lo que es importante, un buen perfil de seguridad. Estos tres principios centrales han dado forma a nuestro enfoque desde el principio.
La seguridad es primordial
El cáncer es una enfermedad compleja con tratamientos complejos, y creemos que la adición de terapias adicionales junto con tratamientos estándar debe evaluarse con mucho cuidado. No solo desde la perspectiva de la eficacia, sino también,lo que es más importante, en términos de seguridad. Esta es la razón por la que todo nuestro enfoque se basa en pruebas, principalmente en estudios científicos publicados, y también, cada vez más, en nuestros propios datos.
Muchos medicamentos diferentes en el mercado tienen al menos algunas evidencias publicadas que respaldan su uso relativamente efectivo en el cáncer, pero pocas de estas medicaciones tienen el nivel de evidencia de seguridad y efectividad que se requiere para el Protocolo AOC. Ya existen grandes cantidades de datos detallados para cada uno de los medicamentos de protocolo, obtenidos a partir de años de uso en la población general, y esto nos ayudó a darnos una ventaja crucial durante el desarrollo.
Hemos buscado minuciosamente a través de décadas de datos publicados sobre cada uno de los medicamentos del Protocolo del COC, explorando cómo funcionan en diferentes poblaciones de pacientes (incluidos pacientes con cáncer) y en modelos celulares y animales en el laboratorio. Estos datos, junto con nuestra propia experiencia clínica, ayudan a garantizar que tenemos una buena comprensión de cómo se comportarán estos medicamentos en pacientes con diferentes estadios y tipos de cáncer, tanto en combinación entre sí como en combinación con muchas otras terapias contra el cáncer. Este conocimiento es importante, y a partir de nuestros estudios, este tipo de evidencia no existe para muchos otros candidatos a medicamentos anticancerosos no etiquetados, especialmente cuando se les administra en combinación.
Una terapia antimetabólica que puede dirigirse potencialmente a cualquier cáncer
El Protocolo COC está diseñado para funcionar restringiendo la capacidad general de las células cancerosas para absorber y usar (es decir, «metabolizar») la energía.
Las células cancerosas necesitan grandes cantidades de energía para sobrevivir, y la gran mayoría de los cánceres utilizan un proceso adaptativo llamado glucólisis aeróbica para generar la energía excesiva que necesitan (Kroemer y Pouyssegur, 2008). Cada uno de los medicamentos en el protocolo puede dirigirse a los diversos procesos metabólicos moleculares involucrados en la glucólisis aeróbica circundante, y esto puede ayudar a reducir la tasa metabólica general de la célula cancerosa (Jang et al.,2013).
Creemos que los medicamentos COCProtocol pueden funcionar en combinación para restringir consistentemente el suministro y el uso de energía, al tiempo que evitan que las células cancerosas se adapten y utilicen otras vías para absorber energía (Jagust et al.,2019). Como resultado, las células cancerosas se vuelven cada vez más débiles y menos capaces de absorber y utilizar los nutrientes (p. ej. como la glucosa y los ácidos grasos esenciales glutamina y arginina) que necesitan de su entorno (Andrzejewskiet al., 2018; Liu et al., 2016).Esto dificulta en general la supervivencia, el crecimiento y la diseminación de las células cancerosas en el cuerpo. Gradualmente, las células debilitadas (incluidas las células más resilientes y resistentes al tratamiento) se vuelven más vulnerables al ataque de otras terapias para el cáncer que destruyen células, como la radioterapia,la quimioterapia, la terapia hormonal y las terapias dirigidas (Bradford andKhan, 2013; Chen et al., 2012; Lacerda et al., 2014; Lamb et al., 2015a; Pantziarka et al., 2014).
Al apuntar a los mecanismos metabólicos adaptados que son comunes a la mayoría de los cánceres(pero generalmente no a las células sanas), creemos que el Protocolo de AOC puede ser eficaz y selectivo para prácticamente cualquier cáncer,independientemente del tipo, estadio o ubicación específicos del cáncer. Los estudios epidemiológicos y de laboratorio publicados apoyan cada vez más la amplia gama potencial de esta terapia (Chae et al., 2015, 2016; Iliopoulos et al., 2011; Lamb et al., 2015b; Pantziarka et al.,2014).
Coherencia mecanicista en la acción-el poder de la combinación
El verdadero poder del Protocolo COC radica en la combinación específica de medicamentos que usamos. Desarrollamos el protocolo no solo como un régimen de cuatro tratamientos individuales cada uno con actividad anticancerígena, sino también para funcionar como un único tratamiento combinado, con el potencial de producir poderosos efectos sinérgicos (Mokhtari et al., 2017).
Cada medicación en el Protocolo COC se dirige al metabolismo de las células cancerosas de una manera distinta y complementaria, y hemos denominado a esta acción «coherencia mecanicista». En pocas palabras, la coherencia mecanicista describe cómo cada medicamento puede atacar a la célula cancerosa desde un ángulo diferente. Por ejemplo, las células madre del cáncer son un tipo de célula cancerosa muy resistente, y cada medicamento se dirige a estas células de una manera diferente: la metformina se dirige a las «baterías» de la célula (llamadas mitocondrias) al hacer que sea muy difícil para las mitocondrias ejecutar las reacciones moleculares que necesitan para producir energía, la doxiciclina bloquea la maquinaria celular que las mitocondrias necesitan replicar y reparar (Skoda et al., 2019), las estatinas pueden alterar la expresión génica de las células madre cancerosas, haciendo que las células sean más sensibles a otras terapias contra el cáncer (Kodach et al., 2011), y el mebendazol puede interrumpir numerosos procesos moleculares involucrados en la división celular para ayudar a bloquear el crecimiento de células madre cancerosas (Hothi et al., 2012; Hou et al., 2015).
Al combinar todos los cuatro agentes, el Protocolo COC puede afectar a las células madre cancerosas (y a otras células cancerosas) en múltiples «puntos débiles», y, como un golpe de uno a dos, deja a las células menos capaces de esquivar y recuperarse.
Los estudios de laboratorio están comenzando a resaltar la efectividad de este enfoque utilizando combinaciones de medicamentos con cocprotocolo. En un estudio mecanicista, la combinación de estatina y metformina disminuyó en gran medida el crecimiento de células cancerosas de próstata más que el de un solo agente (Wang et al., 2017). Los estudios de observación también han reportado efectos potencialmente «sinérgicos» de estos medicamentos contra varios cánceres (Babcook etal., 2014; Danzig et al., 2015; Lehman et al., 2012; Nimako et al., 2017). Un ensayo clínico que investiga la metformina y la doxiciclina en el cáncer de mama está en marcha (NCT02874430), y nuestro propio programa de investigación, METRICS, también está comenzando a producir datos prometedores.
Una terapia complementaria a largo plazo
El Protocolo COC está diseñado principalmente para ser una terapia «complementaria» a largo plazo, para ayudar a optimizar los tratamientos estándar. Sin embargo, dado que el tratamiento metabólico con el COCProtocol está destinado a ser a largo plazo, los pacientes también pueden tomar el protocolo como un régimen de mantenimiento después de que se haya completado el tratamiento estándar o durante las pausas del tratamiento estándar y como parte de una estrategia a largo plazo para mitigar el riesgo de recurrencia o metástasis. Por esta razón, también vale la pena señalar que cada uno de los medicamentos del Protocolo de AOC también ha reportado mecanismos beneficiosos de acción en cáncer que no dependen de la administración conjunta de terapias estándar, y que pueden ayudar de forma independiente a reducir el riesgo de recaída y diseminación metastásica.
El modelo de Atención oncológica
Supervisión médica activa de cada paciente
Aunque los medicamentos COCProtocol se han utilizado de forma segura en la población general durante muchos años, cada paciente que acude a nosotros es único. Esta es la razón por la que cada paciente que asiste a la Clínica de Oncología de Atención se coloca bajo la atención directa de médicos con conocimientos especializados sobre la prescripción de los medicamentos del Protocolo de AOC en el contexto del cáncer. Nuestros médicos evalúan individualmente los beneficios y riesgos potenciales involucrados en tomar el Protocolo de AOC con cada paciente. Solo recomendarán el Protocolo de AOC a los pacientes cuando crean que será seguro y beneficioso hacerlo. Cada receta del Protocolo de AOC se adapta a las necesidades del paciente, y las dosis y los regímenes se revisan y ajustan cuidadosamente en función de la evolución del paciente.
Por lo tanto, es esencial que los pacientes solo tomen el Protocolo de AOC mientras estén monitorizados cuidadosamente en nuestra clínica durante la duración de su tratamiento.
*********************************************************************************
Aviso Importante
el Propósito de este artículo
Thisarticle es un resumen de algunos de los científicos y médicos publishedliterature sobre los medicamentos que componen el sistema patentado de Atención Oncologyprotocol. Se ha tenido cuidado de seleccionar artículos relevantes que apoyen el uso fuera de la etiqueta de estos medicamentos en un entorno clínico para el tratamiento complementario del cáncer. Este artículo no pretende ser una revisión exhaustiva de toda la evidencia, ni captura todos los efectos secundarios potenciales de tal tratamiento.
Este artículo es solo para fines informativos y NO constituye asesoramiento médico. Los medicamentos descritos en este documento están disponibles solo con receta y no deben tomarse sin consultar a su médico u otro proveedor profesional de atención médica. Los médicos oncológicos de Care discutirán con usted la idoneidad de estos medicamentos y se pondrán en contacto con su médico u oncólogo para discutir su idoneidad para usted.
No debe confiar en la información de este artículo como una alternativa al asesoramiento médico de su médico u otro proveedor de atención médica profesional. Si tiene alguna pregunta específica sobre cualquier asunto médico, debe consultar a su médico u otro proveedor de atención médica profesional. Si cree que puede estar padeciendo alguna afección médica, debe buscar atención médica inmediata. Usted nunca debe demorar en buscar consejo médico, ignorar consejo médico, o continuar el tratamiento médico debido a la información contenida en este artículo.
Copyright
Los derechos de autor de este artículo son propiedad de Health Clinics LLC y sus licenciantes.
Patente
El Protocolo Care Oncology(«COC») está protegido por la patente de los Estados Unidos US9622982B2 y por varias patentes internacionales adicionales.
*********************************************************************************
Agrawal,S., Vamadevan, P., Mazibuko, N., Bannister, R., Swery, R., Wilson, S., andEdwards, S. (2019). Un Nuevo Método para Generar Pruebas Éticas y Eficientes Para el Uso de Medicamentos No Etiquetados en Oncología (Un Estudio de Caso en Glioblastoma). Delantero.Pharmacol. 10.
Ahern, T. P., Lash, T. L., Damkier, P., Christiansen, P. M., and Cronin-Fenton, D. P. (2014). Statins and breast cancer prognosis:evidence and opportunities (en inglés). Lancet Oncol. 15, e461-468.
Aksoy, S., Sendur, M. A. N., y Altundag, K. (2013).Características demográficas y clínico-patológicas en pacientes con cáncer de mama invasor que reciben metformina. Mediterráneo. Oncol. Northwood Lond. Engl. 30, 590.
Alarcon Martinez, T., Zeybek, N. D., and Müftüoğlu, S. (2018). Evaluación de los Efectos Citotóxicos y Autofágicos de la Atorvastatina sobre las Células de Cáncer de Mama CMF-7. Balk. Mediterráneo. J. 35, 256-262.
Alimova, I. N., Liu, B., Fan, Z., Edgerton, S. M., Dillon, T., Lind, S.E., and Thor, A. D. (2009). La metformina inhibe el crecimiento de las células del cáncer de mama, la formación de colonias e induce la detención del ciclo celular in vitro. Ciclo celular 8, 909-915.
Andrzejewski, S., Siegel, P. M., and St-Pierre, J. (2018). Perfiles Metabólicos Asociados A La Eficacia de La Metformina en el Cáncer. Delantero.Endocrinol. 9.Babcook, M. A., Shukla, S., Fu, P., Vazquez, E. J., Puchowicz, M. A., Molter, J. P., Oak, C. Z., MacLennan, G. T., Flask, C. A., Lindner, D. J., et al. (2014). Quimioterapia Combinada Sinérgica de Simvastatina y Metformina para el Cáncer de Próstata Metastásico Óseo Resistente a la Castración. Mol.Cáncer allí. 13, 2288–2302.
Bahrami, F., Morris, D. L., and Pourgholami, M. H. (2012). Tetraciclinas: fármacos con un enorme potencial terapéutico. Mini Apo. Med.Chem. 12, 44–52.
Bao, B., Azmi, A. S., Ali, S., Zaiem, F., and Sarkar,F. H. (2014). La metformina puede funcionar como agente anticanceroso dirigiéndose a las células del tallo canceroso: la importancia biológica potencial de los miRNAs asociados a tumores en los cánceres de páncreas y de mama. Ana. Transl. Mediterráneo. 2.
Bjarnadottir, O., Romero, Q., Bendahl, P.-O., Jirström, K., Rydén, L., Loman, N., Uhlén, M., Johannesson, H., Rose, C., Grabau, D., etal. (2013). Dirigir la HMG-Coa reductasa con estatinas en un ensayo de cáncer de mama en una ventana de oportunidad. Tratamiento de Cáncer de Mama. 138, 499–508.
Bjarnadottir, O., Kimbung, S., Johansson, I., Veerla, S., Jönsson, M., Bendahl, P.-O., Grabau, D., Hedenfalk, I., and Borgquist, S.(2015). Cambios Transcripcionales Globales Después del Tratamiento con Estatinas en el cáncer de mama. Clin. Res. de Cáncer Apagada. J. Am. Assoc. Cancer Res. 21, 3402-3411.
Bonanni, B., Puntoni, M., Cazzaniga, M., Pruneri, G., Serrano, D., Guerrieri-Gonzaga, A., Gennari, A., Trabacca, M. S., Galimberti, V., Veronesi, P., et al. (2012). Efecto dual de la metformina en la proliferación del cáncer de mama en un ensayo prequirúrgico aleatorizado. J. Clin. Oncol. Fuera. J. Am.Soc. Clin. Oncol. 30, 2593–2600.
Bradford, S.A., and Khan, A. (2013). Quimioterapia individualizada utilizando el Medicamento Antidiabético, Metformina, como un «Juvant»: Un estudio exploratorio. J. Cancer Sci. Allí. 5.Brewer, T. M., Masuda, H., Liu, D. D., Shen, Y., Liu, P., Iwamoto, T., Kai, K., Barnett, C. M., Woodward, W. A., Reuben, J. M., et al.(2013). Uso de estatinas en el cáncer de mama inflamatorio primario: un estudio de cohorte. Br.J. Cancer 109, 318-324.
Camacho, L., Dasgupta, A., and Jiralerspong, S. (2015). Metformina en el cáncer de mama: un misterio en evolución. Cáncer de Mama Res. BCR 17, 88.Campbell, M. J., Esserman, L. J., Zhou, Y.,Shoemaker, M., Lobo, M., Borman, E., Baehner, F., Kumar, A. S., Adduci, K., Marx, C., etal. (2006). Prevención del crecimiento del cáncer de mama con estatinas. Cancer Res. 66,8707-8714.Cazzaniga, M., DeCensi, A., Pruneri, G., Puntoni, M., Bottiglieri, L., Varricchio, C., Guerrieri-Gonzaga, A., Gentilini, O. D., Pagani, G., Dell’Orto, P., et al. (2013). El efecto de la metformina sobre la apoptosisina en un ensayo prequirúrgico de cáncer de mama. Br. J. Cancer 109, 2792-2797.
Chae, Y. K., Valsecchi, M. E., Kim, J., Bianchi, A. L., Khemasuwan, D., Desai, A., and Tester, W. (2011). Reducción del riesgo de recurrencia de cáncer de Mama en Pacientes que usan Inhibidores de la ECA, ARAII y / o estatinas. CancerInvest. 29, 585–593.
Chae, Y. K., Yousaf, M., Malecek, M.-K., Carneiro, B., Chandra, S., Kaplan, J., Kalyan, A., Sassano, A., Platanias, L. C., and Giles,F. (2015). Estatinas como terapia anticancerígena; ¿Podemos traducir los datos preclínicos y epidemiológicos en beneficios clínicos? Discov. Mediterráneo. 20, 413–427.
Chae, Y. K., Arya, A., Malecek, M.-K., Shin, D. S., Carneiro, B., Chandra, S., Kaplan, J., Kalyan, A., Altman, J. K.,Platanias, L., et al. (2016). Reutilización de metformina para el tratamiento del cáncer: estudios clínicos actuales. Oncotarget 7, 40767-40780.
Chen, J., Lan, T., Hou, J., Zhang, J., An, Y., Tie, L., Pan, Y., Liu, J., and Li, X. (2012). La atorvastatina sensibiliza a los carcinomas de pulmón de células pequeñas del hombre al carboplatino a través de la supresión de la activación de AKT y la regulación ascendente de TIMP-1. Int. J. Bioquímica. Cell Biol. 44, 759–769.
Chen, L., Chubak, J., Boudreau, D. M., Barlow, W. E., Weiss, N. S., and Li, C. I. (2017). Tratamientos para la Diabetes y Riesgos de los desenlaces del Cáncer Adverso en Pacientes con Cáncer de Mama en estadio Temprano: Un análisis de Medicamentos VIDENTES. Cancer Res. 77, 6033-6041.
Chen, T., Liang, Y., Feng, D., Tao, L., Qi, K.,Zhang, H., Wang, H., Lin, Q., and Kong, H. (2013). La metformina inhibe la proliferación y promueve la apoptosis de las células de cáncer de mama HER2 positivas regulando a la baja SP90. J. BUON Off. J. Balk. Union Oncol. 18, 51–56.
Coyne, C., Jones, T., and Bear, R. (2014).Citotoxicidad Antineoplásica de Gemcitabina(amida C4) en combinación con Epirrubicina(amida C3) contra el Adenocarcinoma Mamario Resistente a Quimioterapia (SKBr-3) y el Efecto complementario del Mebendazol. J. Cancer Res.Ther. Oncol. 2.
Coyne, C. P., Jones, T., and Bear, R. (2012). Influencia de Inhibidores de Tubulina Alternativos en la Potencia de la Aepirrubicina-Inmunoquímica Sintetizada con un Intermediario Activado por Luz Ultra Violeta. Cáncer Clin. Oncol. 1, 49–80.
Coyne, C. P., Jones, T., and Bear, R. (2013).Gemcitabine-(C4-amide)- Anti-Neoplastic Cytotoxicity in DualCombination with Mebendazole against Chemotherapeutic-Resistant MammaryAdenocarcinoma. J. Clin. Exp. Oncol. 2.
Cufi, S., Corominas-Faja, B., Vazquez-Martin, A.,Oliveras-Ferraros, C., Dorca, J., Bosch-Barrera, J., Martin-Castillo, B., andMenendez, J.A. (2012). Metformin-induced preferential killing of breast cancerinitiating CD44+CD24-/low cells is sufficient to overcome primary resistance totrastuzumab in HER2+ human breast cancer xenografts. Oncotarget 3, 395–398.
Danzig, M.R., Kotamarti, S., Ghandour, R.A., Rothberg, M. B., Dubow, B. P., Benson, M. C., Badani, K. K., and McKiernan, J. M. (2015).Sinergia entre metformina y estatinas para modificar el riesgo de recurrencia bioquímica después de una prostatectomía radical en hombres con diabetes. Enfermedad prostática del Cáncer de Próstata. 18, 63–68.
Davies, G., Lobanova, L., Dawicki, W., Groot, G., Gordon, J. R., Bowen, M., Harkness, T., and Arnason, T. (2017). Metformina inhibe el desarrollo y promueve la resensibilización, a menudo el cáncer de mama resistente al tratamiento. PLoS UNO 12.
De Witt, M., Gamble, A., Hanson, D., Markowitz, D., Powell, C., Al Dimassi, S., Atlas, M., Boockvar, J., Ruggieri, R., and Symons,M. (2017). Reutilización del Mebendazol como Reemplazo de la Vincristina para el tratamiento de Tumores Cerebrales. Mol. Mediterráneo. 23, 50–56.
DeCensi, A., Puntoni, M., Gandini, S., Guerrieri-Gonzaga, A., Johansson, H. A., Cazzaniga, M., Pruneri, G.,Serrano, D., Schwab, M., Hofmann, U., et al. (2014). Efectos diferenciales de la proliferación del cáncer de mama con metformina según los marcadores de resistencia a la insulina y subtipo tumoral en un ensayo prequirúrgico aleatorizado. Tratamiento de Cáncer de Mama. 148,81–90.
DeCensi, A., Puntoni, M., Guerrieri-Gonzaga, A., Cazzaniga, M., Serrano, D., Lazzeroni, M., Vingiani, A., Gentilini, O., Petrera, M., Viale, G., et al. (2015). Efecto de la Metformina en la Proliferación In Situ del Carcinoma de Conducto Mamario en un Ensayo Prequirúrgico Aleatorizado. Prevención del Cáncer.R Filadelfia. Pa 8, 888-894.
Deng, X.-S., Wang, S., Deng, A., Liu, B., Edgerton, S. M., Lind, S.E., Wahdan-Alaswad, R., and Thor, A. D. (2012). Metformina targetsStat3 para inhibir el crecimiento celular e inducir apoptosis en cáncer de mama triple negativo. Georget de Ciclo Celular. Tex 11, 367-376.
Dowling, R. J., Parulekar, W. R., Gelmon, K. A., Shepherd, L. E., Virk, S., Ennis, M., Mao, F., Ligibel, J. A., Hershman, D. L., Rastogi, P., et al. (2018). CA15-3 / MUC1 en CCTG MA-32 (NCT01101438): Un ECA de fase III del efecto de metformina vs.placebo sobre la supervivencia general y sin enfermedad invasiva en el cáncer de mama en estadio temprano (CB). J. Clin. Oncol.
Duivenvoorden, W. C. M., Popović, S. V., Lhoták, S., Seidlitz, E., Hirte, H. W., Tozer, R. G., and Singh, G. (2002). La doxiciclina disminuye la carga tumoral en un modelo de metástasis ósea de cáncer de mama humano. Cancer Res. 62,1588–1591.
El-Benhawy, S.A., y El-Sheredy, H. G. (2014).Metformina y supervivencia en pacientes diabéticos con cáncer de mama. J. Egipto.Public Health Assoc. 89, 148–153.
Feldt, M., Bjarnadottir, O., Kimbung, S., Jirström, K., Bendahl, P.-O., Veerla, S., Grabau, D., Hedenfalk, I., and Borgquist, S.(2015). Efectos antiproliferativos inducidos por estatinas a través de ciclina D1 y p27 en un ensayo de cáncer de mama de oportunidad. J. Trad. Mediterráneo. 13, 133.
Fife, R. S., and Sledge, G. W. (1995). Efectos de la oxiciclina sobre el crecimiento, la migración y la actividad de la gelatinasa in vitro de las células del cáncer de mama. J. Lab. Clin. Mediterráneo. 125, 407–411.
Fife, R. S., and Sledge, G. W. (1998). Efectos de la toxiciclina en las células cancerosas in vitro e in vivo. Adv. Dent. Res. 12, 94 a 96.
Fiorillo, M., Tóth, F., Sotgia, F., and Lisanti, M. P. (2019). Doxiciclina, Azitromicina y vitamina C (DAV) : una potente terapia combinada para atacar las mitocondrias y erradicar las células madre cancerosas (CSC).Aging 11, 2202-2216.
Foroodi, F., Duivenvoorden, W. C., and Singh, G. (2009). Interacciones de la doxiciclina con agentes quimioterapéuticos en células de adenocarcinoma de mama humano MDA-MB-231. Anticancerígena. Drogas 20, 115-122.
Garwood, E. R., Kumar, A. S., Baehner, F. L., Moore, D. H., Au, A., Hylton, N., Flowers, C. I., Garber, J., Lesnikoski, B.-A.,Hwang, E. S., et al. (2010). La fluvastatina reduce la proliferación y aumenta la apoptosis en mujeres con cáncer de mama de alto grado. Tratamiento de Cáncer de Mama. 119, 137–144.
Giles, E. D., Jindal, S., Wellberg, E. A., Schedin, T., Anderson, S. M., Thor, A. D., Edwards, D. P., MacLean, P. S., and Schedin, P. (2018). La metformina inhibe la expresión de la aromatasa estromal y la progresión tumoral en un modelo de cáncer de mama posmenopáusico de roedores. Cáncer de Mama Res.BCR 20.
Goodwin, P. J., Parulekar, W. R., Gelmon, K. A., Shepherd, L. E., Ligibel, J. A., Hershman, D. L., Rastogi, P., Mayer,I. A., Hobday, T. J., Lemieux, J., et al. (2015). Efecto de metformina frente a placebo sobre los factores metabólicos y en el NCIC CTG MA.32. J. Natl. Cáncer Inst. 107.
Hadad, S., Iwamoto, T., Jordan, L., Purdie, C., Bray, S., Baker, L., Jellema, G., Deharo, S., Hardie, D. G., Pusztai, L., et al.(2011). Pruebas de los efectos biológicos de la metformina en el cáncer de mama operable:un ensayo aleatorizado preoperatorio con ventana de oportunidad. Tratamiento de Cáncer de Mama. 128, 783–794.
Hadad, S. M., Hardie, D. G., Appleyard, V., andThompson, A. M. (2014). Efectos de la metformina en la proliferación celular del cáncer de mama, la vía AMPK y el ciclo celular. Clin. Transl. Oncol. Fuera.Publ. Fed. Abarcar. Oncol. Soc. Natl. Cáncer Inst. Mex. 16, 746–752.
Hatoum, D., and McGowan, E. M. (2015). Avances recientes en el uso de metformina: ¿puede el tratamiento de la diabetes prevenir el cáncer de mama? BioMedRes. Int. 2015, 548436.
Hirsch, H. A., Iliopoulos, D., Tsichlis, P. N., andStruhl, K. (2009). La Metformina Se Dirige Selectivamente a las Células Madre Cancerosas y actúa junto con la Quimioterapia para Bloquear el Crecimiento del Tumor y Prolongar la Remisión. CancerRes. 69, 7507–7511.
Hothi, P., Martins, T. J., Chen, L., Deleyrolle,L., Yoon, J.-G., Reynolds, B., and Foltz, G. (2012). Los exámenes Químicos de Alto Rendimiento Identifican al Disulfiram como un Inhibidor de las Células Madre de Glioblastoma Humano.Oncotarget 3, 1124-1136.
Hou, Z.-J., Luo, X., Zhang, W., Peng, F., Cui, B., Wu, S.-J., Zheng, F.-M., Xu, J., Xu, L.-Z., Long, Z.-J., et al. (2015).El flubendazol, antihelmíntico aprobado por la FDA, se dirige a las células parecidas al cáncer de mama.Oncotarget 6, 6326-6340.
Iliopoulos, D., Hirsch, H. A., and Struhl, K. (2011).La metformina disminuye la dosis de quimioterapia para prolongar la remisión tumoral en xenoinjertos de inyección que involucran múltiples tipos de células cancerosas. Cancer Res. 71,3196-3201.
Jacob, L., Kostev, K., Rathmann, W., y Kalder, M. (2016). Impacto de la metformina en las metástasis en pacientes con cáncer de mama y diabetes de tipo 2. J. Complicaciones de la diabetes 30, 1056-1059.
Jagust, P., de Luxán-Delgado, B., Parejo-Alonso, B., y Sancho, P. (2019). Estrategias Terapéuticas Basadas En El Metabolismo Dirigidas A Las Células del Tallo Canceroso. Delantero. Pharmacol. 10.
Jang, M., Kim, S. S., and Lee, J. (2013). Metabolismo celular canceroso: implicaciones para las dianas terapéuticas. Exp. Mol. Mediterráneo. 45, e45.
Jiralerspong, S., Palla, S.L., Giordano, S. H., Meric-Bernstam, F., Liedtke, C., Barnett, C. M., Hsu, L., Hung, M.-C., Hortobagyi, G. N., and Gonzalez-Angulo, A. M. (2009). Metformina y Respuestas Patológicas Completas a la Quimioterapia Neoadyuvante en Pacientes Diabéticas con cáncer de Mama. J. Clin. Oncol. 27, 3297–3302.
Kalinsky, K., Crew, K. D., Refice, S., Xiao, T., Wang, A., Feldman, S. M., Taback, B., Ahmad, A., Cremers, S., Hibshoosh, H., et al.(2014). Ensayo prequirúrgico de metformina en pacientes con sobrepeso y obesidad con cáncer de mama recién diagnosticado. Cancer Invest. 32, 150–157.
Kanugula, A. K., Gollavilli, P. N., Vasamsetti, S. B., Karnewar, S., Gopoju, R., Ummanni, R., and Kotamraju, S. (2014). La inhibición de la proliferación e invasión del cáncer de mama inducida por estatinas implica la atenuación del transporte de iones: intermediación de mecanismos de defensa de óxido nítrico y antioxidantes. FEBS J. 281, 3719-3738.
Kim, H. J., Kwon, H., Lee, J. W., Kim, H. J., Lee, S. B., Park, H. S., Sohn, G., Lee, Y., Koh, B. S., Yu, J. H., et al. (2015). La metformina aumenta la supervivencia en pacientes con cáncer de mama HER2 positivo con receptor hormonal y diabetes. Cáncer de Mama Res. BCR 17, 64.
Kim, J., Lim, W., Kim, E.-K., Kim, M.-K., Paik, N.-S., Jeong, S.-S., Yoon, J.-H., Park, C. H., Ahn, S. H., Kim, L. S., et al. (2014).Ensayo aleatorizado de fase II de metformina neoadyuvante más letrozol versus placeboplus letrozol para cáncer de mama posmenopáusico positivo con receptores de estrógeno (METEOR). Cáncer BMC 14, 170.
Kodach, L. L., Jacobs, R. J., Voorneveld, P. W., Wildenberg, M. E., Verspaget, H. W., van Wezel, T., Morreau, H., Hommes, D. W., Peppelenbosch, M. P., van den Brink, G. R., et al. (2011). Las estatinas aumentan la sensibilidad química de las células de cáncer colorrectal, inducen la reprogramación epigenética y reducen la «tronco» de las células de cáncer colorrectal a través de la vía de la proteína morfogenética ósea. Gut 60, 1544-1553.
Kozar, K., Kaminski, R., Legat, M., Kopec, M., Nowis, D., Skierski, J., Koronkiewicz, M., Jakóbisiak, M., and Golab, J. (2004).La cerivastatina demuestra una mayor actividad antitumoral contra líneas celulares de cáncer de mama humano cuando se usa en combinación con doxorrubicina o cisplatino. Int.J. Oncol.
Kroemer, G. y Pouyssegur, J. (2008). Metabolismo celular Tumoral: Talón de Aquiles del Cáncer. Célula cancerosa 13, 472-482.
Kwan, M. L., Habel, L. A., Flick, E. D., Quesenberry, C. P., and Caan, B. (2008). Uso de estatinas después del diagnóstico y reaparición del cáncer de mama en un estudio prospectivo de cohortes de sobrevivientes de cáncer de mama en estadio temprano. Tratamiento de Cáncer de Mama. 109, 573–579.Lacerda, L., Reddy, J. P., Liu, D., Larson, R., Li, L., Masuda, H., Brewer, T., Debeb, B. G., Xu, W., Hortobágyi, G. N., et al. (2014).La simvastatina sensibiliza a la radiación líneas celulares de cáncer de mama diferenciadas y similares al tallo y se relaciona con un mejor control local en pacientes de cáncer de mama inflamatorio tratadas con radiación posmastectomía. Células Madre Transl. Mediterráneo.3, 849–856.
Lamb, R., Fiorillo, M., Chadwick, A., Ozsvari, B., Reeves, K. J., Smith, D. L., Clarke, R. B., Howell, S. J., Cappello, A. R., Martinez-Outschoorn, U. E., et al. (2015a). La doxiciclina reduce la regulación del ADN-PK y radiosensibiliza las células iniciadoras de tumores: Implicaciones para una terapia de radiación más eficaz. Oncotarget 6, 14005-14025.
Lamb, R., Ozsvari, B., Lisanti, C. L., Tanowitz, H. B., Howell, A., Martinez-Outschoorn, U. E., Sotgia, F., and Lisanti, M. P. (2015b).Los antibióticos dirigidos a las mitocondrias erradican eficazmente las células madre del cáncer en múltiples tipos de tumores: tratan el cáncer como una enfermedad infecciosa.Oncotarget 6, 4569-4584.
Lehman, D. M., Lorenzo, C., Hernandez, J., and Wang, C. (2012). Uso de estatinas como Moderador del Efecto de la Metformina sobre el Riesgo de Cáncer de Próstata En Pacientes Diabéticos Tipo 2. Diabetes Care 35, 1002-1007.
Lin, C., Lo, M., Moody, R., Stevers, N., Tinsley, S., and Sun, D. (2018). La doxiciclina se dirige a las células del tallo del cáncer de mama con aldehído deshidrogenasa positiva. Oncol. Rep.
Liu, B., Yi, Z., Guan, X., Zeng, Y.-X., and Ma, F. (2017). La relación entre las estatinas y el pronóstico del cáncer de mama varía según el tipo de cistatina y el tiempo de exposición: un metanálisis. Tratamiento de Cáncer de Mama. 164,1–11.
Liu, H., Scholz, C., Zang, C., Schefe, J. H., Habbel, P., Regierer, A.-C., Schulz, C.-O., Possinger, K., and Eucker, J. (2012).La metformina y el inhibidor de mTOR everolimus (RAD001) sensibilizan las células del cáncer de mama al efecto citotóxico de los fármacos quimioterapéuticos in vitro. Anticancerros. 32, 1627–1637.
Liu, X., Romero, I. L., Litchfield, L. M., Lengyel, E., and Locasale, J. W. (2016). La metformina se dirige al metabolismo central del carbono y satisface las necesidades mitocondriales en cánceres humanos. Metab de Celulares. 24, 728–739.
Ma, J., Guo, Y. Chen, S., Zhong, C., Xue, Y., Zhang,Y., Lai, X., Wei, Y., Yu, S., Zhang, J., et al. (2014). Inhibición del crecimiento tumoral mediada por metformina potenciador de amoxifeno en carcinoma de mama ER positivo. BMCCancer 14, 172.
Manthravadi, S., Shrestha, A., and Madhusudhana, S. (2016). Impacto del uso de estatinas en la recidiva y mortalidad del cáncer de mama: Una revisión sistemática y metanálisis. Int. J. Cancer 139, 1281-1288.
Mark, M., Klingbiel, D., Mey, U., Winterhalder, R., Rothermundt, C., Gillessen, S., von Moos, R., Pollak, M., Manetsch, G., Strebel, R., et al. (2019). Impacto de la Adición de Metformina a Abiraterona en Pacientes con Cáncer de Próstata Metastásico Resistente a la Castración Con Progresión de la Enfermedad Mientras reciben Tratamiento con Abiraterona (MetAb-Pro): Estudio Piloto de Fase 2. Clin. Genitourin. Cáncer 17, e323-e328.
Martin-Castillo, B., Pernas, S., Dorca, J., Álvarez,I., Martínez, S., Pérez-Garcia, J.M., Batista-López, N., Rodríguez-Sánchez,C.A., Amillano, K., Domínguez, S., et al. (2018). A phase 2 trial ofneoadjuvant metformin in combination with trastuzumab and chemotherapy in womenwith early HER2-positive breast cancer: the METTEN study. Oncotarget 9,35687–35704.
Mokhtari, R.B., Homayouni, T.S., Baluch, N.,Morgatskaya, E., Kumar, S., Das, B., and Yeger, H. (2017). Combination therapyin combating cancer. Oncotarget 8, 38022–38043.
Mück, A.O., Seeger, H., and Wallwiener, D. (2004).Efecto inhibitorio de las estatinas en la proliferación del cáncer de mama humano cells.Int J. Clin. Pharmacol. Allí. 42, 695–700.
Mukhopadhyay, T., Sasaki, J., Ramesh, R., and Roth,J. A. (2002). El mebendazol Provoca un Potente Efecto Antitumoral en las Líneas Celulares Cancerosas Humanas Tanto in Vitro como in Vivo. Clin. Cancer Res. 8, 2963-2969.
Murtola, T. J., Visvanathan, K., Artama, M.,Vainio, H., and Pukkala, E. (2014). Statin use and breast cancer survival: a nationwidecohort study from Finland (en inglés). PLoS One 9, e110231.
Nanni, O., Amadori, D., De Censi, A., Rocca, A., Freschi, A., Bologna, A., Gianni, L., Rosetti, F., Amaducci, L., Cavanna, L., et al. (2019). Metformina más quimioterapia versus quimioterapia sola en el tratamiento de primera línea del cáncer de mama metastásico HER2 negativo. El ensayo clínico de fase 2 de Myanmar. Tratamiento de Cáncer de Mama. 174, 433–442.
Nimako, G. K., Wintrob, Z. A. P., Sulik, D. A., Donato, J. L., and Ceacareanu, A.C. (2017). Beneficio Sinérgico de las Neoplasias malignas gastrointestinales de Estatinas y Metforminas. J. Pharm. Pract. 30, 185–194.
Niraula, S., Dowling, R. J. O., Ennis, M., Chang, M. C., Done, S. J., Hood, N., Escallon, J., Leong, W. L., McCready, D. R., Reedijk,M., et al. (2012). Metformina en el cáncer de mama precoz: un estudio neoadyuvante prospectivo de ventana de oportunidad. Tratamiento de Cáncer de Mama. 135, 821–830.
Nygren, P., and Larsson, R. (2014). Reposicionamiento de fármacos desde el banco hasta la cama: Remisión de tumores mediante el fármaco antihelmíntico mebendazoleína, cáncer de colon metastásico refractario. Acta Oncol. 53, 427–428.
Orecchioni, S., Reggiani, F., Talarico, G., Mancuso, P., Calleri, A., Gregato, G., Labanca, V., Noonan, D. M., Dallaglio, K., Albini, A., et al. (2015). Las biguanidas metformina y fenformina inhiben la angiogénesis, el crecimiento local y metastásico del cáncer de mama al dirigirse a las células neoplásicas y del microambiente. Int. J. Cáncer 136, E534-544.Ozsvari, B., Sotgia, F., y Lisanti, M. P. (2017). Un nuevo enfoque independiente de la mutación para la terapia del cáncer: Inhibición de RAS y MYC oncogénicos, al dirigirse a la biogénesis mitocondrial. Aging 9, 2098-2116.
Pantziarka, P., Bouche, G., Meheus, L., Sukhatme, V., and Sukhatme, V. P. (2014). Fármacos de reutilización en oncología (Rehacer): agente anticancerígeno mebendazol asan. Ciencia médica ecológica 8.
Peiris-Pagès, M., Sotgia, F., y Lisanti, M. P. (2015). Doxiciclina y orientación terapéutica de la respuesta al daño del ADN células cancerígenas: fármaco antiguo, nuevo propósito. Oncoscience 2, 696-699.
Rahmani, J., Manzari, N., Thompson, J., Gudi, S. K., Chhabra, M., Naik, G., Mousavi, S. M., Varkaneh, H. K., Clark, C., and Zhang, Y. (2019). El efecto de la metformina sobre los biomarcadores asociados con el cáncer de mama resultados: una revisión sistemática, metanálisis y respuesta a la dosis de ensayos clínicos aleatorizados. Clin. Transl. Oncol.
Scatena, C., Roncella, M., Di Paolo, A., Aretini, P., Menicagli, M., Fanelli, G., Marini, C., Mazzanti, C. M., Ghilli, M., Sotgia,F., et al. (2018). La Doxiciclina,un Inhibidor de la Biogénesis Mitocondrial, Reduce Eficazmente las Células Madre Cancerosas (CSC) en Pacientes con Cáncer de Mama Temprano: Estudio Piloto Clínico. Delantero. Oncol. 8.
Seeger, H., Wallwiener, D., y Mueck, A. O. (2003).Las estatinas pueden inhibir la proliferación de células cancerosas de mama humanas in vitro. Exp.Clin. Endocrinol. Diabetes Fuera. J. Ger. Soc. Endocrinol. Ger. Diabetes Assoc.111, 47–48.
Skoda, J., Borankova, K., Jansson, P. J., Huang, M. L.-H., Veselska, R., and Richardson, D. R. (2019). Objetivo farmacológico de las mitocondrias en las células madre del cáncer: Un orgánulo antiguo en la encrucijada de las terapias novedosas contra el cáncer. Pharmacol. Res. 139, 298 a 313.
Sonnenblick, A., Agbor-Tarh, D., Bradbury, I., DiCosimo, S., Azim, H. A., Fumagalli, D., Sarp, S., Wolff, A.C., Andersson, M., Kroep, J., et al. (2017). Impact of Diabetes, Insulin, and Metformin Use on theOutcome of Patients With Human Epidermal Growth Factor Receptor 2-Positive Primary Breast Cancer: Analysis From the ALTTO Phase III Randomized Trial. J. Clin. Oncol. 35, 1421–1429.
Van Wyhe, R. D., Rahal, O. M., y Woodward, W. A. (2017). Efecto de las estatinas en la recurrencia y mortalidad del cáncer de mama: una revisión.El Cáncer De Mama Se Dirige Allí. 9, 559–565.
Vázquez-Martin, A., Oliveras-Ferraros, C., Cufí, S.,Del Barco, S., Martin-Castillo, B., Lopez-Bonet, E., y Menéndez, J. A. (2011).El fármaco antidiabético metformina suprime la proteína asociada a metástasis D24 en células de cáncer de mama triple negativo MDA-MB – 468. Oncol. República 25,135–140.
Vintonenko, N., Jais, J.-P., Kassis, N., Abdelkarim, M., Perret, G.-Y., Lecouvey, M., Crepin, M., and Di Benedetto, M. (2012).Análisis de transcriptomas y actividad in vivo de fluvastatina versus zoledronicácido en un modelo de metástasis de cáncer de mama murino. Mol. Pharmacol. 82, 521–528.
Wahdan-Alaswad, R. S., Cochrane, D. R., Spoelstra, N. S., Howe, E. N., Edgerton, S. M., Anderson, S. M., Thor, A. D., and Richer, J. K.(2014). La eliminación inducida por metformina de células de cáncer de mama triple negativo es mediada por la reducción de la sintasa de ácidos grasos a través de miARN-193b.Horm. Cáncer 5,374–389.
Wang, Z.-S., Huang, H.-R., Zhang, L.-Y., Kim, S., He, Y., Li, D.-L., Farischon, C., Zhang, K., Zheng, X., Du, Z.-Y., et al. (2017).Estudio Mecanicista de los Efectos Inhibidores de la incombinación de Metformina y Atorvastatina en Células Cancerosas de Próstata in Vitro e in Vivo. Biol. Farmacéuticas. Toro.40, 1247–1254.
Wolfe, A. R., Debeb, B. G., Lacerda, L., Larson, R., Bambhroliya, A., Huang, X., Bertucci, F., Finetti, P., Birnbaum, D., Van Laere, S., et al. (2015). La simvastatina previene la metástasis del cáncer de mama triple negativo en modelos preclínicos a través de la regulación de los cánceres de mama FOXO3a. Tratar. 154, 495–508.
Xu, H., Chen, K., Jia, X., Tian, Y., Dai, Y., Li, D., Xie, J., Tao, M., and Mao, Y. (2015). El Uso De Metformina Se Asocia Con Una Mejor Supervivencia de Pacientes con Cáncer de Mama Con Diabetes: Un Metanálisis. TheOncologist 20, 1236-1244.
Yam, C., Esteva, F. J., Patel, M. M., Raghavendra, A. S., Ueno, N. T., Moulder, S.L., Hess, K. R., Shroff, G. S., Hodge, S., Koenig,K. H., et al. (2019). Eficacia y seguridad de la combinación de metformina, everolimus y exemestano en pacientes posmenopáusicas obesas y con sobrepeso con cáncer de mama metastásico,positivo para receptores hormonales y negativo para HER2: un estudio de fase II.Invertir. New Drugs 37, 345-351.
Yao, H., He, G., Yan, S., Chen, C., Song, L., Rosol, T.J., and Deng, X. (2017). Cáncer de mama triple negativo: ¿hay algún tratamiento en el horizonte? Oncotarget 8, 1913-1924.
Zhang, L., Guo, M., Li, J., Zheng, Y., Zhang, S., Xie, T., and Liu, B. (2015). Descubrimiento basado en la biología de sistemas de un atg4bagonista potencial (flubendazol) que induce la autofagia en el cáncer de mama. Mol. Biosystem.11, 2860–2866.
Zhang, L., Xu, L., Zhang, F., and Vlashi, E. (2017).La doxiciclina inhibe el fenotipo de las células madre cancerosas y la transición epitelial a mesenquimal en el cáncer de mama. Georget de Ciclo Celular. Tex16, 737-745.
Zhang, L., Bochkur Dratver, M., Yazal, T., Dong, K., Nguyen, A., Yu, G., Dao, A., Bochkur Dratver, M., Duhachek-Muggy, S., Bhat,K., et al. (2019a). El Mebendazol Potencia la Radioterapia en el Cáncer de Mama Triple Negativo. Int. J. Radiat. Oncol. Biol. Phys. 103, 195–207.
Zhang, Y., Storr, S. J., Johnson, K., Green, A. R., Rakha, E. A., Ellis, I. O., Morgan, D. A. L., and Martin, S. G. (2014). Implicación de metformina y AMPK en la radiorrespuesta y pronóstico del cáncer de mama de tipo versusbasal luminal tratado con radioterapia. Oncotarget 5, 12936-12949.
Zhang, Z.-J., Yuan, J., Bi, Y., Wang, C., and Liu, Y.(2019b). El efecto de la metformina sobre los biomarcadores y la supervivencia del cáncer de mama: una revisión sistemática y metanálisis de ensayos clínicos aleatorizados. Pharmacol.Res. 141, 551-555.
Zhong, S., Zhang, X., Chen, L., Ma, T., Tang, J., andZhao, J. (2015). Uso de estatinas y mortalidad en pacientes con cáncer: Revisión sistemática y metanálisis de estudios observacionales. Tratamiento para el Cáncer. Apo. 41, 554-567.
