Une partie importante de la compréhension du fonctionnement de ces systèmes pour contrôler la division cellulaire a été la découverte que la p53 a un impact à la fois sur le cancer et l’âge. Tyner et coll. (2002) ont mis au point une stratégie agénétique chez la souris pour comparer les effets de l’absence de p53 ou d’asmaller que la protéine p53 normale. Les lignées de souris transgéniques à deux mutants présentaient soit une délétion complète du gène p53 (p53-), soit une forme tronquée de p53 (p53m, mutant) qui n’avait pas les six premiers exons du gène p53 (Figure 2).
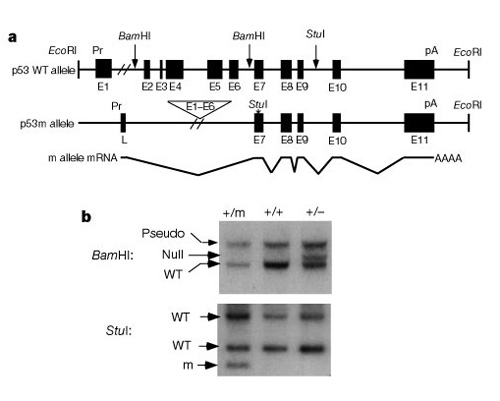
La première moitié de l’étude a comparé trois groupes de souris: groupe 1, p53+/p53- (suppression d’une copie de p53); groupe 2, p53 +/p53m (mutant à suppression partielle); et groupe 3, p53+/p53+ (type sauvage , normal). Le tableau 1 montre ces trois groupes et leurs résultats expérimentaux liés aux phénotypes du cancer et du vieillissement. Fait intéressant, aucune des souris du groupe 2, avec la protéine p53 tronquée, n’a développé de tumeurs potentiellement mortelles, tandis que 45% du groupe 3 (type sauvage) et plus de 80% du groupe 1 ont développé des tumeurs potentiellement mortelles. Les souris du groupe 2 avaient également une durée de vie intermédiaire entre la durée de vie très courte du groupe 1 et la durée de vie plus longue des souris de type sauvage du groupe 3. La conclusion de ces données est que la mutation partielle de p53 a réduit l’incidence decancer, et en même temps semblait causer un déficit de durée de vie, pas une durée de vie prolongée.
| Tableau 1. Experimental results from genetic mousestudies with p53 mutants | |||
| Genotype | Cancer phenotype | Agingphenotype | |
| Group 1 | p53+/p53- (complete deletion) | 80%had tumors | Muchshorter life span |
| Group 2 | p53+/p53m (partial mutant) | None | Shorterlife span |
| Group 3 | p53+/p53+ (wild type) | 45%had tumors | Normallife span |
| Adapté de Tyner etal. 2002 | |||
Les auteurs ont également noté que les souris du groupe 2 développaient des phénotypes caractéristiques des vieilles souris, tels que la repousse lente des cheveux et les épines bossues dues à la des changements, plus tôt que les souris sauvages l’ont fait (figure 3).

Dans la seconde moitié de l’étude, Tyner et ses collègues ont demandé si le mutant p53 fonctionnait différemment en présence de p53 normal. Ils ont élevé une lignée de souris transgéniques supplémentaire avec des mutantallèles p53-/ p53m et ont constaté que ces souris n’avaient pas la forte protection tumorale et affichaient un effet de durée de vie beaucoup moins important. Ainsi, le mutant p53 devait en quelque sorte fonctionner sans accord avec le p53 normal pour avoir un effet. Comme observation générale, les chercheurs ont rapporté que les cellules de l’hétérozygote p53 + / p53m se sont avérées environ trois fois plus difficiles à transplanter que les cellules de type sauvage. Ainsi, bien que ces cellules soient résistantes au cancer, ce fond de terre p53 + / p53m a également provoqué un vieillissement plus précoce. En effet, l’activité de p53 dans ces hétérozygotes semblait être nettement supérieure à son activité dans la nature type.It il semblait qu’un tel changement, bien qu’apriori, serait bon contre le cancer et la sénescence, mais cela ne s’est pas avéré être le cas.
Plus tard, Mooreet al. démontré que dans les cellules cultivées avec la même mutation provoquant une protéine p53 tronquée, cette protéine tronquée est entrée dans le noyau et s’est colocalisée avec la p53 normale. Ils ont également étudié la demi-vie de la protéine p53 dans les cellules et ont constaté que les hétérozygotes avec une copie du mutant p53 avaient environ une augmentation de trois fois la stabilité de la protéine p53 normale, par rapport à la stabilité dans le seul type sauvage, ce qui signifie que la stabilité de la protéine était améliorée par rapport à la normale. Ces résultats dans des cellules cultivées ont prolongé et confirmé l’étude menée par Tyner et al. chez la souris. De plus, il s’agissait de la première voie de réponse à la division cellulaire découverte pour fonctionner via p53 et moduler clairement à la fois l’indentivité du cancer et le vieillissement.
Dans la voie Rb, qui peut signaler la sortie du cycle de division cellulaire, des événements tels que des dommages à l’ADN ou une réplication insuffisante conduisant à des télomères courts aux extrémités des chromosomes entraînent une diminution de la signalisation CDK. Cela augmente l’activité de la protéine kinase Rb et augmente par conséquent l’activité du facteur de transcription E2F. Quelle est la signification de l’E2F? Ce facteur de transcription se lie aux promoteurs des sous-unités de l’ARN polymérase et aux autres protéines nécessaires au début de la phase S, et il aide à démarrer la division cellulaire (Campisi 2003; Weinberg 1995). Il semble donc que les voies p53 et Rb empiètent sur les mêmes mécanismes de contrôle du cycle cellulaire.
