L’utilisation d’une terminologie cohérente au sein et entre les études est essentielle pour permettre un processus d’essai efficace. Les normes CDISC telles que CDASH, SDTM, SEND et ADaM standardisent les structures à utiliser lors de la collecte et de la soumission des données, mais qu’en est-il des valeurs de données elles-mêmes?
Cet article donne un aperçu de la terminologie contrôlée normalisée du CDISC et de la façon dont elle devrait être utilisée pour collecter et soumettre des données de manière à accélérer les essais et à permettre une analyse croisée.
Si vous souhaitez en savoir plus sur les normes CDISC, vous pouvez lire nos blogs Tout ce que vous devez savoir sur SDTM et Introduction aux normes CDISC.
Le CDISC s’associe au NCI pour définir une terminologie normalisée
Le CDISC s’est associé au National Cancer Institute (NCI) pour contribuer à la cohérence de la terminologie dans les essais cliniques. Grâce à cette collaboration, un ensemble standard de terminologie a été défini et mis à jour tous les trimestres, apportant une cohérence sémantique entre les études. En utilisant cette terminologie, la même information sera représentée de la même manière dans toutes les études.
Prenons un exemple simple – Le sexe:
- Le mâle devrait-il être représenté par « Mâle », « MÂLE », « M » ou « 1 »?
- Comment une personne intersexuée doit-elle être enregistrée?
Autrefois, ces informations pouvaient avoir été collectées de différentes manières pour chaque étude. La norme terminologique du CDISC NCI définit maintenant que les seules options admissibles sont » F « , » M « , » U » et » INDIFFÉRENCIÉES « , et qu’une personne intersexuée doit être enregistrée comme » INDIFFÉRENCIÉE « . Vous pouvez voir comment cet exemple très simple facilite déjà la compréhension des données sous-jacentes et la segmentation facile pour différentes populations d’une étude à l’autre.
![]() Note
Note
Le catalogue de normes de données de la FDA exige désormais que la terminologie NCI normalisée soit utilisée pour toutes les nouvelles normes de données études. Cela rend la vie d’un examinateur beaucoup plus facile, car il sait interpréter les données.

Comment la terminologie CDISC NCI est-elle définie?
Le tableau ci-dessous montre comment la terminologie standard du sexe est définie.
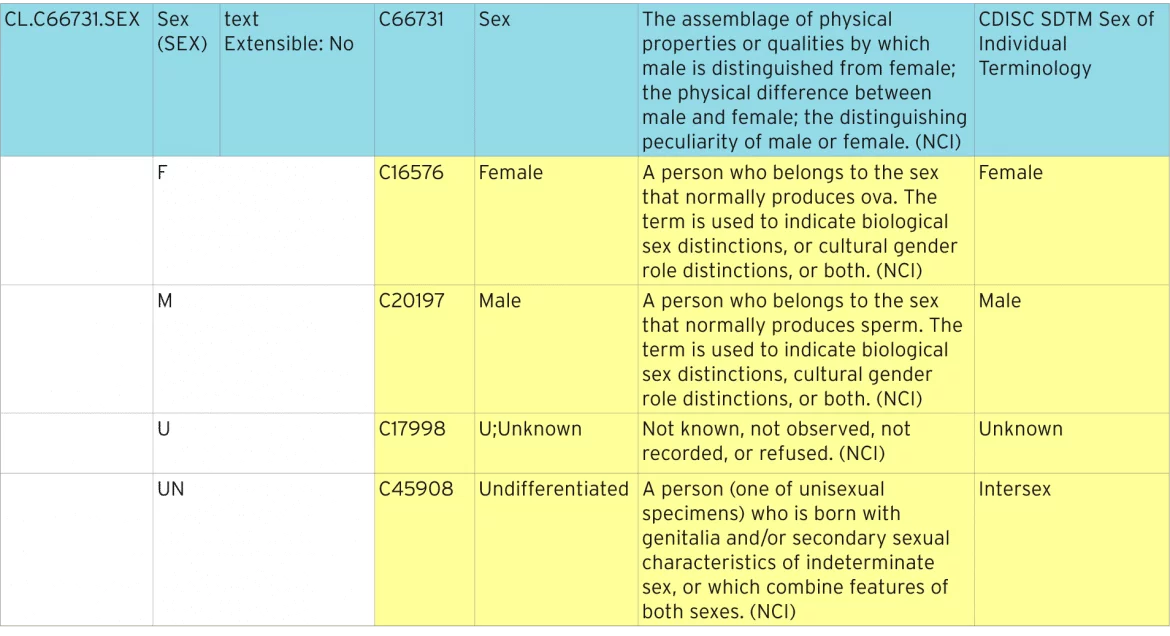
Identification de la terminologie normalisée
La ligne bleue représente la liste de codes qui contient tous les codes individuels. La liste de codes a un « code C » standard de « C66731 ». Chacun des codes individuels a son propre code C, par exemple « C16576 ». Ces codes C sont utilisés dans les métadonnées ODM et Define-XML pour identifier les listes de codes comme étant la terminologie standard de NCI.
Extensibilité
Cette liste de codes est définie comme étant non extensible, ce qui signifie que partout où la liste de codes est utilisée, elle ne doit contenir aucun terme non répertorié ici. Les listes de codes qui sont extensibles peuvent avoir des termes supplémentaires ajoutés. Ces termes supplémentaires doivent être décrits dans Define-XML comme étant des termes étendus et ne peuvent pas être dupliqués ou synonymes de termes existants.
Valeur de la soumission, Synonymes et Terme préféré
La valeur de la soumission est ce qui doit être soumis à un organisme de réglementation. La valeur réellement affichée sur un formulaire peut être différente, et peut-être l’un des synonymes ou le Terme préféré.
Disponible en plusieurs couleurs
Les normes terminologiques NCI sont disponibles dans un certain nombre de formats pour répondre à différents besoins, notamment Excel, ODM, HTML et RDF. L’exemple ci-dessus est tiré de la version Excel.
Regroupés en sous-ensembles pour CDASH, SDTM, ADaM et plus
Pour plus de commodité, la terminologie NCI est regroupée en un certain nombre de sous-ensembles.
- La terminologie SDTM contient des termes à utiliser dans une soumission basée sur SDTM
- La terminologie CDASH contient des termes à utiliser dans la collecte de données basée sur CDASH
- La terminologie ADaM contient des termes à utiliser dans des ensembles de données ADaM
- La terminologie SEND contient des termes à utiliser dans une soumission basée sur SEND
- La terminologie du protocole contient des termes à utiliser avec le Modèle de représentation de protocole (PRM) et le Registre d’essais cliniques XML (CTR-XML)
Utilisation de la terminologie CDISC NCI dans une étude
Lors de la définition des métadonnées de soumission dans Define-XML, des listes de codes sont utilisées pour définir des listes fixes de valeurs pour certaines variables. Conformément à la réglementation en vigueur de la FDA, ces listes de codes doivent être conformes à la terminologie normalisée CDISC NCI, lorsqu’une telle terminologie existe. Ils sont liés à la terminologie normalisée en ajoutant des alias aux codes C, par exemple:
<Alias Name="C66731" Context="nci:ExtCodeID"/>
Lors de la définition des métadonnées de collecte de données dans ODM, il n’est pas nécessaire d’utiliser la terminologie normalisée, cependant, cela supprimera la nécessité de mapper des termes de vos données collectées à vos données soumises. Cela simplifie grandement votre processus d’étude de bout en bout et augmente la cohérence entre les études.
Gestion des mises à jour
La gestion des mises à jour terminologiques peut représenter un travail considérable, en particulier si les normes sont mises à jour régulièrement. Comment savez-vous quelles études ou normes organisationnelles pourraient être affectées par la nouvelle terminologie? Comment effectuez-vous ensuite les mises à jour requises de manière efficace et fiable?
Le moyen le plus simple de gérer cela consiste à utiliser un référentiel de métadonnées compatible CDISC qui vous permet de définir des normes organisationnelles basées sur la terminologie normalisée et de construire vos études à partir de ces normes. Comme le référentiel comprend les relations entre toutes les normes et vos études, il peut simplifier le processus de mise à jour vers de nouvelles versions des normes terminologiques CDISC NCI.
