Présentation du patient
Le patient est un fumeur mince de 40 ans qui s’est présenté au Service des urgences se plaignant d’inconfort thoracique et d’engourdissement. Il a remarqué une nouvelle masse sur sa paroi thoracique gauche, qui s’était progressivement agrandie au cours des 3 derniers mois. Plus récemment, il avait développé une paresthésie dans la peau recouvrant la masse et avait diminué l’amplitude de mouvement de son épaule gauche en raison d’une oppression thoracique. Le patient a des antécédents d’alcoolisme et de mauvaise dentition, y compris des abcès dentaires récurrents, le plus récent ayant duré deux mois et s’étant vidé spontanément. Il déclare avoir eu une toux sèche et non productive au cours de l’année précédente. Il rapporte un récent 15-20 lb. perte de poids et antécédents de sueurs nocturnes de 4 semaines. Ses antécédents médicaux et chirurgicaux sont par ailleurs insignifiants, à l’exception de l’asthme infantile. Un examen supplémentaire des systèmes n’a pas été révélé.
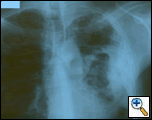
Figure 1: Le film thoracique de PA révèle une masse à base pleurale gauche avec un épaississement pleural et une cicatrisation du lobe supérieur.
Lors de l’examen physique, le patient était afébrile avec des signes vitaux stables. C’était un homme mince qui semblait plus âgé que son âge déclaré. L’examen de la tête et du cou a révélé une mauvaise dentition sans lymphadénopathie cervicale ou supraclaviculaire palpable. Il y avait une masse de paroi thoracique gauche d’environ 6 cm de diamètre entourant le mamelon gauche, qui était ferme, non mobile et non sensible à la palpation. Il n’y avait pas de décoloration de la peau, d’érythème, de fluctuation ou de sinus drainants notés. Le patient avait une amplitude de mouvement passive complète de son épaule gauche. L’examen pulmonaire était clair bilatéralement, sans râles, ronces ou respiration sifflante significative. Son examen cardiovasculaire et son examen restant étaient sans anomalie grave. Ses valeurs de laboratoire de chimie étaient dans la plage normale. Le patient a un nombre de globules blancs de 9 800, un différentiel normal, et ses sérologies du VIH étaient négatives.
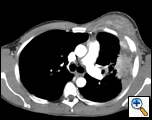
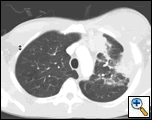
L’AP et le film thoracique latéral ont révélé une consolidation inégale du poumon gauche avec une masse pleurale importante, un épaississement pleural apical gauche et une cicatrisation du lobe supérieur droit (Figure 1). La tomodensitométrie hélicoïdale de la poitrine, de l’abdomen et du bassin avec contraste montre une grande masse pleurale gauche de 10,8 x 4,1 cm s’étendant dans la paroi thoracique et le sein gauche (figure 2). Il y avait un épaississement périoste et une irrégularité des côtes adjacentes. Plusieurs nœuds médiastinaux, hilaires gauches et supraclaviculaires élargis ont été notés, les plus grands de 1,5 x 2,6 cm dans la fenêtre AP ou la région de la station cinq. Il y avait une consolidation inégale des lobes supérieurs gauche et droit. Une IRM du thorax avec contraste a été obtenue et a confirmé la présence d’une adénopathie supraclaviculaire gauche et une masse améliorée avec extension dans la paroi thoracique impliquant les côtes, infiltration du muscle pectoral et extension dans le parenchyme pulmonaire gauche. Les principaux diagnostics différentiels à cette époque étaient les néoplasmes (sarcome, cancer du poumon avancé, mésothéliome, lymphome, ostéosarcome).
 |
|
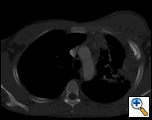 |
| Figure 2a: La fenêtre des tissus mous du thorax par tomodensitométrie montre une masse à base pleurale gauche infiltrant la paroi thoracique et le sein gauche. | Figure 2b: La fenêtre pulmonaire montre la même chose et met également en évidence la lymphadénopathie médiastinale et la consolidation pulmonaire. | Figure 2c: La fenêtre osseuse montre la même chose et montre également la réaction périostée des côtes. |
Une biopsie à l’aiguille Tru-cut a été réalisée au chevet du patient, ce qui a révélé des résultats pathologiques non spécifiques, mais une répétition avec un échantillonnage accru a révélé une inflammation aiguë et chronique avec un tissu de granulation contenant des Actinomyces confirmé par un décalage acide périodique (PAS), la méthamine argentée de Gomori (GMS) et des taches de gramme modifiées (Figure 3). Le traitement a commencé avec de la pénicilline G par voie intraveineuse (4 millions d’unités toutes les 4 heures pendant un traitement de 6 semaines) qui sera suivie d’amoxicilline orale pendant 6 à 12 mois. Une nouvelle tomodensitométrie était prévue dans 4 semaines, car l’actinomycose est connue pour coloniser les tissus malins. Le patient, à trois mois de suivi, se portait bien du point de vue pulmonaire et présentait une régression de la masse de sa paroi thoracique.
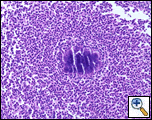 |
 |
| Figure 3a: (H&E) Un infiltrat neutrophile entoure une masse d’Actinomycètes formant un granule de soufre. | Figure 3b: Les organismes (GMS) apparaissent sous forme de bactéries filamenteuses ramifiées. À la périphérie du nodule, le phénomène dit « Splendore-Hoeppli » du clubbing est évident. |
Discussion
L’actinomycose est une infection granulomateuse chronique suppurée causée par des espèces d’Actinomyces, le plus souvent A. israelii. De nombreux cas d’actinomycose sont en fait polymicrobiens et se propagent par extension directe dans les tissus adjacents. Le premier rapport de cas chez l’homme date de 1857, suivi du premier rapport de cas d’actinomycose thoracique en 1882. La présentation la plus fréquente (> 50%) de l’actinomycose est cervicofaciale, se présentant généralement sous la forme d’une masse de mâchoire, l’actinomycose thoracique représentant entre 15 et 50% des cas selon la série. La maladie se manifeste dans un ratio hommes / femmes de 3: 1, peut-être en raison d’une mauvaise hygiène buccale et d’une incidence plus élevée de traumatismes faciaux chez les hommes. Il existe également une distribution bimodale de l’âge: 11-20 ans et les 4ème-5ème décennies de vie, où ce patient s’adapte. Les patients atteints de maladies sous-jacentes sont prédisposés à l’infection, mais elle peut survenir chez des individus autrement en bonne santé. Fait intéressant, il ne semble pas y avoir d’augmentation du nombre de patients immunodéprimés, y compris ceux atteints du VIH, greffés d’organes ou sous stéroïdes. Au Royaume-Uni, les patients atteints de BPCO, de bronchite et d’alcooliques sont prédisposés à l’actinomycose, tandis qu’au Japon, une association est trouvée avec les caries dentaires (19%), le diabète (13%) et la pyorrhée alvéolaire (6%). La présentation la plus courante d’actinomycose pulmonaire au Royaume-Uni est la toux, la fièvre et les douleurs thoraciques. Dans un examen de 95 cas au Japon, les présentations les plus courantes étaient: hémoptysie (42%), toux ou expectorations (37%), fièvre (28%). Une maladie avancée ou disséminée peut être associée à une perte de poids, à un malaise, à une forte fièvre et à des sinus drainants.
L’actinomycose peut être trouvée dans la flore de l’oropharynx, en particulier dans la plaque dentaire et dans le tractus gastro-intestinal. Ainsi, l’aspiration et l’aérosolisation ont été proposées comme mécanismes de l’actinomycose pulmonaire. Ce mécanisme pourrait être en corrélation avec l’incidence plus élevée chez les alcooliques et chez les patients ayant une mauvaise hygiène buccale, comme le patient présenté ici. Cette étiologie est également compatible avec la découverte fréquente d’une atteinte du lobe inférieur et du poumon périphérique de l’actinomycose pulmonaire. Cependant, d’autres étiologies comme la propagation hématogène des emboles septiques dues à l’érosion des vaisseaux ont été proposées car des individus apparemment normaux peuvent être atteints d’actinomycose pulmonaire et des anomalies radiologiques du lobe supérieur ont été notées avec une certaine fréquence. Dans l’ensemble, l’actinomycose est assez rare et son incidence et sa virulence diminuent, peut-être en raison d’une meilleure hygiène buccale et d’une utilisation plus répandue d’antibiotiques pour traiter d’autres affections.
La difficulté du diagnostic réside dans la rareté de la maladie, sa ressemblance radiologique avec une maladie maligne, et la difficulté à identifier ou à cultiver l’organisme (< 50% de réussite), car elle est très fastidieuse et nécessite une coloration spéciale avec de la méthamine argent (GMS) ou une coloration de Gram modifiée. L’observation de « filaments ramifiés » est insuffisante pour faire la distinction entre colonisation et infection, mais la présence de « granules de soufre » qui sont en fait des colonies d’Actinomyces, suggèrent une actinomycose infectieuse. Les résultats de laboratoire ne sont pas spécifiques; une leucocytose légère et des marqueurs inflammatoires élevés, notamment la vitesse de sédimentation des érythrocytes (ESR) et la protéine C-réactive (CRP), peuvent être observés. Les résultats radiographiques courants de l’actinomycose thoracique comprennent la périostite ondulée, la fibrose pulmonaire, la cavitation et l’épaississement pleural et l’ostéoarthropathie pulmonaire. Bon nombre de ces caractéristiques ont été observées par radiographie dans le cas actuel et peuvent être confondues avec une tumeur maligne. Une bronche normale vue entrant dans une lésion de masse peut être utile pour distinguer l’actinomycose de la malignité, car une bronche normale n’est presque jamais vue avec une grosse tumeur. L’aspiration à l’aiguille fine (ANF) ou la biopsie Tru-cut peuvent être utilisées pour le diagnostic des tissus, mais présente un taux de faux négatifs élevé, vu par la difficulté d’obtenir un échantillon adéquat dans le cas actuel. La thoracoscopie assistée par vidéo (VATS) peut être particulièrement utile pour le diagnostic d’actinomycose pulmonaire ou thoracique périphérique. Il offre les avantages de la visualisation directe et la possibilité de prélever des échantillons de tissus plus importants. Malheureusement, la plupart des diagnostics d’actinomycose thoracique ou pulmonaire sont toujours effectués à la thoracotomie, y compris plus de la moitié des cas au Japon et à Taiwan.
Le traitement de première intention de l’actinomycose est médical avec des cours prolongés de pénicilline intraveineuse pendant 2 à 6 semaines suivis de pénicilline orale ou d’amoxicilline pendant 6 à 12 mois. La doxycycline peut être utilisée comme substitut chez les patients allergiques à la pénicilline. La chirurgie joue un rôle dans la gestion des complications de l’actinomycose, y compris les abcès, l’empyème, la fistule et l’hémoptysie. L’hémoptysie due à l’actinomycose s’est avérée avoir un 36.taux de 4% de nouveau saignement dans les six mois suivant la sortie de l’hôpital pour les patients traités médicalement, et mortalité de 50% chez les patients qui saignent à nouveau. Un traitement précoce conduit à un excellent résultat avec une faible mortalité, mais dans l’ensemble, l’actinomycose pulmonaire a un pronostic plus mauvais que la maladie dans d’autres endroits.
