Message urgent: Lorsqu’un patient relativement jeune se présente aux soins d’urgence avec une douleur thoracique, il peut y avoir ou non une cause « typique ». Une évaluation rapide et une évaluation précise des facteurs de risque sont essentielles à l’efficacité des soins et, souvent, à la survie du patient.
Max Palatnik, MD
Présentation du cas
Un homme de 35 ans s’est présenté à 21h59 avec une plainte principale de douleur thoracique; à 22h03, nous avons noté ce qui suit:
Temp: 98,9
Pouls: 103
Resp: 16
Syst: 122
Diast: 69
O2Sat: 99%
Antécédents de maladie actuelle (douleur thoracique) 22:47) (Mot à mot)
Pt. homme de 38 ans atteint d’une myocardite et d’une péricardite en 1983 et 1991, qui a dîné à 18h30 et a commencé à ressentir une pression sur sa poitrine antérieure en regardant la télévision à 19h30. – j’avais l’impression que « certains étaient assis sur ma poitrine » » SANGLOT associé et rayonnement dans son épaule et sa main gauche « picotements ». Il a eu des brûlures d’estomac, mais cela semblait différent. J’ai pris du bicarbonate de soude (qu’il prend normalement pour ses brûlures d’estomac) et cela n’a pas aidé. Pas de syncope, de nausées, de vomissements, de fièvre, de douleur ou d’antécédents d’intolérances alimentaires. Il avait des symptômes viraux il y a 2 semaines (toux non productive, sinus HA et PND qui ont tous disparu.) Aucune orthopnée, PND, relation entre la douleur et l’exercice, traumatisme thoracique, composante pleurétique
Antécédents médicaux / Triage
Médicaments, allergies courantes: Aucune
PMH: Myocardite / Péricardite
PSH: Aucune
SocHx: Non-fumeur
FamHx: Positif pour la CAO avec un frère de 52 ans atteint d’IM, père CABG à 53
Examen (22:52)
Général: Bien en apparence; bien nourri; sans détresse apparente.
Tête: Normocéphale; atraumatique.
Yeux : PERLA; OM intact
ORL : normal de la MT; nez normal; pas de rhinorrhée; La gorge est rouge et des exsudats légers.. Membranes muqueuses humides.
Cou: Souple; nontender; pas de lymphadénopathie cervicale. Aucun signe méningé
Cardiovasculaire: Normal S1, S2; pas de murmures, de frottements ou de galops. Pas de sensibilité reproductible de la paroi thoracique
Respiratoire: Excursion thoracique normale avec respiration; la respiration semble claire et égale bilatéralement; pas de sifflements, de rhonches ou de râles.
Abdomen: Bruits intestinaux normaux; non distendus; non-tendus; pas d’organomégalie palpable.
Extrémités: ROM normale dans les quatre extrémités; non sensible à la palpation; les impulsions distales sont normales et égales.
Peau: Normal pour l’âge et la race; chaud; sec; bonne turgescence; pas de lésions apparentes ni d’exsudat
Notes de progrès (23:12)
Il a reçu 2 aspirines pour bébés et SL NTG avec soulagement de l’inconfort thoracique. Il a ensuite placé 1 pouce de Nitropaste. À 00h44, sa douleur est revenue et son ECG a été répété. Il a reçu 15 mg de Maalox sans amélioration, puis ½ pouce de plus de NTP, ce qui a soulagé l’inconfort.
Résultats
ECG 1 : Ondes T aplaties inférieures et en V2-V6.
ECG 2 : Aucun changement
Labs 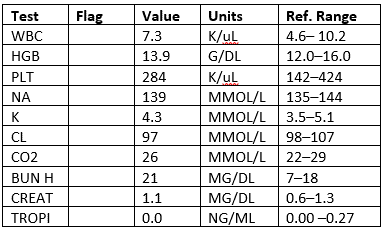
CXR: Diagnostic négatif
(01:57)
Douleur thoracique, antécédents de myocardite
Disposition (02:02)
Le patient a été admis à l’hôpital sous télémétrie.
Cours hospitalier
Pt. a subi des enzymes en série et répète l’ECG le matin. Il a exclu pour MI et a été libéré. Un ÉCHO de stress subséquent était négatif après 12,5 minutes d’exercice sans gêne thoracique ni modification de l’ECG.
Deuxième visite
- Le patient a suivi son PCP, a reçu un diagnostic de RGO et a commencé un IPP.
- Le patient est retourné à l’urgence 6 semaines plus tard avec une oppression thoracique et une dyspnée au moment d’un repas. Ses symptômes ont été aggravés par l’effort, se produisent au repos et sont améliorés par un positionnement vertical ainsi qu’avec Prilosec.
- Pas de fièvre associée, toux, radiations, diaphorèse, douleur au mollet, œdème périphérique.
- Le patient présente des signes vitaux normaux, avec un examen banal et approprié.
- ECG révèle TWI dans aVL, ainsi que de nouvelles ondes q dans les changements V1-V2 et NSST.
- CXR est négatif.
- Les laboratoires montrent une troponine qui est > 20 fois la limite supérieure de la normale.
- Le patient reçoit de l’aspirine, de l’héparine, du Plavix, de la nitroglycérine et est admis pour un syndrome coronarien aigu.
- Le patient subit une intervention coronarienne percutanée (ICP) avec un placement réussi du stent et est ensuite évacué en bon état.
Discussion
La douleur thoracique est la principale plainte pour plus de 5% des patients dans les services d’urgence (EDs) aux États-Unis. L’évaluation du patient souffrant de douleur thoracique est un défi énorme, en grande partie en raison du diagnostic différentiel large, mais aussi en raison du risque associé à un diagnostic erroné. Parmi les affections les plus rapidement mortelles en médecine d’urgence — dont beaucoup peuvent se présenter initialement aux soins d’urgence — figurent le syndrome coronarien aigu (ischémie myocardique et infarctus), la dissection aortique, l’embolie pulmonaire, la péricardite avec tamponnade cardiaque, la myocardite, le pneumothorax de tension et la rupture de l’œsophage. Toutes ces conditions ont tendance à se manifester par une douleur thoracique, et elles doivent toutes être prises en compte au début de l’évaluation du patient souffrant de douleur thoracique.
Il est de la responsabilité du médecin d’évaluer ces patients avec la liste des menaces potentielles pour la vie en haut du diagnostic différentiel. Un historique détaillé, un examen physique (en mettant l’accent sur les examens cardiaques, pulmonaires et vasculaires) et des informations de test de base (par exemple, électrocardiogramme, radiographie thoracique) peuvent souvent écarter rapidement ces menaces de mort avec une précision raisonnable. Cependant, dans les cas où cette évaluation rapide initiale n’exclut pas l’un des diagnostics mortels, un examen plus approfondi dans un cadre d’acuité plus élevée peut être justifié.
Bien que les symptômes typiques de l’ACS soient décrits comme une apparition progressive de douleurs douloureuses ou de pression dans la poitrine avec rayonnement au bras gauche, au cou ou à la mâchoire, en vérité, l’atypique peut être plus « typique. »Dans une synthèse de données volumineuses, les caractéristiques historiques les plus utiles qui augmentaient la probabilité d’infarctus aigu du myocarde étaient les radiations du bras ou de l’épaule droit, les radiations des deux bras, la douleur qui s’aggravait avec l’effort, la diaphorèse et les nausées ou vomissements.1 Certains sous-ensembles, y compris les femmes, les diabétiques et les personnes âgées, sont plus susceptibles d’avoir des symptômes angineux représentés par une dyspnée, des vomissements, une diaphorèse, une faiblesse généralisée; certains peuvent avoir des présentations indolores.2 Même chez les patients présentant des symptômes atypiques tels que des douleurs pleurales ou une sensibilité palpable de la paroi thoracique, la probabilité post-test n’est suffisamment abaissée que chez ceux qui présentent déjà un risque faible.1 L’énumération de la charge historique du facteur de risque cardiaque a peu de valeur pronostique, en particulier chez les patients âgés de plus de 40 ans.3
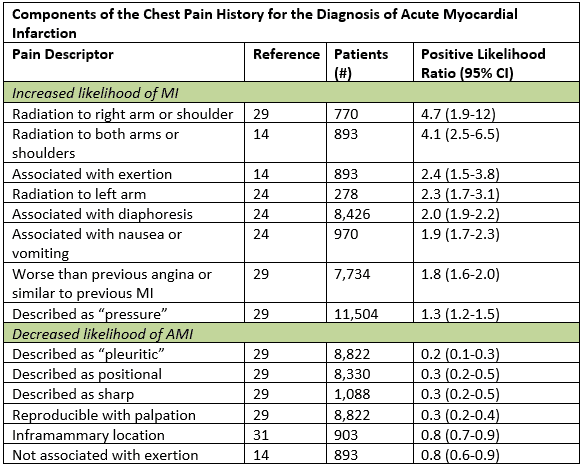
Adapté de Swap CJ, et al. JAMA. 2005;294:2623-2629.
Les jeunes patients (< 45 ans) représentent un groupe à haut risque de diagnostic erroné de SCA, principalement en raison d’une tendance des médecins à sous-estimer le risque cardiaque. Jusqu’à 10% des infarctus du myocarde aux États-Unis surviennent chez des patients < âgés de 45 ans, dont la majorité sont liés à une cardiopathie athéroscléreuse. La maladie athéroscléreuse a été notée chez 17% des adolescents dans une étude, 4 et la maladie multivesselle notée chez 20% des jeunes adultes (âge moyen: 26 ans) dans une étude d’autopsie des victimes de violence dans les centres-villes.5 Une étude récente DE l’URGENCE a révélé que 5,4% des patients de 24 ─39 ans présentant une douleur thoracique ont déclaré un SCA et que 2,2% ont eu un événement cardiaque indésirable (décès, IM, nécessité d’une intervention coronarienne percutanée ou d’un pontage cardiaque) dans les 30 jours.6 Bien que l’incidence globale de l’ACS soit plus faible chez les jeunes patients, les médecins ne doivent pas négliger un HPI concernant uniquement en fonction de l’âge du patient.
Le diabète sucré (DM) représente une autre affection à haut risque en termes de risque de diagnostic erroné du SCA. Les patients atteints de DM sont sujets à des présentations indolores lorsqu’ils ont une ischémie cardiaque. Des présentations atypiques (par exemple, dyspnée, confusion, vomissements, fatigue) surviennent dans jusqu’à 40% des cas. Les patients diabétiques sont également plus susceptibles d’avoir des résultats indésirables de l’ACS.7 Les médecins traitants ne doivent donc pas s’appuyer sur des plaintes typiques pour initier un bilan cardiaque chez les patients diabétiques, ni sur des biomarqueurs cardiaques positifs pour inciter une approche agressive du traitement chez ces patients.
La consommation de cocaïne doit être considérée comme un facteur de risque indépendant supplémentaire de cardiopathie athéroscléreuse et d’IM, en particulier chez les jeunes patients. Certains auteurs estiment que la cocaïne représente jusqu’à 25% des IM aiguës chez les patients < 45 ans.7 L’utilisation aiguë de cocaïne peut induire une vasoconstriction coronaire, une augmentation de l’agrégation plaquettaire et / ou une stimulation adrénergique entraînant des dysrythmies et une ischémie. La consommation chronique de cocaïne est également associée à l’IM, provoquant une athérogenèse nettement accélérée et un IM précoce subséquent. Dans l’ensemble, les consommateurs de cocaïne ont un risque sept fois plus élevé d’IM.8
Le lupus érythémateux disséminé (LED) est un facteur de risque important mais sous-estimé d’athérosclérose précoce et d’infarctus du myocarde. On estime que les jeunes patients atteints de LED présentent un risque neuf fois plus élevé d’IM précoce.9 Les femmes < de 45 ans, en particulier, courent un risque accru, les estimations d’un risque accru d’IM précoce pouvant atteindre cinquante fois.10 La cause de l’athérosclérose prématurée dans le LED est probablement multifactorielle, mais en grande partie liée à une inflammation systémique et à des dyslipidémies coexistantes.
L’infection par le virus de l’immunodéficience humaine (VIH) a également été identifiée comme un facteur de risque indépendant d’athérosclérose prématurée. Les preuves suggèrent que l’infection par le VIH provoque des lésions endothéliales des vaisseaux coronaires, initiant une cascade inflammatoire conduisant à des lésions athérosclérotiques.11 La découverte d’une athérosclérose prématurée est particulièrement importante chez les patients présentant des stades ultérieurs de l’infection par le VIH (nombre de CD4 < 200).12 Les schémas thérapeutiques actuellement utilisés dans le traitement du VIH (inhibiteurs de la protéase) exacerbent également le risque d’athérosclérose précoce. Dans l’ensemble, les patients séropositifs atteints de SCA sont plus âgés de plus de 10 ans que les patients non séropositifs.13
L’insuffisance rénale chronique (IRC) a également été récemment identifiée comme un facteur de risque indépendant d’athérosclérose accélérée. La CRD est associée à une inflammation chronique14 et à une agrégation plaquettaire accrue.15 Ces facteurs, combinés à une prévalence accrue de facteurs de risque conventionnels concomitants, produisent un risque disproportionnellement élevé d’événements cardiaques chez ces patients.14
Bien qu’il doive être obtenu et évalué dans les 10 minutes suivant la présentation concernant l’ischémie cardiaque, l’ECG ne doit pas être utilisé pour exclure l’ACS. Jusqu’à 50% des patients atteints d’ischémie cardiaque ou d’infarctus auront un ECG non spécifique ou normal.16 ECG en série peuvent augmenter le rendement diagnostique en confirmant la présence de SCA chez les patients présentant des symptômes persistants.
Tout comme l’ECG, les biomarqueurs cardiaques sont utiles lorsqu’ils sont positifs, mais ont une utilité limitée lorsqu’ils sont normaux. Les tests de biomarqueurs en série sur une période de 3 ─6 heures sont devenus un protocole de routine dans de nombreux EDs et présentent une excellente sensibilité à la détection de preuves d’IM. Cependant, les biomarqueurs ne peuvent pas être invoqués pour exclure l’ischémie cardiaque. La validation prospective du score « CŒUR » a permis aux praticiens de différencier de manière fiable un sous-ensemble de patients à faible risque qui ne bénéficieraient probablement pas de tests supplémentaires.17
Les tests d’effort et l’angiographie coronarienne sont plus couramment utilisés au début de l’évaluation des patients souffrant de douleurs thoraciques pour régir l’ACS. Bien qu’un test d’effort négatif ou une angiographie soit associé à un risque plus faible de CAO sous-jacente, aucun des deux tests ne peut exclure définitivement l’ACS ou la présence de thromboses coronaires sous-jacentes significatives. La majorité des modalités des tests de résistance détectent des signes de lésions coronaires significatives avec seulement 85% à 95% de sensibilités.L’angiographie coronaire 18-19 est également un test imparfait; les interprétations d’angiographie faussement négatives ne sont pas rares en présence d’une maladie diffuse, de plaques excentriques, d’occlusions « affleurantes », de lésions ostiales branchiales, de branches latérales qui se chevauchent et même lorsque des lésions sont présentes dans l’artère coronaire principale gauche.20 La fiabilité de ces tests est encore compromise par les données indiquant que la majorité des MIS proviennent d’occlusions dans des artères qui étaient auparavant obstruées à 50% avant que l’infarctus ne se produise.21-23
Ces types de lésions sont généralement associés à des tests de stress négatifs ou à des angiographies « non significatives » si les tests sont effectués avant l’infarctus. De par leur nature de détection de la sténose coronarienne fixe, les tests de résistance ne sont pas en mesure d’évaluer ou de prédire les plaques coronariennes vulnérables qui risquent de se déloger, entraînant un événement coronarien aigu. Dans une étude de patients en cours d’évaluation pour l’ACS qui ont subi un test de stress négatif au cours des 3 années précédentes, plus de 20% ont atteint l’indice composite d’AMI, de test de stress positif, de CABG ou de cathétérisme avec intervention, la grande majorité des tests négatifs survenant dans l’année suivant la présentation.24 De même, lors de tests encore plus invasifs, les hommes et les femmes présentant une CAO normale ou « minimale » lors d’un cathétérisme cardiaque (1,2% et 3,3%, respectivement) ont eu une IAM ou sont décédés dans l’année suivant le suivi.25 Il est essentiel que le clinicien ne se fie pas à un test objectif préalable face à un patient présentant des signes et des symptômes indiquant un SCA.
Résumé
L’évaluation de la douleur thoracique et de l’ACS possible est une entreprise à haut risque. La décision de poursuivre un « bilan cardiaque complet » devrait principalement être basée sur un HPI complet. Les médecins doivent être conscients de la fréquence des présentations atypiques, en particulier chez les femmes, les personnes âgées et les patients diabétiques. Les jeunes patients méritent également une attention particulière, car leur risque est souvent sous-estimé. D’autres facteurs de risque cardiaques non traditionnels, notamment la cocaïne, le lupus érythémateux disséminé, le virus de l’immunodéficience humaine et la maladie rénale chronique, méritent une attention particulière. Les tests diagnostiques consistent en une électrocardiographie (utile pour statuer dans l’ACS, mais pas pour exclure le diagnostic) et des tests de biomarqueurs cardiaques, qui sont également principalement utiles lorsqu’ils sont positifs. Fait important, le test de stress négatif ou l’angiographie est très utile pour stratifier les patients à un faible risque de SCA et de CAD, mais ils n’excluent pas définitivement le diagnostic.
Référence : Palatnik M. Un homme de 38 ans souffrant de douleurs thoraciques. J Soins urgents Med. Mars 2018. Disponible à l’adresse suivante : https://www.jucm.com/a-38-year-old-man-with-chest-pain/.
- Permutez CJ, Nagurney JT. Valeur et limites des antécédents de douleur thoracique dans l’évaluation des patients présentant des syndromes coronariens aigus suspectés. JAMA. 2005;294:2623-2629.
- El-Menyar A, Zubaid M, Sulaiman K. Présentation atypique du syndrome coronarien aigu: Un prédicteur indépendant significatif de la mortalité hospitalière. J Cardiol. 2011;57;165-171.
- Han JH, Lindsell CJ, Storrow AB, et al. Le rôle du fardeau du facteur de risque cardiaque dans le diagnostic des syndromes coronariens aigus dans le cadre du service d’urgence. Ann Emerg Med. 2007;49;145-152.
- Tuzcu EM, Kapadia SR, Tutar E, et al. Prévalence élevée de l’athérosclérose coronarienne chez les adolescents et les jeunes adultes asymptomatiques: preuves de l’échographie intravasculaire. Circulation. 2001;103:2705-2710.
- Joseph A, Ackerman D, Talley JD, et al. Manifestations de l’athérosclérose coronarienne chez les jeunes victimes de traumatismes — une étude d’autopsie. Je Suis Coll Cardiol. 1993;222:459-467.
- Marsan RJ Jr., Shaver KJ, Sease KL, et al. Évaluation d’une règle de décision clinique pour les jeunes patients adultes souffrant de douleurs thoraciques. Acad Emerg Med. 2005;12:26-32.
- Fergus TS, Fazel R, Fang J, et al. Présentation, prise en charge et résultats des patients diabétiques comparés aux patients non diabétiques admis pour des syndromes coronariens aigus. Cœur. 2004;90:1051-1052.
- Qureshi AI, Suri MF, Guterman LR, et al. Cocaine use and the likelihood of nonfatal myocardial infarctus and stroke: data from the Third National Health and Nutrition Examination Survey. Circulation. 2001;103:502-506.
- D’Agate DJ, Kokolis S, Belilos E, et al. Maladie coronarienne prématurée dans le lupus érythémateux disséminé avec réocclusion étendue suite à un pontage coronarien. J Cardiol invasif. 2003;15:157-163.
- Manzi S, Meilahn EN, Rairie JE, et al. Taux d’incidence spécifique à l’âge de l’infarctus du myocarde et de l’angine de poitrine chez les femmes atteintes de lupus érythémateux disséminé: comparaison avec l’étude de Framingham. Am J Epidémiol. 1997;145:408-415.
- Varriale P, Saravi G, Hernandez E, et al. Infarctus aigu du myocarde chez les patients infectés par le virus de l’immunodéficience humaine. Am Heart J. 2004; 147:55-59.
- Hsue PY, Lo JC, Franklin A, et al. Progression de l’athérosclérose telle qu’évaluée par l’épaisseur de l’intima-média carotidien chez les patients infectés par le VIH. Circulation. 2004;109:1603-1608.
- Hsue PY, Giri K, Erickson S, et al. Caractéristiques cliniques des syndromes coronariens aigus chez les patients atteints d’une infection par le virus de l’immunodéficience humaine. Circulation. 2004;109:316-319.
- Yerkey MW, Kernis SJ, Franklin BA, et al. Dysfonctionnement rénal et accélération de la maladie coronarienne. Cœur. 2004;90:961-966.
- Aggarwal A, Kabbani SS, Rimmer JM, et al. Effets biphasiques de l’hémodialyse sur la réactivité plaquettaire chez les patients atteints d’insuffisance rénale terminale: un contributeur potentiel au risque cardiovasculaire. Je suis Malade des reins. 2002;40:315-322.
- Brady WJ, Aufderheide TP, Chan T, et al. Diagnostic électrocardiographique de l’infarctus aigu du myocarde. Emerg Med Clin Nord Am. 2001;19:295-320.
- Backus BE, Six AJ, Kelder JC, et al. Une validation prospective du score CARDIAQUE pour les patients souffrant de douleurs thoraciques au service des urgences. Cardiologie Int J. 2013;168;2153-2158.
- Ioannidis JPA, Salem D, Chew PW, et al. Précision des technologies d’imagerie dans le diagnostic de l’ischémie cardiaque aiguë au service des urgences: une méta-analyse. Ann Emerg Med. 2001;37:471-477.
- Latef F, Gibler WB. Test provocateur pour la douleur thoracique. Am J Emerg Med. 2000;18:793-801.
- Schwartz L, Gourassa MG. Évaluation des patients souffrant de douleurs thoraciques et d’angiographies coronariennes normales. Arch Int Med. 2001;161:1825-1833.
- Giroud D, Li JM, Urban P, et al. Relation du site de l’infarctus aigu du myocarde à la sténose artérielle coronaire la plus sévère à l’angiographie préalable. Je suis Cardiol. 1992;69:729-732.
- Hackett D, Davies G, Maseri A. Les sténoses coronariennes préexistantes chez les patients présentant un premier infarctus du myocarde ne sont pas nécessairement graves. Cœur Eur J. 1988; 9:1317-23.
- Hackett D, Verwilghen J, Davies G, et al. Sténoses coronaires avant et après un infarctus aigu du myocarde. Je suis Cardiol. 1989;63:1517-1518.
- Walker J, Galuska M, Vega D. Maladie coronarienne chez les patients souffrant de douleurs thoraciques aux urgences avec des tests de stress négatifs récents. West J Emerg Med. 2010;11;384-388.
- Hemingway H, McCallum A, Shipley M, et al. JAMA 2006; 295; 1404-1411.
