Aperçu
Le fer joue un rôle vital dans la plupart des organismes en raison de sa capacité à catalyser le transfert d’électrons, une partie vitale des réactions métaboliques dans les mitochondries lors de la production d’énergie. De plus, chez les mammifères, le fer est un composant clé de l’hémoglobine, permettant le transport de l’oxygène vers les tissus via les globules rouges. Le fer libre est potentiellement toxique en raison de sa capacité à catalyser la génération de radicaux libres nocifs. Pour cette raison, le fer est généralement lié aux protéines dans le cadre de groupes hémiques ou de centres fer-soufre pour l’activité fonctionnelle. Le fer non fonctionnel est lié aux protéines de support ou de stockage, mais peut être plus faiblement attaché à d’autres protéines sous une forme labile. Le contrôle minutieux de la distribution du fer chez l’homme régule non seulement la disponibilité et la toxicité, mais joue également un rôle dans la réponse immunitaire. Pendant l’infection, le corps séquestre le fer disponible pour empêcher son utilisation en envahissant les bactéries, limitant considérablement leur capacité à se développer et à se multiplier.
L’un des principaux contrôleurs du transport du fer dans les cellules est CD71, également connu sous le nom de récepteur de transferrine 1. La figure 1 résume son rôle dans le transport du fer du liquide tissulaire ou du plasma dans la cellule. Le fer « libre », sous forme de Fe(III) se lie à la transferrine, qui devient elle-même un ligand pour le CD71 lié à la membrane. Le complexe Fe(III)-transférine-CD71 est ensuite endocyté en un endosome qui est acidifié par l’action de pompes ioniques. Dans l’environnement acide, le complexe se dissocie en ses composants. Le CD71 et la transferrine sont recyclés à la surface, tandis que le Fe(III) est réduit en Fe(II) par l’activité de la métalloprotéase STEAP3. Fe(II) peut alors être exporté de l’endosome par la protéine DMT1 (transporteur de métal divalent 1). Dans le cytoplasme, le Fe(II) peut s’associer à la ferritine et être stocké pour une utilisation future; traité dans les mitochondries pour la synthèse de groupes hémiques et de composés Fe-S; ou relâché dans l’environnement extracellulaire par l’action de la ferroportine. La libération de Fe(II) par la ferroportine est contrôlée négativement par l’hormone hepcidine du foie, par exemple lors d’une inflammation pour limiter la disponibilité du fer aux agents pathogènes. Le fer Fe(II) libéré peut ensuite être reconverti en forme Fe(III) par des protéines plasmatiques telles que la céruloplasmine.
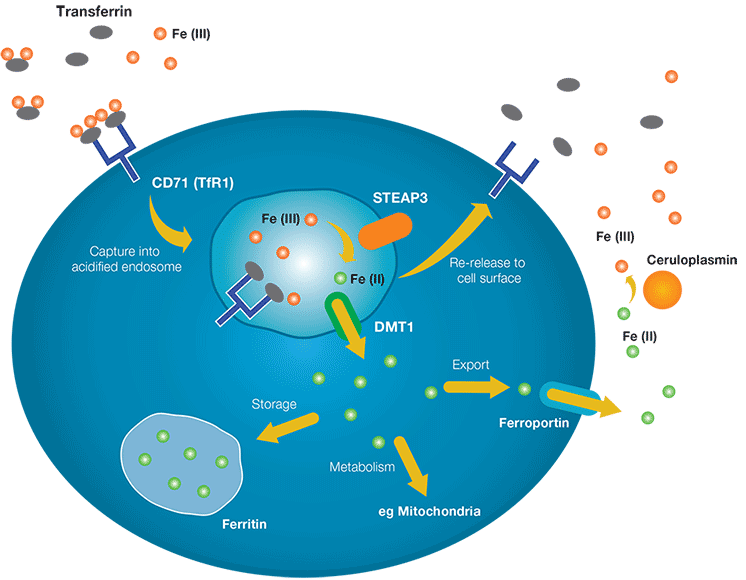
Fig. 1. Le rôle du récepteur de la transferrine 1 dans le transport du fer dans les cellules.
Etude du Transport du fer
Bio-Rad vend une gamme d’anticorps contre les protéines impliquées dans l’homéostasie du fer.
|
Target |
Human |
Mouse |
Rat |
|---|---|---|---|
|
CD71/TfR1 |
MCA1148, MCA2775, VMA00037 |
MCA1033, MCA2474 |
MCA155 |
|
Transferrin |
9100-0004, 9100-1055, AHP081, AHP1757, AHP858, VMA00578, VPA00797 |
AHP081 |
9100-1055, AHP081 |
|
Ferritin |
4420-4804, 4420-3010, 4420-3904GA, 4420-4804, AHP2179, OBT1639 |
||
|
Ceruloplasmin |
|||
|
Proerythroblasts / Erythrocytes |
MCA506G |
MCA6044G |
Flow Cytometry Analysis of Key Iron Transport Marker CD71
Rat Anti-Mouse CD71 Antibody, clone 8D3 recognizes mouse CD71, a 763 amino acid ~95 kDa single pass type II surface cellulaire de la glycoprotéine transmembranaire, autrement connue sous le nom de récepteur de la transferrine. Le CD71 est exprimé sur les cellules de la lignée érythroïde, mais il est absent de la majorité des érythrocytes matures. Le clone 8D3 reconnaît les formes indigènes, solubles et dénaturées du CD71 murin. La liaison de l’anticorps 8D3 au CD71 n’interfère pas avec l’absorption du fer dans les cellules. Anticorps Anti-Souris TER-119 / Cellules érythroïdes de Rat, le clone TER-119 reconnaît TER-119 également connu sous le nom de Ly-76. Le clone TER-119 détecte une protéine de 52 kDa associée à la glycophorine A exprimée en surface cellulaire. TER-119 est un antigène spécifique des érythrocytes exprimé depuis le début du proérythroblaste jusqu’au stade érythrocytaire mature. Cet antigène est également exprimé dans une moindre mesure sur 20 à 25% des cellules de la moelle osseuse et 2 à 3% des cellules de la rate. Ces marqueurs clés ont été utilisés ensemble en cytométrie de flux (Figure 2) pour montrer le CD71 nécessaire à l’importation de FE pour synthétiser l’hémoglobine dans les proérythroblastes positifs TER-119.
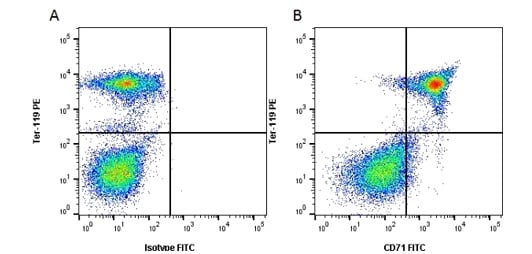
Fig. 2. Analyse par cytométrie en flux des marqueurs de transport tron de souris CD71 et TER-119. A, Anticorps Anti-Souris TER-119 (MCA6044PE) conjugué RPE chez le Rat et Contrôle Isotype IgG2a conjugué FITC chez le Rat (MCA1212F). B, Anticorps Anti-Souris conjugué RPE TER-119 (MCA6044PE) de Rat et Anticorps Anti-Souris conjugué FITC CD71 (MCA2474F) de Rat. Toutes les expériences effectuées sur la moelle osseuse de souris. Données acquises sur l’analyseur de cellules ZE5™.
