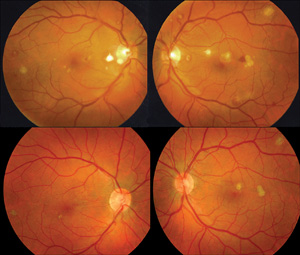
Figure 1. Photographie en couleur du fond d’œil des deux yeux chez un toxicomane IV avant vitrectomie bilatérale séquentielle (rangée du haut) et après vitrectomie (rangée du bas). Avant la vitrectomie, il y avait une légère vitrite et quelques opacités vitrées bilatéralement. Des zones de rétinochoroïdite hémorragique sont présentes. Après vitrectomie et cinq injections sérielles d’amphotéricine-B aux deux yeux administrées deux fois par semaine, des cicatrices rétinochoroïdiennes résiduelles peuvent être observées avec une résolution de l’hémorragie rétinienne et de l’opacité vitreuse. Ce patient a également reçu un mois de kétoconozole par voie orale.
L’endophtalmie endogène est une infection intraoculaire rare, mais potentiellement dévastatrice, dans laquelle les agents pathogènes atteignent l’œil via la circulation sanguine. L’endophtalmie endogène est moins fréquente que l’endophtalmie exogène, représentant 2 à 8% de tous les cas d’endophtalmie dans diverses études.1,2 L’endophtalmie endogène pédiatrique est encore plus rare, représentant 0,1 à 4% de tous les cas d’endophtalmie endogène.2,3
Les conditions prédisposantes sont importantes pour déterminer le risque d’endophtalmie endogène d’un patient. Chez les patients atteints de panuvéite aiguë ou chronique d’origine peu claire, des procédures diagnostiques invasives, le plus souvent la vitrectomie pars plana, peuvent être nécessaires pour poser le diagnostic. Les facteurs de risque identifiés pour l’endophtalmie endogène comprennent : les maladies chroniques (p. ex. diabète sucré, insuffisance rénale, tumeurs malignes et syndrome d’immunodéficience acquise); le traitement immunosupressif; la chirurgie invasive récente; l’abus de drogues par voie intraveineuse; cathéter à demeure; endocardite; infections des voies hépatobiliaires; transplantation d’organes; grossesse ou accouchement; chirurgies urogénitales; ou procédures dentaires.4 Susciter des antécédents d’abus de drogues par voie intraveineuse est particulièrement important et souvent difficile étant donné la réticence des patients à discuter de cette question. Des antécédents positifs de conditions médicales sous-jacentes telles que le diabète, les maladies cardiaques et les tumeurs malignes ont été rapportés chez 90% des patients dans un rapport d’Annabelle A. Okada et ses collègues en 1994.5 Un examen important des patients atteints d’endophtalmie endogène a signalé des conditions médicales sous-jacentes prédisposant à une infection oculaire dans 56 à 68% des cas.6 Zenith H. Wu et ses collègues ont signalé l’identification d’une condition prédisposante préexistante chez 90,9% des patients et la condition systémique la plus fréquente trouvée était le diabète sucré (50%).7
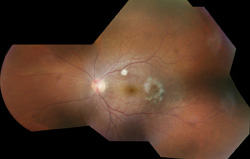
Figure 2. Photographie du fond d’œil en couleur de l’œil gauche d’un patient atteint d’endophtalmie endogène à Candida post-vitrectomie et traitement par cinq injections intravitréennes d’amphotéricine-B administrées deux fois par semaine montrant des lésions rétinochoroïdales blanches dans la macula ainsi qu’un trou maculaire excentrique comme séquelles d’endophtalmie fongique. L’acuité visuelle était de 20/30. Ce patient a également reçu un mois de kétoconozole par voie orale.
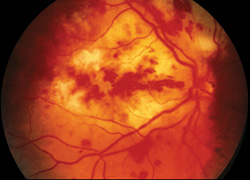
Figure 3. Photographie du fond d’œil en couleur de l’œil droit d’un patient atteint d’endophtalmie endogène causée par Aspergillus. Le patient avait des antécédents d’abus de drogues par voie intraveineuse et a été pris en charge avec de l’amphotéricine B intravitréenne et systémique, mais avait un mauvais résultat visuel.
L’endoptalmie endogène est le plus souvent causée par des bactéries ou des champignons. Les organismes responsables varient géographiquement. Une étude du Bascom Palmer Eye Institute a signalé que les champignons étaient une cause plus fréquente que les bactéries (62% de champignons contre 38% de bactéries)8, tandis qu’une étude de Hong Kong a signalé que les bactéries étaient la cause la plus fréquente d’endophtalmie endogène (72,7% de bactéries contre 27,3% de champignons).7 La littérature d’Asie de l’Est a indiqué que les organismes à gram négatif étaient la cause la plus fréquente (70%) et Klebsiella l’organisme causal le plus fréquent (60%).9 Les données en Amérique du Nord et en Europe ont montré un pourcentage croissant d’organismes à gram négatif, passant de 32% en 1986 à 52% en 20036. Les levures sont une cause plus fréquente et associées à de meilleurs résultats visuels que les moisissures dans l’endophtalmie fongique endogène.10,11 Candida est l’organisme le plus commun responsable de l’endophtalmie fongique endogène.8,11,12 Chez les patients immunodéprimés, tels que les patients atteints du SIDA, des organismes atypiques tels que Cryptococcus, Mycobacterium avium, Nocardia et Pneumocystis jiroveci doivent être pris en compte.
L’œil impliqué peut avoir des douleurs, des rougeurs, des flottements ou une diminution de la vision. Le diagnostic est retardé dans la population pédiatrique par l’incapacité de signaler les symptômes tôt. La présentation bilatérale est rapportée dans 14 à 25% des cas et plus fréquemment avec des champignons et des bactéries comme le méningocoque, Escherichia coli et Klebsiella.6 L’endophtalmie endogène peut d’abord être unilatérale et se développer ensuite dans l’œil de l’autre. Les infections bactériennes ou fongiques peuvent présenter un microabcès de l’iris, une hypopyon, des grades variables de brume vitreuse, des nodules rétiniens discrets, une hémorragie rétinienne périvasculaire, des emboles artériolaires ou une rétine nécrotique. Les cas graves peuvent évoluer vers une panophtalmie. La présence d’exsudat brun chocolat dans la chambre antérieure suggère que le bacille est l’organisme responsable, tandis que Listeria est caractérisée par une hypopyon brune et Serratia par une hypopyon rouge.
L’endophtalmie fongique endogène à Candida peut présenter des boules pelucheuses dans le vitré, une choriorétinite, une hypopyon, une périvascularite, une névrite optique ou des lésions choriorétiniennes (crémeuses, profondes et bien circonscrites). L’infection par des moisissures comme Aspergillus est plus fulminante, généralement confinée à l’espace sous-rétinien et peut présenter des lésions choriorétiniennes (confluentes avec des marges indistinctes), des hémorragies intra-rétiniennes, une occlusion vasculaire ou une nécrose rétinienne de pleine épaisseur. Les cultures aspirées vitrées positives sont plus difficiles à obtenir à partir de moisissures que les levures, peut-être parce que les moisissures n’impliquent pas le vitré aussi souvent que les levures.13
L’endophtalmie endogène peut imiter une conjonctivite, une uvéite antérieure non infectieuse, une irite, un glaucome aigu, une cellulite, une cataracte et, en particulier, un rétinoblastome chez l’enfant. Un diagnostic erroné lors de la présentation initiale a été signalé dans 16 à 63% des cas, retardant ainsi le diagnostic et la prise en charge appropriée.6,12
Le diagnostic d’endophtalmie endogène est généralement posé à la suite de preuves microbiologiques d’infection à partir d’un échantillon intraoculaire (aqueux ou vitreux). Des cultures positives à partir de sang, de liquide céphalo-rachidien ou de tout site extraoculaire peuvent être très suggestives. Le taux de positivité de l’hémoculture varie considérablement, de 33% à 94% des cas.6,8 En l’absence de symptômes localisants, le rendement diagnostique du sang dans l’endophtalmie endogène d’Aspergillus est très faible.14 Cultures doivent être mises en place avec un milieu aérobie et anaérobie (gélose au chocolat, gélose au sang de mouton et gélose Sabouraud) et incubées jusqu’à deux semaines. La coloration de Gram est couramment utilisée pour évaluer la présence de bactéries. La croissance fongique peut être confirmée par des taches blanches de Geimsa ou de Calcorfluor. L’étude de la réaction en chaîne par polymérase de l’échantillon de tissu est une méthode rapide pour identifier les organismes responsables, mais présente l’inconvénient de ne pas pouvoir être utilisée pour évaluer la sensibilité aux antibiotiques ou aux antifongiques.
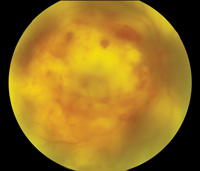
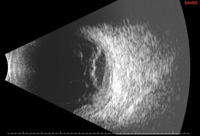
Figure 4. Nocardia endophtalmite endogène. La biopsie vitreuse initiale était négative et seule la biopsie sous-rétinienne a donné des cultures positives. L’image du haut (4a) montre hypopyon présent lors de la présentation. L’image du milieu (4b) montre les résultats du fond d’œil, y compris un gros abcès sous-maculaire. L’échographie B-scan (4c) montre un décollement neurosensoriel et une masse sous-maculaire.
L’échographie B de l’œil est importante pour déterminer l’étendue et le type d’exsudats vitreux, l’épaisseur sclérale, l’abcès choroïdien et la présence d’un décollement de la rétine. Les tomographies informatisées de l’orbite aident à identifier l’implication orbitale. D’autres examens tels que la radiographie thoracique, l’échographie abdominale, la tomodensitométrie abdominale, l’échocardiographie et les scanners au Gallium-67 peuvent aider à identifier un foyer systémique d’infection.
Traitement
• endophtalmie endogène bactérienne. Soon-Phaik Chee et ses collègues ont rapporté que les antibiotiques systémiques peuvent atteindre des niveaux thérapeutiques dans l’œil en raison de la barrière oculaire du sang perturbée.1 Néanmoins, les agents systémiques sont le plus souvent complétés par des antimicrobiens intravitréens et une vitrectomie, en particulier dans le cadre d’une atteinte vitreuse importante. La vancomycine (1 mg / 0,1 mL) et la ceftazidime (2,25 mg / 0,1 mL) restent les antibiotiques intravitréens de choix. Selon une étude de revue, les yeux subissant une vitrectomie pars plana sont trois fois plus susceptibles de conserver une vision utile que ceux qui n’ont pas subi de vitrectomie.6 De plus, ces yeux sont trois fois moins susceptibles de nécessiter une éviscération ou une énucléation. Les antibiotiques systémiques à large spectre tels que la vancomycine, la ciprofloxacine, les aminoglycosides ou les céphalosporines de troisième génération constituaient auparavant le pilier du traitement, mais sont maintenant utilisés en complément du traitement local. Les antibiotiques recommandés sont des antibiotiques à large spectre qui couvrent la plupart des organismes à gram positif et négatif. Les antibiotiques systémiques sont généralement maintenus pendant au moins trois à quatre semaines ou selon l’infection extraoculaire du patient.
• endophtalmie fongique endogène. Le traitement dépend de l’étendue de l’atteinte oculaire. La thérapie systémique seule est suffisante lorsque l’infection est isolée de la rétine et de la choroïde. La vitrectomie et les injections antifongiques intravitréennes ainsi qu’un traitement systémique sont recommandés dans les cas où le vitré est impliqué.15
L’amphotéricine-B par voie intraveineuse a été classiquement le médicament de choix, mais nécessite une surveillance attentive en raison de sa toxicité systémique. Le voriconozole oral ou le fluconazole en association avec un traitement local sont de plus en plus utilisés. Injection intravitréenne de l’un ou l’autre voriconazole (100 µg/0.1 ml) ou amphotéricine-B (5 à 10 µg / 0,1 ml) assure des niveaux immédiats et adéquats d’agent antifongique dans le segment postérieur. Le voriconazole peut avoir une meilleure couverture pour les espèces d’Aspergillus et certaines espèces de Candida (comme C.glabrata et C.krusei) où le fluconazole ou l’amphotéricine-B sont inefficaces. Les nouveaux antifongiques comme le posaconazole, les échinocandines, la micafungine, la caspofungine et l’anidulafungine ont une faible pénétration oculaire et ne sont pas recommandés pour une utilisation dans l’endophtalmie.16 La vitrectomie aide à diminuer la charge d’infection et à améliorer l’accessibilité des agents antifongiques aux structures intraoculaires. La nécessité d’injections intravitréennes répétées doit être basée sur l’amélioration clinique, l’état de l’œil (vitrectomisé vs non vitrectomisé) et la pharmacocinétique du médicament antifongique.
Les corticostéroïdes locaux ou systémiques sont généralement évités dans l’endophtalmie fongique10, bien que leur utilisation reste controversée.14,15
Résultat
Les cas d’endophtalmie endogène ont généralement un mauvais résultat visuel. L’acuité visuelle des doigts de comptage ou plus est rapportée dans 22.2 à 41% de cas.17,18 Une perte de vision due à la cécité, à l’éviscération ou à l’énucléation est rapportée dans 55 à 69% des cas.6 Les résultats visuels après le traitement sont pires pour l’endophtalmie endogène d’Aspergillus que pour les cas de Candida, et cela pourrait être dû à une détection plus précoce de l’infection à Candida, conduisant à une initiation plus rapide du traitement.15
Les patients qui ont des foyers extraoculaires d’infection bactérienne ont un taux de mortalité rapporté de 5 pour cent6 à 32 pour cent.19 Facteurs tels que l’infection par des organismes virulents, une mauvaise défense de l’hôte, un diagnostic erroné entraînant un traitement retardé, un traitement inadéquat, l’utilisation d’antibiotiques inappropriés, la panophtalmie sont considérés comme associés à un mauvais pronostic. L’infection fongique a une mortalité élevée, avec un taux de mortalité rapporté de 7% dans l’infection systémique à Candida.20
L’endophtalmie endogène est une infection oculaire potentiellement dévastatrice et doit être diagnostiquée et prise en charge rapidement. L’utilisation d’antibiotiques oculaires et systémiques combinés est courante. La co-infection systémique est fréquente et est associée à un taux de mortalité élevé.
Le Dr Relhan est chercheur en maladies viréorétiniennes et uvéites à l’Institut ophtalmologique Bascom Palmer. Elle était auparavant consultante junior en chirurgie vitréorétinienne à l’Institut des yeux LV Prasad à Hyderabad, en Inde. Le Dr Albini est professeur agrégé d’ophtalmologie clinique spécialisé dans les maladies vitréorétiniennes et l’uvéite au Bascom Palmer Eye Institute. Le Dr Flynn est professeur d’ophtalmologie spécialisé en chirurgie vitréorétinienne chez Bascom Palmer. Les demandes de renseignements doivent être adressées au Dr Albini à TAlbini @ med.miami.edu .
1. Chee SP, Jap A. Endophtalmite endogène. Curr Opin Ophthalmol 2001; 12 (6): 464-70.
2. Rachitskaïa AV, Flynn HW, Davis JL. endophtalmie endogène causée par le sérotype B de salmonella chez un enfant immunocompétent de 12 ans. Arch Ophthalmol 2012; 130 (6): 802-4. doi: 10.1001/ archophtalmol.2011.1862.
3. Chaudhry IA, Shamsi FA, Al-Dhibi H, Khan AO. endophtalmie bactérienne endogène pédiatrique: Rapport de cas et revue de la littérature. J AAPOS 2006; 10(5):491-3. Epub 2006 Sept. 7.
4. Flynn HW Jr. Le défi clinique de l’endophtalmie endogène. Rétine 2001; 21(6): 572-4.
5. Okada AA, Johnson RP, Liles WC, D’Amico DJ, Baker AS. Endophtalmie bactérienne endogène – Rapport d’une étude rétrospective de dix ans. Ophtalmologie 1994; 101:832-8.
6. Jackson TL, Eykyn SJ, Graham EM, Stanford MR (2003). Endophtalmie bactérienne endogène : Série prospective sur 17 ans et examen de 267 cas signalés. Surv Ophthalmol 2003; 48 (4): 403-23.
7. Wu ZH, Chan RP, Luk FO, Liu DT, Chan CK, Lam DS, Lai TY. Examen des Caractéristiques cliniques, du Spectre microbiologique et des Résultats du traitement de l’Endophtalmie endogène sur une période de 8 ans. J Ophthalmol 2012: 265078. doi: 10.1155/2012/265078. Epub 23 février 2012.
8. Schiedler V, Scott UI, Flynn HW Jr, Davis JL, Benz MS, Miller D. endophtalmie endogène éprouvée par la culture: Caractéristiques cliniques et résultats de l’acuité visuelle. Am J Ophthalmol 2004; 137:725-31.
9. Wong JS, Chan TK, Lee HM, Chee SP. Endophtalmie bactérienne endogène: une expérience en Asie de l’Est et une réévaluation d’une affection oculaire sévère. Ophtalmologie 2000; 107: 1483-91.
10. Lingappan A, Wykoff CC, Albini TA, Miller D, Pathengay A, Davis JL, Flynn HW Jr. Endophtalmie fongique endogène: Organismes responsables, stratégies de gestion et résultats de l’acuité visuelle. Am J Ophthalmol 2012; 153:162-6.e1. doi: 10.1016/ j.ajo.2011.06.020. Epub 2011 13 septembre.
11. Sridhar J, Flynn HW Jr, Kuriyan AE, Miller D, Albini T. Endophtalmie fongique endogène: Facteurs de risque, caractéristiques cliniques et résultats du traitement dans les infections à moisissures et à levures. J Infecte l’inflammation ophtalmique 2013; Sep 20; 3 (1): 60. doi: 10.1186 / 1869-5760-3-60.
12. Binder MI, Chua J, Kaiser PK, Procop GW, Isada CM. Endophtalmie endogène: Examen sur 18 ans des cas positifs à la culture dans un centre de soins tertiaires. Médecine (Baltimore) 2003;82(2):97-105.
13. Rao NA, Hidayat AA. Endophtalmie mycotique endogène: Variations des modifications cliniques et histopathologiques de la candidose par rapport à l’aspergillose. Am J Ophthalmol 2001; 132 (2): 244-51.
14. Nous sommes en mesure de vous aider À trouver des solutions pour vos besoins. Endophtalmie endogène d’Aspergillus. Caractéristiques cliniques et résultats du traitement. Ophtalmologie 1998; 105:57-65.
15. Brod RD, Flynn HW, Miller D. Endophtalmite fongique endogène. Dans: Ophtalmologie clinique de Duane. Hagerstown : Harper et Row; 2004. CD-ROM. ch 11
16. Bouza E1, Cobo-Soriano R, Rodríguez-Créixems M, Muñoz P, Suárez-Leoz M, Cortés C. Une recherche prospective de lésions oculaires chez des patients hospitalisés présentant une bactériémie significative. Clin Infect Dis 2000; 30(2): 306-12.
17. Riddell J 4th1, Comer GM, Kauffman CA. Traitement de l’endophtalmie fongique endogène: Concentrez-vous sur de nouveaux agents antifongiques. Clin Infect Dis 2011; 52 (5): 648-53. doi: 10.1093/cid/ciq204. Epub 2011 16 janvier.
18. Greenwald MJ, Wohl LG, Vendre CH. Endophtalmie bactérienne métastatique: Une réévaluation contemporaine. Surv Ophthalmol 1986; 31 (2): 81-101.
19. Chen YJ1, Kuo HK, Wu PC, Kuo ML, Tsai HH, Liu CC, Chen CH. A 10-year comparison of endogenous endophtalmitis outcomes: An east Asian experience with Klebsiella pneumoniae infection. Rétine 2004; 24 (3): 383-90.
20. Menezes AV1, Sigesmund DA, Demajo WA, Devenyi RG. Mortalité des patients hospitalisés atteints d’endophtalmie à Candida. Arch Intern Med 1994; 154 (18): 2093-7.
