Quelle est la densité des cellules?
Mode lecteur
La densité du matériel biologique est responsable de la décantation des cellules au fond de nos tubes de laboratoire et de nos plaques à puits multiples et sert de base à la centrifugation de routine qui fait partie du quotidien de tant de biologistes. Ces mêmes différences de densité entre les cellules et leur extérieur aqueux sont également à la base du contraste que nous observons dans les images de microscopie de phase. Ces différences sont également importantes en dehors du cadre du laboratoire. Par exemple, le plancton doit composer avec cette différence de densité pour rester à une profondeur dans l’océan où la lumière du soleil est abondante plutôt que de s’enfoncer dans les profondeurs noircies. Étant donné que la plupart des biologistes et des biochimistes utilisent quotidiennement la séparation basée sur la densité, il semble surprenant de voir à quel point des densités telles que celles recueillies dans le tableau 1 sont rarement discutées.
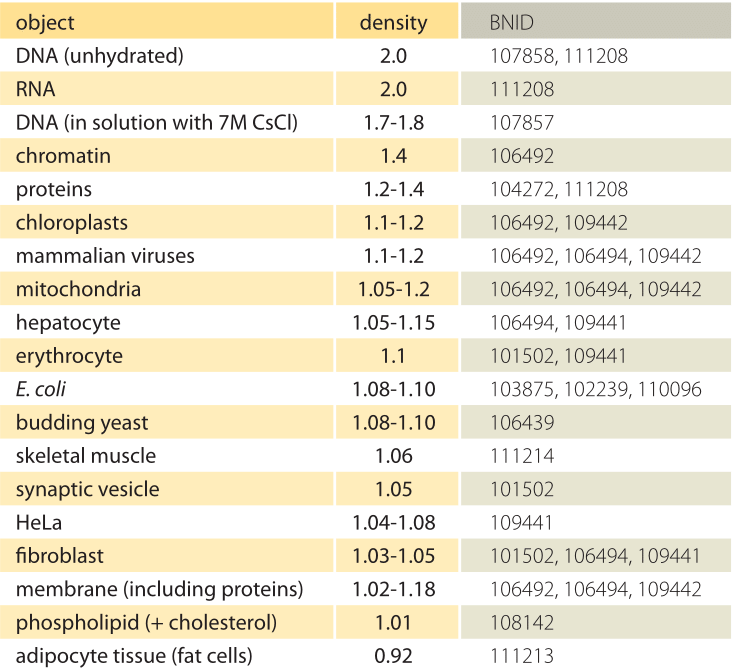
Tableau 1: Densités d’objets biologiques par rapport à l’eau. Cela équivaut presque à les donner en unités de g / ml ou 1000 kg / m3. Les valeurs sont triées par ordre décroissant. Sauf indication contraire, les valeurs ont été mesurées en saccharose ou en solution de ficoll.
Quelle est la base sous-jacente des densités variables des différents organites et types cellulaires? Dans une large mesure, ces différences peuvent être attribuées au rapport entre la teneur en eau et la masse sèche. Les protéines ont une densité de ≈1,3-1,4 (BNID 104272, 101502) par rapport à l’eau (ou presque de manière équivalente en unités de g / ml ou 1000 kg / m3). Étant donné la valeur de référence de 1 pour la densité de l’eau, un spectre de valeurs intermédiaires pour la densité cellulaire entre 1 et 1.3 sont obtenus en fonction de l’abondance relative de protéines et d’eau. Les lipides sont à l’extrémité basse à côté de l’eau à une densité d’environ 1 (BNID 108142). À l’autre extrême, les granules d’amidon de densité ≈1,5 (BNID 103206) et les nucléotides à ≈1,7 peuvent déplacer le bilan massique global dans la direction opposée.
La connaissance de la densité est souvent basée sur l’emplacement où un composant biologique donné se dépose lorsqu’il est filé dans une centrifugeuse contenant un gradient de concentrations souvent produit par le saccharose ou dans le cas de l’ADN, le chlorure de césium. La densité reflète la masse divisée par le volume, mais pour les composés chargés en solution, la densité est également affectée par les coquilles d’eau dite liée. La densité dans ce cas devient une densité effective, réduite par l’eau liée, et donc quelque peu dépendante de la concentration en sel (BNID 107858).
La vitesse de sédimentation, telle qu’elle se produit dans une centrifugeuse, est quantifiée en unités de Svedberg qui est à l’origine des noms 70S, 23S etc. pour le ribosome et ses sous-unités d’ARNr. Un ARNr 23S sédimentera à une vitesse de 23×10-12 m/ s sous gravité normale. Dans une ultracentrifugeuse produisant une accélération d’un million de g, la vitesse évoluera proportionnellement à 23×10-6 m/s, soit environ 1 mm/min. La vitesse de sédimentation dépend de la densité, de la taille et de la forme de la molécule. Pour des formes et des densités similaires, la vitesse de sédimentation évolue comme la racine carrée de la masse moléculaire. Dans de tels cas, la masse moléculaire est le carré de la vitesse de sédimentation, de sorte que les sous-unités 23S et 16S du ribosome ont une masse moléculaire avec un rapport d’environ (23/16) 2 ou environ 2 qui est étroitement en ligne avec les mesures de 0,9 et 0.5 MDa respectivement (BNID 110972, 110967). En clinique, le taux de sédimentation des érythrocytes (globules rouges) est couramment utilisé pour mesurer l’inflammation. Des taux beaucoup plus élevés que 10 mm / heure indiquent généralement la présence du facteur de pro-sédimentation fibrinogène qui est un indicateur général d’une affection inflammatoire.
Il est bien connu que l’eau est la fraction moléculaire la plus abondante des cellules, mais quelle abondance exactement? Si nous examinons les tissus d’organismes multicellulaires, trouver la teneur en eau est une tâche simple de mesurer la masse du tissu avant et après séchage. Mais comment peut-on effectuer de telles mesures pour les cellules? Lorsque nous pesons une masse de cellules avant et après séchage, comment mesurer uniquement les cellules sans aucune eau autour d’elles? Même après la centrifugation, il reste de l’eau dans la pastille cellulaire, ce qui crée une ambiguïté sur la masse sèche elle-même.
Une fois de plus, le marquage radio-isotopique vient à la rescousse (Cayley et al 1991). Tout d’abord, l’eau marquée (en utilisant du tritium, 3H) est mesurée dans une pastille cellulaire. Cela indique la somme d’eau à l’intérieur et à l’extérieur des cellules. Ensuite, un autre composé soluble marqué mais ne pouvant entrer dans la cellule, tel que l’inuline 14C ou le PEG 3H, mesure le volume d’eau à l’extérieur des cellules dans un culot centrifugé (par exemple, chez E. coli environ 25 à 35% du volume du culot (BNID)). La différence indique la teneur en eau à l’intérieur des cellules. De telles méthodes conduisent à des valeurs typiques allant de ≈60-65% en masse pour la levure en herbe et les globules rouges à ≈70% pour E. coli et l’amibe D. discoideum et jusqu’à ≈80% pour les tissus musculaires de rat et cardiaques de porc (BNID 105938, 103689). La contribution de la matière sèche étant dominée par des constituants de densité ≈1,3 (c’est-à-dire des protéines), cela conduit à la densité globale caractéristique de ≈1,1 (BNID 103875, 106439, 101502). À partir de ces fractions caractéristiques, la masse sèche par volume peut être déduite d’environ 300-500 mg / ml (BNID 108131, 108135, 108136), mais lors d’une croissance lente, les valeurs peuvent être plus élevées. Les faibles densités sont courantes chez les graines sèches et les plantes sous-marines qui ont des parties flottantes avec des densités inférieures à l’eau environnante, leur permettant ainsi de flotter. Des densités inférieures à celles de l’eau peuvent être obtenues soit par du gaz comme dans le varech et certaines bactéries, soit en utilisant des solutés de poids moléculaire (MW) inférieur au milieu environnant (par exemple en remplaçant le sodium par MW≈23 par de l’ammonium par MW≈18) comme chez les petits crustacés, les copépodes antarctiques.
Les humains sont composés d’environ 60% d’eau (40% dans les cellules, 15% dans le liquide interstitiel et 5% dans le plasma sanguin, BNID 110743) et la plupart d’entre nous ont subi les effets forts de la déshydratation après avoir oublié de boire ne serait-ce que quelques verres. Pourtant, certaines cellules peuvent être étonnamment robustes à une diminution de leur teneur en eau. Par exemple, le taux de métabolisme du glucose dans les cellules du foie de rat n’a pas été affecté par une perte de 25% d’eau intracellulaire. Une telle diminution peut être obtenue par osmose – en modifiant la tonicité (concentration en soluté) du liquide extracellulaire. Un exemple extrême est celui de la remarquable crevette saumâtre. Vivant dans des environnements où la concentration extérieure en sel peut fluctuer et être très élevée, il a été montré qu’il avait des kystes qui ne peuvent être desséchés qu’à 2% d’eau sans dommages irréversibles et à des niveaux d’hydratation supérieurs à 37% (seulement environ la moitié de son état entièrement hydraté) leur physiologie se comporte normalement. Cette robustesse face à la perte d’eau pourrait être liée à une distinction parfois faite entre deux formes d’eau à l’intérieur de la cellule. « eau en vrac » normale qui est plus dispensable et « eau liée » qui est associée aux composants cellulaires et sert de solvant essentiel au bon fonctionnement.





