L’angiotensine II provoque une augmentation de la pression artérielle par des actions sur divers sites:
- Glandes surrénales: L’angiotensine II augmente la libération de l’hormone stéroïde aldostérone, qui agit localement pour augmenter la rétention de sodium et la sécrétion de potassium par le rein. L’effet net de ceci est la rétention d’eau, rétablissant ainsi l’équilibre des fluides.
- Reins: L’angiotensine II augmente également la rétention de sodium par des actions directes sur les tubules proximaux rénaux, ainsi que sur le taux de filtration glomérulaire et le flux sanguin rénal.
- Système cardiovasculaire: L’angiotensine II est un vasoconstricteur endogène puissant, provoquant une contraction des artères et des veines de résistance, augmentant la pression artérielle. De plus, dans les vaisseaux sanguins et le cœur, une augmentation prolongée de l’Angiotensine II favorise la croissance cellulaire et l’hypertrophie qui en résulte.
- Système nerveux central: Dans le cerveau, l’Angiotensine II agit sur l’hypophyse postérieure, stimulant la libération de l’hormone antidiurétique (ADH, également connue sous le nom d’Arginine Vasopressine (AVP)). L’ADH augmente la réabsorption de l’eau dans les canaux de collecte rénaux. L’angiotensine II agit également sur l’organe sous-fornical du cerveau pour provoquer une soif accrue, encourageant la consommation d’eau.
L’activation chronique du système RAAS peut entraîner un remodelage délétère et une inflammation accrue du cœur, du système vasculaire et des reins, ainsi qu’une hypertension et une maladie rénale chronique.
Contrôle neuronal du Système cardiovasculaire
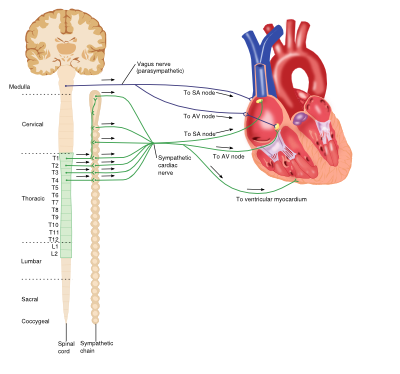
Interaction entre le système nerveux sympathique et parasympathique et le cœur
Système nerveux sympathique (adrénergique)
Le système nerveux adrénergique est un composant vital de nombreux processus dans tout le corps, y compris le système cardiovasculaire. Les catécholamines circulantes (par exemple l’adrénaline et la noradrénaline) se lient aux récepteurs adrénergiques des membranes cellulaires et les activent. Les récepteurs adrénergiques sont une classe de récepteurs couplés à la protéine G qui provoquent une variété d’effets spécifiques aux tissus et existent dans plusieurs sous-types.
Vascularisation
Le sous-type de récepteur prédominant présent dans les vaisseaux sanguins est le récepteur a1-adrénergique, dont l’activation par la liaison à la catécholamine provoque l’activation de la voie de signalisation intracellulaire de la phospholipase-C (PLC), de l’inositol triphosphate (IP3), du diacylglycérol (DAG). Cela se traduit finalement par une contraction des myocytes, une vasoconstriction et une augmentation conséquente de la pression artérielle systémique.
Coeur
Bien que le cœur soit myogène, c’est-à-dire que l’impulsion de contraction est auto-initiée, la sortie du cœur est influencée par le système nerveux central. L’effet net du système sympathique sur le cœur est d’augmenter le débit cardiaque. Les récepteurs adrénergiques présents dans le cœur appartiennent à la sous-famille des récepteurs ß et comprennent les récepteurs ß1 et ß3. La liaison de la catécholamine aux récepteurs ß1 du cœur entraîne une augmentation du débit cardiaque via un certain nombre de mécanismes: les effets chronotropes positifs, les effets inotropes positifs ont augmenté l’automaticité et la conduction à la fois dans les myocytes ventriculaires et dans le nœud auriculo-ventriculaire (AV). Cependant, l’activation du récepteur ß3 contrarie ces actions, produisant un effet inotrope négatif et fournissant un système de contrôle intégré dans le cœur.
Une augmentation prolongée des taux de catécholamines dans la circulation (par exemple lorsqu’elles sont sécrétées par des tumeurs surrénales ou lors de périodes de stress) peut entraîner des problèmes cardiovasculaires chroniques tels que l’hypertension et les arythmies.
Système nerveux parasympathique
Le système parasympathique repose sur la liaison du neurotransmetteur acétylcholine (Ach) aux récepteurs muscariniques et joue divers rôles dans tout le corps.
Vascularisation
Bien que les vaisseaux sanguins expriment des récepteurs muscariniques, ils ne reçoivent pas d’innervation cholinergique; cependant, l’application d’Ach exogène entraîne une vasodilatation rapide et profonde.
Coeur
L’activation des récepteurs muscariniques (sous-type M2) dans le cœur par l’Ach libéré par le nerf vague provoque une réduction du débit cardiaque par des effets opposés à la stimulation adrénergique: effets chronotropes négatifs et diminution de la conduction des nœuds AV ainsi que diminution de la force des contractions auriculaires.
Système plaquettaire / coagulant
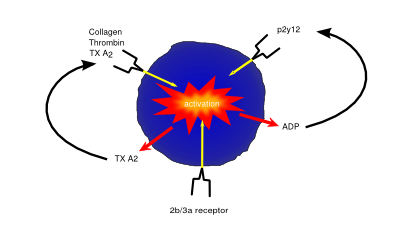
L’activation et l’inhibition plaquettaires fonctionnent à travers les récepteurs de surface des plaquettes. Les boucles de rétroaction améliorent l’activation plaquettaire (p. ex. L’ADP libérée par les plaquettes augmente l’activation plaquettaire, via le récepteur de l’ADP)
Les plaquettes (également appelées thrombocytes) sont de petites cellules dépourvues de noyaux responsables de l’hémostase ou de la coagulation du sang. Des dommages ou des blessures entraînant une perte de sang et une exposition aux fibres de collagène extracellulaires sont détectés, activant les plaquettes. Une fois activées, les plaquettes deviennent adhésives, adhérant à la fois à la paroi du vaisseau endommagé et à l’autre, formant un amas de cellules, ou « caillot », aidant à endiguer la fuite du vaisseau. Ils commencent alors à sécréter des cytokines qui favorisent l’invasion des fibroblastes présents dans les tissus environnants qui forment un patch plus permanent, soit en créant un tissu sain, soit en déposant une matrice extracellulaire pour former une cicatrice.
Il existe plusieurs conditions dans lesquelles une coagulation anormale peut être dommageable pour l’organisme; une coagulation excessive peut entraîner un blocage vasculaire et une ischémie ou un accident vasculaire cérébral; plus rarement, une coagulation déficiente peut entraîner une perte de sang excessive, par exemple en cas d’hémophilie. Pour lutter contre ces maladies, il existe des médicaments qui modulent le processus de coagulation.
anticoagulants
Les médicaments qui empêchent la coagulation (anticoagulants) sont importants chez les personnes présentant un risque accru de lésions liées à la coagulation, telles qu’un accident vasculaire cérébral ou une ischémie.
En plus d’être analgésique et anti-pyrétique, l’aspirine est un agent anti-thrombotique administré à faibles doses aux personnes à risque de lésions dues à la coagulation (par exemple à la suite d’une crise cardiaque). Les actions anticoagulantes de l’aspirine proviennent de sa suppression des principaux facteurs de pro-coagulation tels que la prostaglanding et les thromboxanes via une inactivation irréversible de l’enzyme cyclooxygénase PTGS. Cette suppression de facteurs tels que le thromboxane A2 réduit l’agrégation plaquettaire et empêche ainsi la formation de caillots.
Les inhibiteurs du P2Y12 tels que le clopidogrel exercent leur effet anticoagulant via l’inhibition du sous-type P2Y12 du récepteur plaquettaire ADP. En bloquant P2Y12, ces médicaments empêchent l’activation des plaquettes et la formation du réseau de fibrine nécessaire à la coagulation.
Des médicaments tels que l’abciximab et le tirofiban empêchent la coagulation par inhibition du récepteur de la glycoprotéine IIb / IIIa, empêchant à la fois l’activation et l’agrégation plaquettaires.
Pharmacocinétique
Lors de l’administration de médicaments à un patient, il est essentiel de connaître plusieurs faits sur le médicament afin de maximiser l’efficacité et de minimiser les effets secondaires / la toxicité. Ceux-ci incluent des informations sur la dose efficace, la durée pendant laquelle le médicament reste actif dans le corps, la rapidité avec laquelle il est décomposé / retiré du corps et la facilité avec laquelle le corps peut absorber / utiliser ce médicament. Le tableau suivant détaille ces propriétés pharmacocinétiques et leur calcul:
| Propriété | Description | Unités standard (Abréviation) | Formule |
|---|---|---|---|
| Dose | Quantité de médicament actif administrée au patient | mg (D) | Médicament spécifique (D’après les études cliniques) |
| Concentration | Quantité de médicament dans un volume plasmatique donné | µg/ ml (C) | = D/Vd |
| CE50 | La concentration de médicament nécessaire pour obtenir une réponse à mi-chemin entre les réponses zéro et maximale. | µg / ml (CE50) | y = bas + (Haut-Bas) / (Coefficient de Hill 1 +) |
| Volume de distribution | Le volume théorique que le médicament occuperait s’il était réparti uniformément dans les tissus pour obtenir la concentration plasmatique actuelle. | L (Vd) | D / C |
| Constante d’élimination (Taux) | La vitesse à laquelle le médicament est retiré du corps. | h-1 (Ke) | ln(2)/t1/2 ou CL/Vd |
| Biodisponibilité | Quelle quantité de la dose administrée est disponible pour une utilisation réelle par l’organisme. | aucune unité exprimant une fraction (f) | 100 × (ASC (po)×D(iv)) / (ASC (iv)×D (po))
ASC= Aire sous la courbe po= administration orale iv= administration intraveineuse |
| Cmax ou Cmin | La concentration plasmatique maximale (Cmax)/minimale (Cmin) atteinte après l’administration du médicament | µg/ ml (Cmax ou Cmin) | Identifié par mesure directe du plasma C |
| tmax | Le temps qu’il faut à un médicament pour atteindre la Cmax après administration | h(tmax) | Identifié par mesure directe du plasma C sur temps |
| Demi-vie | Le temps qu’il faut à un médicament pour atteindre la moitié de sa concentration initiale | h(t1/2) | ln(2)/Ke |
| Clairance du médicament | Le volume de plasma dégagé du médicament sur une durée définie | l/h(CL) | Vd x Ke ou D/Aire sous la courbe |
Interactions médicamenteuses courantes
Il est important de connaître les interactions qui peuvent se produire entre les médicaments administrés de manière concomitante, car elles peuvent avoir un effet sur l’efficacité et/ou la toxicité, ou produire des effets indésirables effet. De telles interactions pourraient par exemple affecter l’absorption, la biodisponibilité ou l’efficacité du médicament, ou se combiner pour produire des métabolites indésirables, et éventuellement avoir des effets sur les analyses cliniques. Si une combinaison de deux médicaments diminue l’effet de l’un ou des deux, l’interaction est appelée effet antagoniste; cependant, si, à l’inverse, une combinaison de deux médicaments améliore l’effet de l’un ou des deux, l’interaction est appelée effet synergique. Les médicaments qui agissent sur le système cardiovasculaire sont très interactifs, ce qui est un problème car les patients cardiovasculaires reçoivent normalement plus d’un médicament. Certaines interactions médicamenteuses courantes liées aux médicaments cardiovasculaires sont énumérées ci-dessous:
| Drug | Drugs that drug action | Drugs that ↓ drug action |
|---|---|---|
| Digoxin |
|
|
| Warfarine |
|
|
| Clopidogrel |
|
|
| Furosemide |
|
|
| ACE Inhibitors |
|
|
| ß-blockers |
|
|
| Statines |
|
|
Il existe plusieurs mécanismes par lesquels les médicaments sont décomposés par l’organisme, généralement par dégradation par des enzymes. Une famille commune d’enzymes impliquées dans le métabolisme des médicaments est la famille du cytochrome P450 (CYP); un grand groupe diversifié d’enzymes qui favorisent l’oxydation d’une variété de substrats, à la fois endogènes (p. ex. hormones stéroïdiennes) et exogènes (par ex. toxines et médicaments). Les enzymes CYP représentent jusqu’à 75% du métabolisme des médicaments, aidant certains médicaments à former leurs composés actifs, mais désactivant principalement les médicaments en métabolites inactifs à excréter. Les enzymes CYP peuvent influencer l’action du médicament de plusieurs manières; elles peuvent augmenter le métabolisme du médicament (soit en augmentant l’action via la formation du sous-produit actif, soit en diminuant l’action par le métabolisme du médicament actif) ou leur action peut être inhibée par des médicaments qui se disputent l’accès au site actif des enzymes CYP, empêchant l’interaction normale entre le médicament et l’enzyme. De nombreux médicaments exercent leurs interactions avec d’autres médicaments viainterférence avec le système CYP. Par exemple, si le médicament A est métabolisé par le CYP et que le Médicament B inhibe l’activité du CYP, la co-administration entraînera une diminution de la biodisponibilité du Médicament A. Chez l’homme, il existe 18 familles et 43 sous-familles du groupe d’enzymes CYP, qui ciblent différents substrats. Certaines enzymes CYP importantes en médecine cardiovasculaire, leurs substrats médicamenteux cardiovasculaires et certaines de leurs interactions sont présentés dans le tableau ci-dessous:
| Enzyme | Substrats (par ex.) | Inhibiteurs (par ex.) | Inducteurs (par ex.) |
|---|---|---|---|
| C2 P2C19 |
|
|
|
| CP Li> statines (atorvastatine)
|
|||
| CYP2C9 |
|
|
|
| CYP2D6 |
|
|
|
En plus des interactions médicamenteuses, les actions de nombreux médicaments sont également affectées par les aliments ou les boissons. Par exemple, il convient de faire attention à la consommation d’alcool avec de nombreux types de médicaments, car cela peut exercer un stress sur le foie qui travaille déjà dur pour métaboliser les médicaments dans le corps. Le jus de pamplemousse peut également causer des problèmes, car il est connu pour inhiber le CYP3a.Pour plus d’informations sur les interactions entre les médicaments et les aliments / boissons, consultez ce guide: Utilisation générale de la Médecine
- McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Böhm M, Dickstein K, Falk V, Filippatos G, Fonseca C, Gomez-Sanchez MA, Jaarsma T, Køber L, Lip GY, Maggioni AP, Parkhomenko A, Pieske BM, Popescu BA, Rønnevik PK, Rutten FH, Schwitter J, Seferovic P, Stepinska J, Trindade PT, Voors AA, Zannad F, Zeiher A et Comité des Directives pratiques du CES.. Lignes directrices ESC pour le diagnostic et le traitement de l’insuffisance cardiaque aiguë et chronique 2012: Le Groupe de Travail pour le Diagnostic et le Traitement de l’Insuffisance Cardiaque Aiguë et Chronique 2012 de la Société Européenne de Cardiologie. Développé en collaboration avec l’Association de l’Insuffisance cardiaque (HFA) du CES. Cœur Eur J. 2012 Juil; 33 (14): 1787-847. DOI: 10.1093/ eurheartj/ehs104 / ID PubMed:22611136
- Rydén L, Standl E, Bartnik M, Van den Berghe G, Betteridge J, De Boer MJ, Cosentino F, Jönsson B, Laakso M, Malmberg K, Priori S, Ostergren J, Tuomilehto J, Thrainsdottir I, Vanhorebeek I, Stramba-Badiale M, Lindgren P, Qiao Q, Priori SG, blanc JJ, budaj a, CAMM j, Dean V, Deckers j, Dickstein K, Lekakis j, McGregor K, Metra m, Morais j, Osterspey a, Tamargo j, ZAMORANO JL, Deckers JW, Bertrand M, Charbonnel B, Erdmann e, Ferrannini e, Flyvbjerg a, Gohlke h, Juanatey Jr, Graham I, Monteiro PF, Parhofer K, Pyörälä K, raz i, Schernthaner g, Volpe m, wood d, Task Force on Diabète et Maladies cardiovasculaires de la Société Européenne de Cardiologie (ESC)., et Association Européenne pour l’étude du diabète (EASD).. Lignes directrices sur le diabète, le prédiabète et les maladies cardiovasculaires : résumé. Le Groupe de travail sur le Diabète et les Maladies Cardiovasculaires de la Société Européenne de Cardiologie (ESC) et de l’Association Européenne pour l’Étude du diabète (EASD). Cœur Eur J. 2007 Jan; 28 (1): 88-136. DOI: 10.1093/ eurheartj/ ehl260 / ID PubMed:17220161
- Perk J, De Backer G, Gohlke H, Graham I, Reiner Z, Verschuren M, Albus C, Benlian P, Boysen G, Cifkova R, Deaton C, Ebrahim S, Fisher M, Germano G, Hobbs R, Houes A, Karadeniz S, Mezzani A, Prescott E, Ryden L, Scherer M, Syvänne M, Scholte op Reimer WJ, Vrints C, Wood D, Zamorano JL, Zannad F, Association Européenne de Prévention Cardiovasculaire & Rééducation (EACPR)., et le Comité des Directives pratiques du CES (CPG).. Directives européennes sur la prévention des maladies cardiovasculaires dans la pratique clinique (version 2012). La Cinquième Task Force Conjointe de la Société Européenne de Cardiologie et d’autres Sociétés sur la Prévention des Maladies cardiovasculaires dans la Pratique Clinique (composée de représentants de neuf sociétés et d’experts invités). Cœur Eur J. 2012 Juil; 33 (13): 1635-701. DOI: 10.1093 / eurheartj / ehs092 / PubMed ID: 22555213
- Groupe de travail sur la prise en charge de l’infarctus aigu du myocarde en élévation du segment ST de la Société européenne de Cardiologie (ESC)., Steg PG, James SK, Atar D, Badano LP, Blömstrom-Lundqvist C, Borger MA, Di Mario C, Dickstein K, Ducrocq G, Fernandez-Aviles F, Gershlick AH, Giannuzzi P, Halvorsen S, Huber K, Juni P, Kastrati A, Knuuti J, Lenzen MJ, Mahaffey KW, Valgimigli M, van ‘t Hof A, Widimsky P et Zahger D. Directives de l’ESC pour la gestion de l’infarctus aigu du myocarde chez les patients présentant une élévation du segment ST. Cœur Eur J. 2012 Oct; 33 (20): 2569-619. DOI: 10.1093/ eurheartj/ ehs215 / ID PubMed:22922416
- Blomström-Lundqvist C, Scheinman MM, Aliot EM, Alpert JS, Calkins H, Camm AJ, Campbell WB, Haines DE, Kuck KH, Lerman BB, Miller DD, Shaeffer CW Jr, Stevenson WG, Tomaselli GF, Antman EM, Smith SC Jr, Alpert JS, Faxon DP, Fuster V, Gibbons RJ, Gregoratos G, Hiratzka LF, Hunt SA , Jacobs AK, Russell RO Jr, Priori SG, Blanc JJ, Budaj A, Burgos EF, Cowie M, Deckers JW, Garcia MA, Klein WW, Lekakis J, Lindahl B, Mazzotta G, Morais JC, Oto A, Smiseth O, Trappe HJ, Collège américain de Cardiologie., Groupe de travail de l’American Heart Association sur les directives de pratique., et Comité de la Société Européenne de Cardiologie pour les Directives de pratique. Comité de rédaction chargé d’élaborer des Lignes directrices pour la Prise en charge des Patients Atteints d’Arythmies Supraventriculaires.. Lignes directrices de l’ACC / AHA / ESC pour la prise en charge des patients atteints d’arythmies supraventriculaires summaryrésumé: rapport du Groupe de travail de l’American College of Cardiology / American Heart Association sur les Lignes directrices de Pratique et du Comité de la Société Européenne de Cardiologie pour les Lignes Directrices de Pratique (Comité de Rédaction chargé d’élaborer des Lignes Directrices pour la Prise en Charge des Patients Atteints d’Arythmies Supraventriculaires). Circulation. 2003 14 octobre; 108 (15): 1871-909. DOI: 10.1161/01.CIR.0000091380.04100.84/PubMed ID: 14557344
- Association Européenne de Prévention Cardiovasculaire&Réhabilitation., Reiner Z, Catapano AL, De Backer G, Graham I, Taskinen MR, Wiklund O, Agewall S, Alegria E, Chapman MJ, Durrington P, Erdine S, Halcox J, Hobbs R, Kjekshus J, Filardi PP, Riccardi G, Storey RF, Wood D et Comités du Comité des Directives de pratique (CPG) 2008-2010 et 2010-2012.. Directives ESC/EAS pour la prise en charge des dyslipidémies: le Groupe de travail pour la prise en charge des dyslipidémies de la Société Européenne de Cardiologie (ESC) et de la Société européenne d’Athérosclérose (EAS). Cœur Eur J. 2011 Juil; 32 (14): 1769-818. DOI: 10.1093/eurheartj/ehr158/ID PubMed: 21712404
Tous les résumés Medline : PubMed
