Brève description de deux types de mort cellulaire programmée: l’apoptose et l’autophagie
L’apoptose, ou mort cellulaire programmée de type I, est la plus largement étudiée des formes de mort cellulaire. Ses caractéristiques morphologiques peuvent être identifiées en microscopie optique, et comprennent le rétrécissement cellulaire, le compactage de la chromatine, le blébinage de la membrane cytoplasmique et, enfin, la formation de corps apoptotiques (Figure 1). Biochemically, apoptosis is characterized by the participation of proteases called caspases, orderly internucleosomal DNA fragmentation, phosphatidylserine externalization, changes in mitochondrial membrane permeability, and the participation of members of the Bcl-2 protein family.
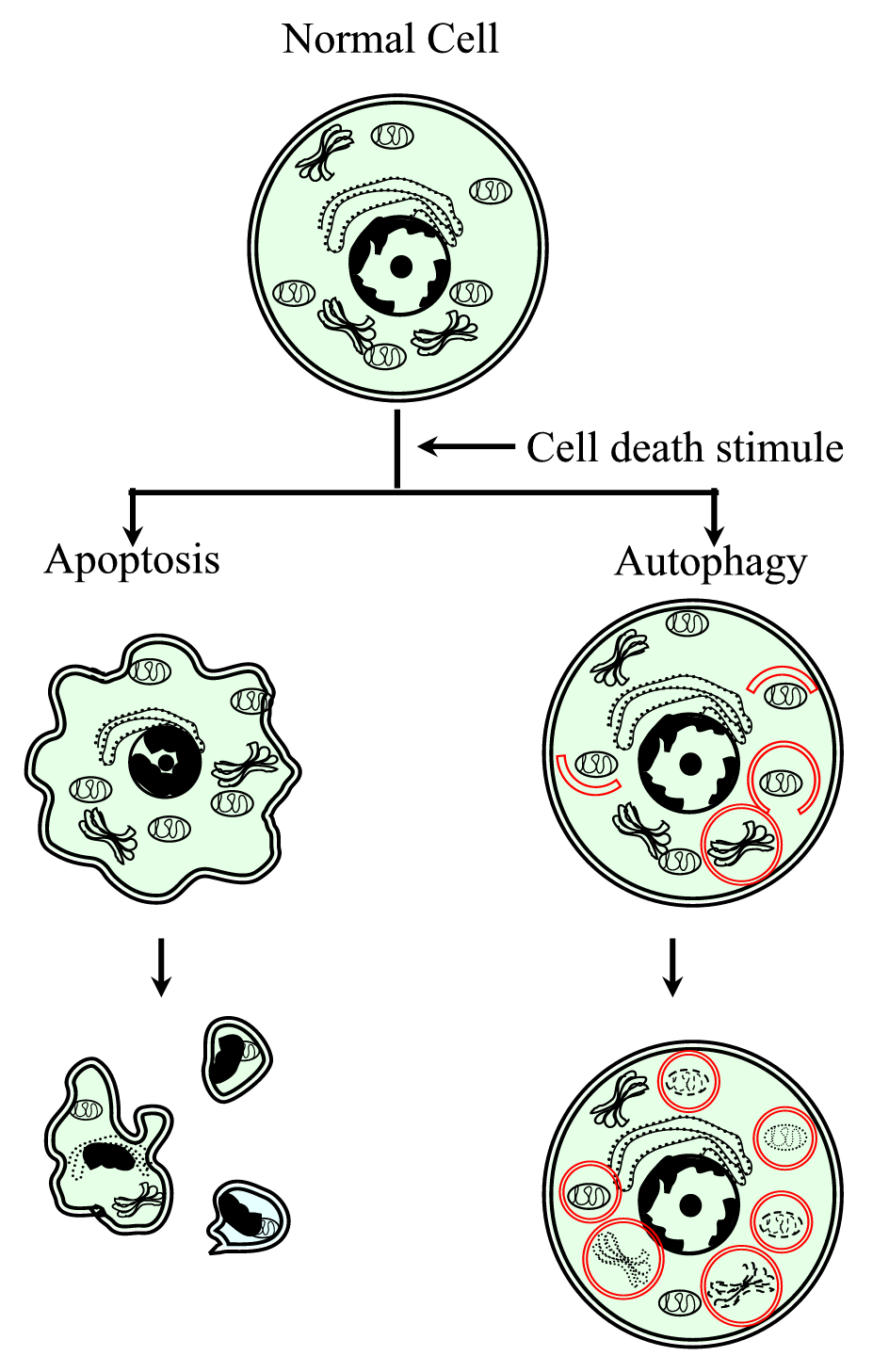
Figure 1.
xmlns:xlink= »http://www.w3.org/1999/xlink » xmlns:mml= »http://www.w3.org/1998/Math/MathML » xmlns:xsi= »http://www.w3.org/2001/XMLSchema-instance Représentation schématique du processus de mort cellulaire programmé de type I (apoptose) et de type II (autophagie). L’apoptose est caractérisée par une contraction cellulaire, un compactage de la chromatine, des blébs membraneux et la formation de corps apoptotiques. L’autophagie est caractérisée par la présence d’un grand nombre d’autophagosomes à contenu cytoplasmique. Les deux types de mort cellulaire ne génèrent pas de réponse inflammatoire puisque la membrane cytoplasmique est conservée jusqu’à ce que les débris cellulaires soient éliminés par voisinage ou par des débris spécialisés.
Les caspases sont des protéases spécifiques aux cystéinyl-aspartates qui sont synthétisées sous une forme inactive sous forme de zymogènes appelés pro-caspases (Figure 2). C’est cette forme inactive qui permet l’exécution contrôlée du processus de mort cellulaire. Les caspases ont d’abord été identifiées chez le nématode Ceanorhabditis elegans, mais des formes homologues sont présentes chez les mammifères.
Les caractéristiques de l’apoptose, telles que la fragmentation de l’ADN et la chromatine compactée, résultent de l’activité de la caspase. Pendant l’apoptose, l’ADN est fragmenté en taille de nucléosome (200 pb). Le facteur responsable de la fragmentation de l’ADN pendant l’apoptose est une DNase spécifique (CAD, DNase activée par la caspase) qui est activée par la caspase-3 active. La caspase-3 active, à son tour, est impliquée dans les modifications morphologiques des cellules au cours de l’apoptose, où elle clive la kinase-1 associée à la rho (ROCK-1) afin de l’activer et cela affecte finalement l’arrangement cytosquelettique provoquant la morphologie de retrait apoptotique.

Figure 2.
xmlns:xlink= »http://www.w3.org/1999/xlink »xmlns:mml= »http://www.w3.org/1998/Math/MathML »xmlns:xsi= »http://www.w3.org/2001/XMLSchema-instanceLes caspases impliquées dans le processus apoptotique sont synthétisées sous une forme inactive sous forme de zymogènes, sont constituées d’un pro-domaine, d’une grande sous-unité et d’une petite sous-unité. Les zymogènes sont activés formant des tétramères.
La mort cellulaire apoptotique est fortement régulée par les membres de la famille des lymphomes à cellules B 2 (Bcl-2). Les membres de la famille Bcl-2 ont été classés comme protéines anti-apoptotiques et pro-apoptotiques selon leur homologie Bcl-2 (BH) et leur organisation de domaine (Figure 3). La présence des domaines BH1, BH2, BH3 et BH4 correspond au groupe qui inhibe l’apoptose. Le groupe pro-apoptotique, en revanche, est divisé en deux groupes: ceux avec des domaines BH1, BH2 et BH3, et ceux avec seulement les domaines BH3 (définis comme BH3 uniquement; voir la revue dans). Cette famille de protéines remplit ses fonctions au niveau intracellulaire à l’intérieur des mitochondries, un élément clé de l’apoptose.

Figure 3.
xmlns:xlink= »http://www.w3.org/1999/xlink »xmlns:mml= »http://www.w3.org/1998/Math/MathML » xmlns:xsi= »http://www.w3.org/2001/XMLSchema-instance Protéines de la famille du lymphome à cellules B 2 (Bcl-2). A) Schématisation générale de la structure des protéines Bcl-2. B) Les membres anti-apoptotiques – ils possèdent les quatre domaines BH. C) Les membres pro-apoptotiques qui à leur tour sont divisés en deux groupes: multidomaines et BH3 uniquement.
L’apoptose peut être initiée par deux voies bien décrites : les voies extrinsèques et intrinsèques (Figure 4). L’activation extrinsèque est réalisée par la participation de ligands mortels (tels que la superfamille du facteur de nécrose tumorale– TNF et les ligands induits par l’apoptose liés au TNF, ou TRAIL) avec leurs récepteurs de mort de surface cellulaire apparentés (tels que le récepteur TNF 1, le SAF, le récepteur TRAIL 1 ou le récepteur TRAIL 2) (examiné dans). Une fois que le ligand reconnaît et se lie à son récepteur, une série de complexes intracellulaires se forment pour activer les caspases initiatrices (telles que -8 et -10), qui activent ensuite les caspases exécutrices (telles que -3, -6 et -7). In their activated form, these executioner caspases cleave multiple intracellular targets.

Figure 4.
xmlns:xlink= »http://www.w3.org/1999/xlink » xmlns:mml= »http://www.w3.org/1998/Math/MathML » xmlns:xsi= »http://www.w3.org/2001/XMLSchema-instanceRoutes of activation of apoptosis. The extrinsic route is mediated by external signals – a ligand – that activate to the membrane receptor. L’interaction ligand–récepteur induit l’assemblage du complexe de signalisation induisant la mort (DISC) pour favoriser l’activation de la caspase-8, qui à son tour est capable d’activer l’exécuteur caspase -3, -6 ou -7, conduisant aux changements morphologiques de l’apoptose. La voie intrinsèque est dirigée par la perméabilisation de la membrane externe mitochondriale, qui permet la libération d’éléments pro-apoptotiques sous forme de cytochrome-C. Le cytochrome-C induit le facteur 1 d’activation de la protéase de l’apoptose (Apaf-1) pour favoriser l’activation de la caspase-9 pour assembler l’apoptosome. L’apoptosome est capable d’activer les caspases de l’exécuteur.
La voie apoptotique intrinsèque, en revanche, peut être activée par divers stimuli, y compris les dommages à l’ADN, la famine du facteur de croissance et le stress oxydatif. Lors de l’exposition des cellules à ces stimuli, les mitochondries sont affectées, car plusieurs membres de la famille Bcl-2 sont activés et favorisent la perméabilisation de la membrane externe des mitochondries (MOMP). La membrane mitochondriale externe imprégnée permet la libération du cytochrome c (cyt c), qui est associé à la protéine Apaf-1. L’union cyt c et Apaf-1 se lie ensuite à la caspase-9 initiatrice pour former le complexe qui constitue l’apoptosome, qui a la capacité d’activer les caspases initiatrices qui remplissent leurs fonctions en clivant des substrats cellulaires spécifiques.
Le deuxième processus de mort cellulaire, l’autophagie, est un processus génétiquement programmé et conservé de manière évolutive qui produit la dégradation d’organites et de protéines obsolètes. Il est activé par des stimuli extracellulaires tels que la privation de nutriments, l’hypoxie, la température élevée et les conditions intracellulaires altérées, y compris l’accumulation d’organites endommagés ou superflus (examinés dans).
Chez les organismes eucaryotes, trois types d’autophagie ont été décrits : la microautophagie, la macroautophagie (communément appelée simplement autophagie) et l’autophagie à médiation chaperon (Figure 5). La microautophagie implique l’engloutissement des composants cytoplasmiques directement au niveau du lysosome au moyen d’un processus d’invagination, tandis que la macroautophagie implique la formation de vésicules à double membrane contenant des composants cellulaires, qui fusionnent avec les lysosomes pour former un autophagolysosome. C’est à l’intérieur de l’autophagolysosome que les composants intra-vésiculaires sont dégradés et, si possible, recyclés par la cellule (revue en). Enfin, l’autophagie médiée par les chaperons implique la participation des chaperons à la reconnaissance des protéines désignées pour l’élimination par les lysosomes.

Figure 5.
xmlns:xlink= »http://www.w3.org/1999/xlink »xmlns:mml= »http://www.w3.org/1998/Math/MathML »xmlns:xsi= »http://www.w3.org/2001/XMLSchema-instance Représentations schématiques des différents mécanismes de l’autophagie. La macroautophagie – autophagie – implique la formation d’une vésicule à double membrane, qui engloutit le contenu cytoplasmique qui sera conduit au lysosome pour être dégradé. La microautophagie est caractérisée par l’engloutissement direct des composants cytoplasmiques par le lysosome. Ce processus implique le remodelage de la membrane de l’organite en formant une invagination de la membrane lysosomale. Au cours de l’autophagie médiée par les chaperons, les protéines à dégrader sont ciblées pour un Hsp70, qui à son tour transporte la cargaison cible vers le lysosome.
L’autophagie est dirigée par des gènes Atg (liés à l’autophagie), qui sont nécessaires pour activer le complexe de signalisation qui déclenche la formation d’autophagosomes. Des atggènes ont été découverts dans la levure, mais beaucoup ont des orthologues chez les eucaryotes supérieurs (Figure 6). La formation d’autophagosomes implique la participation de la protéine cytoplasmique LC3 (Atg8), qui subit une lipidation par la phosphatidyléthanolamine, puis est recrutée dans la membrane autophagosomique naissante (Figure 7). L’accumulation de la protéine LC3 lipidée (connue sous le nom de LC3-II) est utilisée comme marqueur de l’autophagie.

Figure 6.
xmlns:xlink= »http://www.w3.org/1999/xlink »xmlns:mml= »http://www.w3.org/1998/Math/MathML » xmlns:xsi= »http://www.w3.org/2001/XMLSchema-instanceAtg protein family includes more than 30 members that participate in the different events that constitute the autophagic process.

Figure 7.
xmlns:xlink= »http://www.w3.org/1999/xlink » xmlns:mml= »http://www.w3.org/1998/Math/MathML » xmlns:xsi= »http://www.w3.org/2001/XMLSchema-instanceThe formation of autophagic vacuoles involves the participation of different Atg proteins since the initial phases until the sequestration of cytoplasmic content. La protéine LC3 est lipidée par la phosphatidyléthanolamine.
La mort cellulaire autophagique, ou mort cellulaire programmée de type II, est caractérisée par une engloutissement massif du cytoplasme par des vésicules autophagiques. Cette activité autophagique intense diffère sensiblement de l’autophagie qui se produit continuellement aux niveaux basaux. Des études ultrastructurales chez la Drosophile ont révélé l’accumulation de vacuoles autophagiques dans la plupart des tissus larvaires. Ce type de mort cellulaire programmée commence par la dégradation des organites cytoplasmiques par autophagie, bien que les éléments cytosquelettiques soient conservés jusqu’aux derniers stades du processus (examinés dans).
