L’ionisation chimique (CI) est une technique d’ionisation douce, qui est l’application directe des résultats de recherche des réactions moléculaires et ioniques en chimie analytique. La première technique d’ionisation était l’ionisation par bombardement électronique (EI). Le produit obtenu par EI comporte de nombreux fragments difficiles à analyser. CI, qui a produit très peu de fragments, a commencé dans les années 1950 et a un grand potentiel en chimie analytique.
Dans le processus CI, les électrons bombardent d’abord le gaz réactif pour générer des ions réactifs. Les molécules d’échantillon sont ensuite ionisées par des ions réactifs par voie de réaction moléculaire et ionique. Les années 1970 ont été considérées comme une étape importante dans le développement de l’IC. À cette époque, les chercheurs ont résolu les lacunes du travail de CI dans un environnement sous vide, permettant à CI de travailler dans des conditions atmosphériques. L’ionisation chimique atmosphérique fournit de l’énergie à partir de la décharge corona et ne nécessite pas d’environnement sous vide, ce qui augmente considérablement la gamme d’applications CI. Actuellement, CI a été largement utilisé dans la technique de spectrométrie de masse.
Le Principe de l’ionisation chimique
Le principe de CI consiste à utiliser l’ion réactif X + pour réagir avec la molécule d’analyte A afin d’obtenir une ionisation de l’analyte:
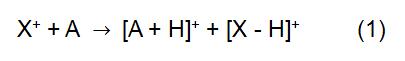
Dans la réaction ci-dessus, X + est dérivé du gaz de réaction ionisé. Certains gaz réactifs courants comprennent le méthane, l’ammoniac, l’eau et l’isobutane. Le temps de réaction et la constante de vitesse (k) dans la formule peuvent être obtenus par la littérature ou la mesure. Lorsque l’ion réactif X+ est H3O+, la formule (2) est:
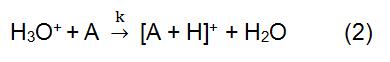
L’ion réactif est produit par une source d’ions. Les sources d’ions couramment utilisées comprennent principalement une source de rayonnement, une source d’alimentation à décharge à cathode creuse et une source d’alimentation à décharge luminescente ordinaire. 210Po et 241Am sont les sources de rayonnement les plus courantes. Le processus d’ionisation commence avec les particules alpha émises par 210Po et 241Am. Il a une énergie élevée et peut entrer en collision avec le gaz réactif pour générer des ions réactifs et des électrons. Si les électrons générés sont suffisamment élevés, ils peuvent entrer en collision avec le gaz réactif pour former de nouveaux ions réactifs et de l’électronique. Dans l’IC utilisant H3O + comme ion réactif, une source d’énergie de décharge à cathode creuse est couramment utilisée, qui peut produire 99,5% de H3O +.
Selon les conditions d’ionisation chimique, CI est classé en ionisation chimique à basse pression (
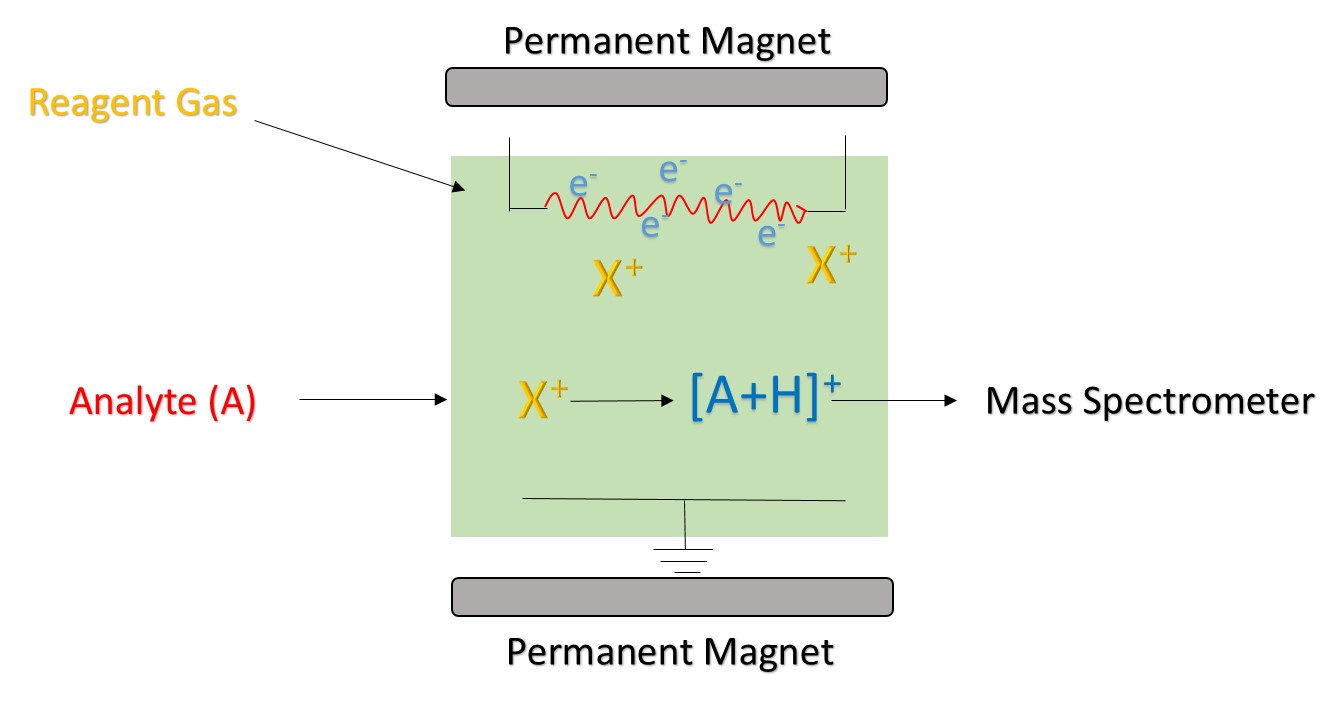 Figure 1. Le principe de l’ionisation chimique
Figure 1. Le principe de l’ionisation chimique
Avantages et inconvénients de CI
La résolution du spectre CI est simple et le poids moléculaire exact de l’analyte peut être obtenu. Le produit obtenu par CI a peu de fragments, et ses produits sont principalement des molécules et des ions de l’analyte. La sélectivité de CI peut être facilement augmentée en sélectionnant un ion réactif approprié. Par example, l’ion réactif H3O+ ne réagit qu’avec une substance organique ayant une affinité protonique supérieure à H3O+. En outre, CI a une sensibilité élevée et une réponse rapide (15s). Cependant, si les ions réactifs sont impurs et qu’une variété de réactions d’ionisation chimique se produisent en même temps, la spectrométrie de masse devient difficile.
Exemples d’applications CI
À l’heure actuelle, le CI est largement utilisé comme source d’ions dans les systèmes de spectrométrie de masse pour détecter diverses substances à l’état de traces. CI peut être utilisé pour la détection de substances telles que les gaz à l’état de traces dans l’atmosphère, les résidus de pesticides dans les légumes et les fruits, la mélamine dans le lait en poudre, les plastifiants et les herbicides dans le sol. En outre, l’IC peut également être utilisé pour l’identification des matériaux, par exemple pour identifier la qualité du thé.
- Mesure des composés organiques volatils (COV)
Dans la mesure des COV par CI, H3O+ est généralement utilisé comme ion réactif. H3O+ ne réagit pas avec la plupart des substances présentes dans l’air telles que O2, N2, CO2, etc. D’autre part, la plupart des réactions de transfert de protons sont non dissociées, de sorte que les ions produits sont uniques, ce qui rend l’analyse des résultats simple. Le principe de la mesure des COV en utilisant H3O+ comme ion réactif est illustré dans l’équation (3). Le produit final a été résolu par spectrométrie de masse par réaction de transfert de protons.
- Détermination de la mélamine dans le lait en poudre
Dans la mesure de la mélamine par CI, le N2 est utilisé comme gaz réactif. Sous l’action de la haute tension, N2 et H2O subissent des réactions physico-chimiques complexes pour générer des ions réactifs H3O +. Le processus réactionnel est représenté dans la formule (3-6). H3O+ réagit avec la mélamine dans le lait en poudre, et le principe de réaction est illustré dans la formule (2).
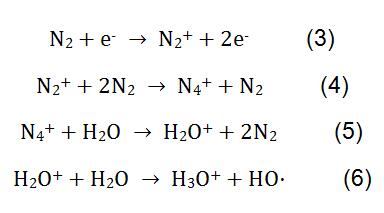
- Identification de la qualité du thé
Différents types de thé peuvent être identifiés en mesurant les substances chimiques à la surface des feuilles de thé avec CI. H3O + réagit avec la surface du thé avec le butanol, le géraniol, la caféine et d’autres substances, et les produits de réaction forment différents spectres de masse sur le spectromètre de masse. Le contenu de la même substance dans différentes variétés de thé est différent, de sorte que le spectre de masse formé par la détection de CI est différent. Le spectre de masse peut refléter les caractéristiques chimiques des empreintes digitales du thé dans une certaine mesure. Par conséquent, l’IC a une valeur d’application pratique importante pour l’identification rapide et l’analyse de la qualité du thé.
L’ionisation chimique est largement utilisée en spectrométrie de masse en raison de sa forte sélectivité et de sa sensibilité élevée. La spectrométrie de masse par ionisation chimique (CIMS) permet non seulement l’identification par spectrométrie de masse en tandem de substances dans des échantillons complexes, mais obtient également des données d’empreintes chimiques pour les échantillons à des fins d’analyse chimiométrique. L’application du CIMS a un effet positif sur la promotion du développement de l’alimentation, de la médecine, de la protection de l’environnement, de l’agriculture et d’autres industries.
Nous avons brièvement présenté le CI, un type de méthode d’ionisation, qui peut vous aider à mieux comprendre la spectrométrie de masse. Chez Creative Proteomics, nous avons développé la plate-forme professionnelle de spectrométrie de masse, qui contient des instruments de pointe. En utilisant la spectrométrie de masse, Creative Proteomics peut fournir différents services pour répondre à diverses exigences, notamment:
- Service de protéomique
- Service de métabolomique
- Service de glycomique
- Fales H M; et al. Comparaison des spectres de masse de certains composés biologiquement importants obtenus par diverses techniques d’ionisation. Chimie Analytique, 1975, 47(2):207-219.
- Lindinger W; et al. Surveillance en ligne des composés organiques volatils aux niveaux de pptv au moyen de la spectrométrie de masse de réaction de transfert de protons (PTR-MS) applications médicales, contrôle des aliments et recherche environnementale. Journal International de Spectrométrie de masse &Processus ioniques, 1998, 173(3):191-241.
- Chen H; et al. Spectrométrie de masse par ionisation chimique à pression atmosphérique à désorption de surface pour l’analyse directe d’échantillons ambiants sans contamination chimique toxique. Journal of Mass Spectrometry, 2010, 42(8):1045-1056.
- Yang S; et al. Détection de la mélamine dans les Produits Laitiers par Spectrométrie de Masse par Ionisation Chimique à Pression Atmosphérique à Désorption de Surface. Chimie Analytique, 2009, 81(7):2426.
