Résumé
L’hémorragie intracérébrale (ICH) est un phénomène rare pour lequel 10% se produisent dans le cervelet. Ils surviennent chez les personnes âgées et sont associés à l’hypertension dans la majorité des cas. Ils ont été rapportés chez les adolescents et les jeunes adultes en association avec des malformations artérioveineuses et des angiomes. L’hémorragie cérébelleuse spontanée, en l’absence de traumatisme ou de tout facteur de risque identifiable bien établi, est un événement extrêmement rare, avec une mortalité allant de 25 à 57%. Un cas d’un homme de 26 ans présentant une hémorragie cérébelleuse spontanée est présenté. Il s’agit d’un jeune adulte en bonne santé sans facteurs de risque identifiables d’accident vasculaire cérébral (AVC), à l’exception de la consommation de marijuana, qui n’a pas été définitivement établie comme facteur de risque. Plusieurs étiologies possibles sont explorées, et après neuf ans, son statut post-événement est évalué.
Mots clés
hémorragie intracérébrale, hémorragie cérébelleuse, traumatisme, hématome
Introduction
L’hémorragie cérébelleuse spontanée est définie comme se produisant sans avertissement préalable, sans traumatisme ou cause externe, et en l’absence de facteurs de risque identifiables. L’hémorragie cérébelleuse, parmi d’autres types d’hémorragie intracérébrale (ICH), peut être classée comme un accident vasculaire cérébral hémorragique. L’AVC est défini comme une interruption de l’approvisionnement en sang du cerveau, ce qui entraîne un apport insuffisant d’oxygène au tissu cérébral. Selon l’American Heart Association, la prévalence des accidents vasculaires cérébraux aux États-Unis est d’environ 2,5% et touche environ 7 millions d’Américains, plus de 90% de ces cas étant attribuables à des facteurs de risque modifiables. Le PCI peut être dû à un traumatisme, à une pathologie sous-jacente ou être spontané. Il peut être classé plus loin en fonction de la région du cerveau impliquée. Les hémorragies provenant du cervelet représentent près de 10% des cas de tous les PCI. La première opération signalée sur une hémorragie cérébelleuse remonte à 1906 selon Ott, et al. . Depuis lors, d’autres rapports et recherches ont apporté une attention et des connaissances supplémentaires à cette pathologie. Des études ont rapporté que l’infarctus cérébelleux représente près de 3% de tous les accidents vasculaires cérébraux, soit environ 20 000 nouveaux infarctus cérébelleux chaque année aux États-Unis. L’incidence mondiale a augmenté chez les jeunes adultes au cours des trois dernières décennies, les accidents vasculaires cérébraux d’étiologie indéterminée représentant jusqu’à 30% des cas. Une hémorragie cérébelleuse non traumatique affecte environ 10 000 patients aux États-Unis chaque année, la majorité englobant des adultes plus âgés en raison d’une maladie chronique identifiable. Cependant, les hémorragies cérébelleuses spontanées chez de jeunes adultes en bonne santé sans conditions médicales sous-jacentes ni facteurs de risque sont rares.
L’aspect postéro-inférieur du crâne contient le tronc cérébral et le cervelet. Le cervelet est composé de deux hémisphères latéraux et d’un vermis médian qui sont considérés comme importants pour coordonner les mouvements et organiser l’information visuospatiale. Les dommages au cervelet produisent des déficits ipsilatéraux à la région touchée. Trois artères appariées alimentent le cervelet; l’artère cérébelleuse inférieure postérieure (PICA), l’artère cérébelleuse inférieure antérieure (AICA) et l’artère cérébelleuse supérieure (SCA). Ces trois artères font partie de la circulation postérieure du cerveau, connue sous le nom de système vertébrobasilaire. Ce système vasculaire alimente le cervelet, et ses micro-circuits très spécifiques afin qu’il puisse remplir de nombreuses fonctions complexes. De plus, les cellules du cortex cérébelleux possèdent une disposition laminaire uniforme, créant une orientation et un fonctionnement spécifiques des fibres nerveuses vers et depuis le cervelet. Cela contraste avec l’orientation des fibres nerveuses traversant le cortex et d’autres parties du cerveau. Bien qu’il soit généralement bien établi que le cervelet est responsable de la posture, des mouvements volontaires, des mouvements dirigés vers un objectif et spontanés, son rôle spécifique dans le traitement des informations spatiales pertinentes reste insaisissable. Molinari et Leggio mentionnent que même si des lésions cérébelleuses ont été rapportées pour altérer la cognition spatiale, « les modèles de réponse ont été très différents des dommages aux structures cérébrales spatiales classiques telles que l’hippocampe et le cortex pariétal ». Les dommages au cervelet ne produisent pas de déficits prévisibles, tout comme les dommages aux autres structures cérébrales. Les patients présentant un infarctus cérébelleux peuvent présenter un large éventail de déficits et de déficiences, allant de maladies mineures à des situations potentiellement mortelles. Bien que le cas qui sera présenté se soit produit au Canada, il est pertinent car de nombreux citoyens des îles des Caraïbes ont des liens et des liens avec les États-Unis et le Canada et voyagent d’avant en arrière.
Rapport de cas
Un homme de 26 ans, auparavant en bonne santé, a reçu de l’aide dans un hôpital de la région du Grand Toronto un jour d’hiver en 2011. Pendant le triage à la salle d’urgence, il vomissait sans cesse, semblait être léthargique, les yeux fermés et avait des troubles de l’élocution. Une ligne intraveineuse (IV) avec du dimenhydrinate dans une solution saline normale a cessé ses vomissements. Le bilan de routine était banal. Un scanner de tête avec contraste a montré une atténuation cérébelleuse dans la région du lobe cérébelleux droit, compatible avec un hématome cérébelleux, ce qui a conduit à un transfert d’interfacilité vers un hôpital doté d’installations neurochirurgicales (Figure 1).
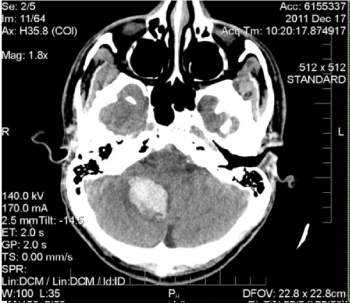
Figure 1. Tomodensitométrie axiale non améliorée de la tête. Il y a une hémorragie parenchymateuse aiguë hyperdense de 25 x 28 x 33 mm dans l’hémisphère cérébelleux droit provoquant une hernie de l’amygdale cérébelleuse droite
dans le foramen magnum avec effacement partiel du quatrième ventricule et hydrocéphalie précoce. L’étiologie de l’hémorragie n’est pas spécifique sur la base des résultats d’imagerie et pourrait être liée à une transformation hémorragique d’un infarctus ischémique, ou à une hémorragie en néoplasme ou malformation caverneuse
Au cours du séjour du patient aux soins intensifs, un historique complet a été obtenu. Selon le patient, tout a commencé comme suit; alors qu’il était allongé dans son lit, face vers le bas, il a tourné la tête sur le côté pour voir quelque chose. Ce faisant, il sentit une étrange sensation passer à l’arrière de son cou. Il n’y pensait pas beaucoup à l’époque, car cela ressemblait à une « crampe » au cou. Cependant, au cours des minutes 15; cela a rapidement changé pour le pire. Après l’étrange sensation du cou, il a commencé à ressentir un vague sentiment de malaise dans son estomac et ses intestins; il pensait que cela pourrait être atténué lors d’une selle. Il n’a pas réussi à passer les selles, mais le vague sentiment de malaise s’est transformé en nausée à part entière, et il a commencé à avoir l’impression que le monde tournait. Il s’est inquiété et a appelé la ligne d’urgence de télésanté de l’Ontario. Télésanté Ontario est une ligne téléphonique à la disposition des résidents qui fournit des conseils médicaux d’infirmières et d’infirmiers autorisés. Après avoir signalé ses symptômes, une visite à la salle d’urgence de l’hôpital le plus proche a été conseillée. À ce stade, il a commencé à vomir de manière incontrôlable et les vertiges prononcés ont rendu extrêmement difficile de garder les yeux ouverts. Moins d’une demi-heure après ses premiers symptômes, il a été conduit à l’hôpital où il s’est effondré sur le trottoir.
Un rapport détaillé de ses antécédents médicaux quelques jours après son admission ne mentionnait aucun facteur de risque identifiable, tel que: antécédents d’hypertension, de coagulopathie, de traumatisme crânien, antécédents familiaux connus d’anévrisme intracrânien ou de malformations artérioveineuses (MAV), antécédents de malignité ou de consommation de drogues (p. ex. cocaïne et amphétamines). Il consommait régulièrement de la marijuana et avait fumé la nuit précédente, mais pas le matin du. Comme la marijuana était encore illégale au Canada à l’époque, le seul moyen d’approvisionnement était par des voies illicites, ce qui soulève des soupçons quant à la source et au traitement du cannabis. La déclaration suivante présente un intérêt particulier: « Cette nuit-là, je me suis senti mal à l’aise lorsque je me procurais la marijuana, car elle provenait d’un autre fournisseur. J’ai remarqué qu’il brûlait différemment alors qu’il le faisait habituellement cette nuit-là, étant beaucoup plus humide que je ne m’en souvenais « » Aucun dépistage de drogue n’a été effectué.
Le séjour à l’hôpital du patient s’est déroulé sans incident et a été géré médicalement. Pendant son séjour aux soins intensifs, le patient a reçu une IRM pour une imagerie plus détaillée, qui a démontré l’étendue de l’hématome (Figures 2 et 3).
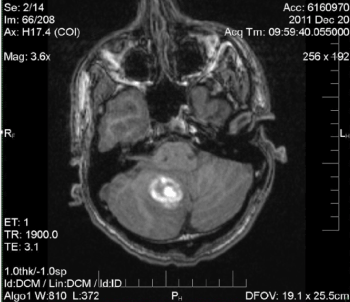
Figure 2. IRM: Hématome intra-parenchymateux de l’hémisphère cérébelleux inféromédial droit non spécifique mesurant 2,8 cm. Léger effet de masse local sur le quatrième ventricule inférieur. Pas d’hydrocéphalie obstructive. Aucune lésion sous-jacente identifiée à ce moment
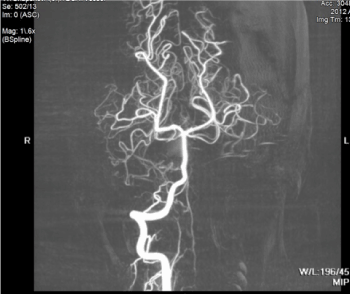
Figure 3. L’angiographie IRM est banale
L’IRM n’a pas révélé d’autre pathologie. Il est resté une semaine aux soins intensifs, suivi de plusieurs jours dans le service général, et est finalement devenu attaché en fauteuil roulant à sa sortie de l’hôpital. Le patient est resté attaché en fauteuil roulant en raison d’une démarche instable pendant trois semaines. La physiothérapie a été recommandée, mais n’a pas été utilisée car elle nécessitait des coûts directs. Une angiographie cérébrale a été recommandée, mais le patient a refusé en raison de préoccupations concernant les risques perçus. L’équipe neurochirurgicale a donc recommandé une angiographie dans les 6 à 12 mois suivant la sortie, qui pourrait potentiellement révéler une lésion vasculaire, imposant des risques à l’avenir. Une angiographie un an après la sortie a révélé des signes d’une fistule artério-veineuse durale à écoulement lent non agressif, décrite comme une découverte accidentelle et très probablement non liée à la présentation passée du patient. Une deuxième angiographie cérébrale un an après la date de la première a été réalisée pour suivre tout changement potentiel dans le système vasculaire, ne montrant finalement aucun changement, et le patient a été libéré sans condition des soins de l’équipe.
Le rétablissement d’un PCI varie considérablement d’un individu à l’autre et peut être très difficile à prévoir au début des phases aiguës. Le suivi avec le patient en 2020, 9 ans après l’événement, a révélé un homme de 35 ans qui s’était bien rétabli. Son discours était fluide et cohérent; cependant, il perdait facilement l’équilibre et ne pouvait pas marcher du talon aux pieds sans tomber. Ses signes vitaux étaient tous dans la plage normale. Les seuls médicaments qu’il prenait étaient la loratadine ou la diphenhydramine pour les allergies au besoin. Selon le patient, il éprouve des tremblements au repos qui deviennent parfois intentionnels lorsqu’il est stressé. Il y a des accès de vertige extrême qui le font rouler et tomber vers le sol, car il a l’impression de perdre tout contrôle moteur. Un test de dix-Hallpike est négatif. Son équilibre est facilement compromis, surtout du côté droit, cependant, il a par ailleurs fait un rétablissement remarquable compte tenu des circonstances. Il consomme encore de la marijuana de temps en temps.
Discussion
La majorité des hémorragies cérébelleuses surviennent chez les personnes âgées souffrant d’hypertension (60 à 70% des cas), tandis que les autres sont en grande partie dues à des malformations artérioveineuses (MAV), à une diathèse hémorragique et à des tumeurs. Les autres causes d’hémorragie cérébelleuse comprennent un traumatisme, une coagulopathie, un accident vasculaire cérébral ischémique avec transformation hémorragique, une angiopathie amyloïde cérébrale, une embolie septique, une encéphalite, une vascularite, des médicaments sympathomimétiques (par exemple cocaïne, amphétamines) et un anévrisme de la circulation cérébrale postérieure. Si une tumeur est la cause d’un saignement, il s’agit toujours d’un glioblastome. Une hémorragie cérébelleuse secondaire à un MAV a tendance à se produire chez les personnes plus jeunes, tandis que celles causées par une maladie vasculaire secondaire à l’hypertension sont plus fréquemment observées chez les personnes plus âgées. La présentation des symptômes varie considérablement en fonction de l’emplacement et de la taille de l’hémorragie. Les hémorragies plus petites peuvent ne pas altérer l’état mental du patient, tandis que les hémorragies plus grandes peuvent laisser le patient dans la stupeur ou ne pas répondre. Les symptômes couramment rapportés pour les hémorragies cérébelleuses comprennent des céphalées d’apparition brusque, des nausées et des vomissements, une ataxie tronconique, des vertiges, une dysarthrie, une rigidité nucale et un état mental ou un niveau de conscience altéré. Ceci est à noter car le patient à l’étude ne s’est pas plaint de maux de tête.
L’hémorragie cérébelleuse relève des lignes directrices de gestion de l’ICH; cependant, il y a beaucoup d’expérience clinique qui joue un rôle dans la détermination de la façon dont les lignes directrices sont appliquées. Selon Little, et al. cela s’applique particulièrement en cas de compression du tronc cérébral ou de gros hématomes avec effet de masse, entraînant une hydrocéphalie aiguë. Dans ces cas, les patients non opérables avaient un pronostic grave. Néanmoins, il y a un manque de preuves soutenant la prise en charge chirurgicale des patients atteints d’ICH entraînant une diminution globale de la mortalité, selon les essais CLEAR III et MISTIE III. L’élimination de gros hématomes n’est pas nécessairement associée à une amélioration des résultats fonctionnels.
Dans ce cas, l’équipe neurochirurgicale a décidé de ne pas recevoir de traitement chirurgical, une décision basée sur son expérience clinique. La décision de subir une prise en charge non chirurgicale chez notre patient présentant un hématome cérébelleux avec effacement partiel du quatrième ventricule et hernie partielle à travers le foramen magnum est discutable. La mortalité associée à une hémorragie cérébelleuse peut varier de 25 à 57% et provient en grande partie de complications telles que la compression du tronc cérébral, la hernie cérébelleuse et la compression du quatrième ventricule avec hydrocéphalie obstructive qui en résulte.
La grande majorité des hémorragies cérébelleuses ont des causes identifiables ou des facteurs de risque prédisposants. Seule une fraction des cas d’hémorragie cérébelleuse sont vraiment spontanés en ce sens qu’il n’y a pas d’antécédents de traumatisme, de cause identifiable ou de facteurs de risque prédisposants. Dayes, et coll. signalez les cas de 3 jeunes adultes de sexe masculin âgés respectivement de 30, 38 et 27 ans qui ont révélé un médulloblastome, une hémophilie A et un mélanome malin. Deux des trois cas concernaient une tumeur et un trouble de la coagulation, tous identifiés comme facteurs de risque. Mitchell & Angrist a étudié 12 cas de décès causés par une hémorragie cérébelleuse. Tous présentaient des facteurs de risque identifiables, notamment une néphrosclérose maligne, une artériosclérose cérébrale et une leucémie myéloïde, le facteur de risque le plus courant étant une maladie cardiovasculaire liée à l’hypertension. Hyland et Levy ont identifié 32 cas d’hémorragie cérébelleuse, dont quatre n’ont pas démontré de lésion sous-jacente. Les auteurs émettent l’hypothèse que les lésions étaient si petites qu’elles saignaient essentiellement et étaient comprimées.
Un examen de la littérature a révélé une autre association potentielle qui nécessite un examen, à savoir la marijuana. Le principal ingrédient psychoactif de la marijuana est le tétrahydrocannabinol (THC), une substance liposoluble ayant un volume de distribution élevé. La consommation d’un joint de marijuana ou d’une cigarette peut fournir entre 2,5 et 5 mg de THC. Il existe de nombreuses autres substances présentes dans la marijuana, y compris le cannabidiol (CBD) et elles ont toutes des effets variables sur le système nerveux central, notamment des propriétés sédatives, analgésiques et anticonvulsivantes. La littérature sur la consommation de cannabis est équivoque, avec des rapports d’effets neuroprotecteurs d’une lésion oxydante à d’autres avantages tels que l’analgésie, l’hypotension oculaire et les propriétés antiémétiques. La consommation de marijuana est associée à une hypotension systémique, à une altération des réflexes vasomoteurs périphériques, à une modification du flux sanguin cérébral et à une autorégulation vasculaire cérébrale. Une association entre la consommation de marijuana et les accidents vasculaires cérébraux chez les adultes a également été rapportée, bien que le mécanisme et la nature de cette relation restent flous. Une hypothèse est que la marijuana provoque des lésions vasculaires en favorisant le vasospasme, en particulier chez les utilisateurs peu fréquents. Selon une base de données d’échantillons de patients hospitalisés à l’échelle nationale de 2004 à 2011, l’incidence des accidents vasculaires cérébraux ischémiques aigus chez les consommateurs de marijuana était de 0,4% chez les personnes âgées de 15 à 54 ans. Avec la légalisation de la marijuana dans des endroits comme le Canada, son utilisation est encore plus répandue. Par conséquent, on s’attendrait à voir plus de cas, mais seul un petit nombre d’infarctus cérébelleux chez les utilisateurs se trouve dans le monde. Une explication possible est qu’il pourrait y avoir des variables confusionnelles, telles que la contamination de la marijuana avec d’autres substances.
La littérature ne fournit pas de réponse définitive quant à l’association entre l’ischémie aiguë et la consommation de marijuana. Deux essais prospectifs n’ont pas montré d’association entre la consommation de marijuana et l’AVC. Une étude cas contrôlée a révélé une probabilité d’AVC 2 à 3 fois plus élevée chez les consommateurs de marijuana, déterminée comme étant due à la variable confondante de la consommation de tabac associée à la consommation de marijuana. Bien. une étude de la base de données nationale a révélé une probabilité 1 à 17 fois plus élevée d’AVC associée à la consommation de marijuana, même après avoir contrôlé la consommation de tabac. Ainsi, il n’y a pas de support définitif de l’hypothèse selon laquelle la consommation de marijuana est associée à des accidents vasculaires cérébraux chez les jeunes adultes. Notre patient a consommé de la marijuana quotidiennement pendant de nombreuses années auparavant, mais pas le matin de l’incident.
Le cannabis et ses produits associés peuvent être contaminés par des pesticides, des moisissures, des bactéries, des métaux et des solvants. Étant donné que la marijuana est illégale dans de nombreux pays et états d’Amérique, il est probable que la marijuana puisse être contaminée par la cocaïne ou les amphétamines, car de nombreux fournisseurs traitent plus d’une substance illicite. Les plantes et les produits de cannabis peuvent ramasser des moisissures ou des bactéries pendant leur croissance et peuvent accumuler des niveaux élevés de métal dans le sol ou le milieu de croissance. La contamination par les engrais peut également se produire. La production de produits liés au cannabis tels que des concentrés (p. ex. brisure, pâte, bourgeon), présentent une occasion supplémentaire pour les agents de transformation, tels que le butane et le propane, de présenter des problèmes de santé. La marijuana obtenue illicitement n’est pas contrôlée et il n’existe aucune norme réglementaire en matière de filtration. Il est possible que dans ce cas, la marijuana utilisée par le patient la veille ait été contaminée.
Conclusion
L’hémorragie cérébelleuse spontanée chez de jeunes adultes en bonne santé est un phénomène extrêmement rare qui nécessite des recherches et des recherches plus approfondies. Bien qu’une voie causale ne puisse jamais être élucidée, la reconnaissance et le traitement rapides d’une hémorragie cérébelleuse peuvent faire la différence entre la vie et la mort. Des lignes directrices sur la prise en charge de l’ICH existent, mais ne sont pas bien définies pour l’hémorragie cérébelleuse. Étant donné que chaque cas est unique, il faut s’attendre à une clémence dans le strict respect des directives. D’autres recherches peuvent révéler les causes et la physiopathologie sous-jacente. Plus de recherches entre la consommation de marijuana, les additifs et les accidents vasculaires cérébraux sont nécessaires pour prouver ou réfuter l’association avec l’ICH, en particulier l’hémorragie cérébelleuse, qui a un taux de mortalité élevé.
- Benjamin EJ, Muntner P, Alonso A, Bittencourt MS, Callaway CW, et al. (2019) Statistiques sur les maladies cardiaques et les accidents vasculaires cérébraux – Mise à jour 2019: Un rapport de l’American heart association. Circulation 139: e56-e528.
- Fischer MA, Das JM (2019) Hématome cérébelleux. StatPerles.
- Ott KH, Kase CS, Ojemann RG, Mohr JP (1974) Hémorragie cérébelleuse: diagnostic et traitement. Archives de neurologie 31:160-167.
- Edlow JA, Newman-Toker DE, Savitz SI (2008) Diagnostic et prise en charge initiale de l’infarctus cérébelleux. The Lancet Neurology 7: 951-964.
- Viswanathan V, Yu C, Sambursky JA, Kaur S, Simpkins AN (2019) Ischémie cérébrale aiguë associée temporellement à la consommation de marijuana. Cureus 11: e5239.
- Hemphill JC, Amin-Hanjani S (2019) Hémorragie intracérébrale cérébelleuse. JAMA 322:1355-1356.
- Middleton FA, Strick PL (1998) Le cervelet: un aperçu. Tendances en sciences cognitives 2:305-306.
- Molinari M, Leggio MG (2007) Traitement de l’information cérébelleuse et fonctions visuospatiales. Le Cervelet 6:214-220.
- Dayes LA, Purtzer TJ, Shahhal I, Cojocaru T, Knierim D, et al. (1986) Hémorragie cérébelleuse spontanée aiguë. Journal de l’Association médicale nationale 78:495-499.
- Odom GL, Tindall GT, Dukes HT (1961) Hématome cérébelleux causé par des malformations angiomateuses. Journal de neurochirurgie 18:777-782.
- Hemphill JC, Greenberg SM, Anderson CS, Becker K, Bendok BR, et al. (2015). Lignes directrices pour la prise en charge de l’hémorragie intracérébrale spontanée. Course 46:2032-2060.
- Little JR, Tubman DE, Ethier R (1978) Hémorragie cérébelleuse chez l’adulte: diagnostic par tomographie informatisée. Journal de neurochirurgie 48:575-579.
- Mitchell N, Angrist A (1942) Hémorragie cérébelleuse spontanée: Rapport de quinze cas. Le Journal américain de pathologie 18: 935-953.
- Hyland HH, Levy M (1954) Hémorragie cérébelleuse spontanée. Journal de l’Association médicale canadienne 71:315-323.
- Geller T, Loftis L, Brink DS (2004) Infarctus cérébelleux chez les adolescents mâles associés à une consommation aiguë de marijuana. Pediatrics 113:365-370.
- Seltenrich N (2019) Contaminants du cannabis: Solvants régulateurs, microbes et métaux dans les mauvaises herbes légales. Perspectives de santé environnementale 127:0820011-0820016.
- https://data.worldbank.org/indicator/BX.TRF.PWKR.DT.GD.ZS?locations=GD
