Introduction
Les cellules cytotoxiques font partie intégrante de la lutte contre les cellules infectées par le virus et les cellules cancéreuses. Ces cellules tuent par trois voies différentes, la libération de granules lytiques, la voie récepteur-ligand du Saf ou la voie récepteur–SENTIER. Aux fins de cet article, nous nous concentrerons sur la dégranulation. Lorsqu’une cellule cytotoxique rencontre une cellule cible, elle y adhère étroitement pour former la synapse immunitaire. Les granules lytiques sont ensuite polarisés vers la synapse immunologique et libérés de la cellule cytotoxique dirigée vers la cible (1). Ces granules contiennent divers médiateurs cytotoxiques tels que la perforine et les granzymes. La perforine libérée peut former des pores transitoires dans la membrane cellulaire cible permettant aux granzymes d’entrer dans la cellule cible. L’entrée est probablement également médiée par des oligomères de perforine formant des pores incomplets (arcs) (2), et il a également été suggéré que les granzymes et la perforine peuvent être absorbées dans les cellules cibles par la voie endosomale (3, 4). Les données à l’origine de ces mécanismes proposés ont récemment été discutées en détail (5). Lorsque les granzymes pénètrent dans les cellules cibles, la voie de la caspase est activée, ce qui entraîne une apoptose (6, 7). La membrane de ces granules cytotoxiques contient une glycoprotéine membranaire associée au lysosome-1 (LAMP1), également connue sous le nom de CD107a(8). La partie luminale du rat CD107a est exposée transitoirement au côté extracellulaire de la membrane cellulaire après dégranulation avant d’être à nouveau intériorisée. Par conséquent, la coloration au CD107a indique qu’un événement de dégranulation s’est produit (9). Alors que le rôle du CD107a est encore en cours de détermination, des études sur l’ARNsi contre le CD107a ont montré qu’il est essentiel pour le trafic de perforine dans les vésicules, car l’administration de perforine aux granules lytiques est inhibée en l’absence de CD107a (10). Il a également été démontré que le CD107a joue un rôle dans la protection des cellules cytotoxiques contre la mort en se liant à la perforine et en empêchant l’insertion dans la membrane cellulaire (11).
Il existe deux principaux types de lymphocytes cytotoxiques, les cellules tueuses naturelles (NK) et les lymphocytes T CD8. Les deux types cellulaires tuent par la libération de granules lytiques, la voie du récepteur Fas / ligand Fas et la voie du récepteur TRAIL / TRAIL, mais le stimulus nécessaire pour activer ces deux groupes cellulaires est différent. Les lymphocytes T reconnaissent l’antigène présenté par les molécules du CMH de classe I grâce à leur récepteur activateur des lymphocytes T (TCR), tandis que les cellules NK reconnaissent les antigènes des cellules cibles via divers récepteurs inhibiteurs et activateurs. Les récepteurs inhibiteurs sont importants pour empêcher les cellules NK de tuer les cellules saines tout en activant les récepteurs induisant une cytotoxicité des cellules NK.
Avant l’identification du CD107a comme marqueur de dégranulation dans les cellules NK (12), la sortie pour mesurer la capacité cytotoxique était la mort des cellules cibles. La détection du CD107a par cytométrie en flux a permis aux chercheurs d’identifier les cellules effectrices spécifiques ayant une capacité cytotoxique. Depuis sa découverte, un large éventail de publications de données provenant d’études sur la souris et l’homme a été achevé montrant l’avantage d’utiliser un anticorps anti-CD107a. Le rat est un modèle animal immunologique précieux pour l’étude de maladies telles que la leucémie et la greffe vs. la maladie de l’hôte (13), mais les lectures fonctionnelles ont été entravées par l’absence d’anticorps anti-CD107a spécifiques de haute qualité pour la cytométrie en flux. Cet article décrit la création d’un anticorps dirigé contre le CD107a du rat et la caractérisation de la réponse de dégranulation dans les lymphocytes T NK et CD8+ du rat.
Matériaux et méthodes
Animaux
Hamsters consanguins arméniens (Cytogen Research and Development Inc., MA, États-Unis) ont été hébergés au Département de médecine comparée du Rikshospitalet, Hôpital universitaire d’Oslo, en accord avec les directives institutionnelles. Les souches de rats PVG-RT1U, PVG-RT7b, PVG-RT1N et PVG-R23 ont été utilisées de manière interchangeable et maintenues pendant plus de 20 générations et hébergées conformément aux directives établies par le Conseil des Animaux Expérimentaux du Ministère norvégien de l’Agriculture et par la Convention Européenne pour la Protection des Animaux Vertébrés utilisés à des fins expérimentales et Autres fins scientifiques. Les rats ont été utilisés à l’âge de 8 à 12 semaines. Les installations pour animaux de laboratoire sont soumises à un programme de surveillance sanitaire de routine et testées pour les organismes infectieux conformément à une modification des recommandations de la Fédération des Associations Européennes de Sciences Animales de Laboratoire. Les expériences sur les animaux étaient réglementées par des règlements de laboratoire, qui sont énoncés par la Loi sur le bien-être des animaux dans laquelle la Norvège suit les directives des laboratoires de l’UE et la convention européenne sur les laboratoires.
Abs et réactifs
Anticorps dirigés contre NKp46, NKR-P1A 3.2.3-PB, ou non conjugué (liant uniquement NKR-P1A, mais pas NKR-P1B, dans la souche PVG), CD8 (OX8-biotine), CD2 (OX34, non conjugué), TCR (R73-Alexa647), allotype IGD b de souris (TIB96-non conjugué, utilisé comme isotype IgG de souris) et CD45.2 (His41-FITC, utilisé comme isotype IgG de souris) ont été fabriqués dans notre laboratoire et conjugué selon les protocoles standard. Des anticorps contre CD3 (IF4, non conjugués) et son IgM de souris isotype (MM-30, non conjugués) et le contrôle isotype IgG de hamster arménien (HTK88-FITC) ont été achetés auprès de Biolegend (San Diego, CA, USA). Des anticorps anti-CD107a commerciaux ont été achetés chez AbCam (Cambridge, Royaume-Uni) (H4A3-FITC), eBioscience (San Diego, CA, États-Unis) (ID48-PerCP-eFluor) et Lifespan (Seattle, WA, États-Unis) (LS-C8580 – non conjugués). Le LS-C8580 a été conjugué avec l’ester NHS Alexa488 (Sigma-Aldrich, St. Louis, MO, USA) pour une utilisation dans des dosages fonctionnels. Des anticorps anti-FLAG (M2, non conjugués) et des IgG anti-souris (polyclonal de chèvre – FITC) ont été achetés auprès de Sigma-Aldrich (St. Louis, MO, USA). L’IL-2 a été obtenu à partir d’un surnageant de culture cellulaire dialysé d’une lignée cellulaire d’ovaire de hamster chinois (CHO) transfectée de manière stable avec une construction d’expression d’IL-2 chez le rat. La streptavidine conjuguée à la protéine Peridinine Chlorophylle-a (PerCP), le contrôle d’isotype polyclonal des IgG de hamster FITC, le contrôle d’isotype des IgG1 de souris FITC (MOPC-FITC) et le GolgiStop ont été achetés auprès de BD biosciences (Franklin Lakes, NJ, États-Unis). Hamster anti-arménien de chèvre (polyclonal-FITC) a été acheté à Jackson Immunoresearch (West Grove, PA, USA). Des surnageants d’hybridomes OX41, CD172a (SIRPa), R73 (TCRaß anti-rat), OX19 (anti-CD5), OX12 (chaîne anti-Igk) et OX33 (anti-CD45RA) ont été fabriqués en interne. Le sérum de hamster témoin a été dérivé de hamsters arméniens non vaccinés.
Le clonage de CD107a de rat
Le CD107a de rat a été amplifié par PCR à partir d’ADNc généré à partir de splénocytes de rat PVG et sous-cloné dans un vecteur d’expression pMX contenant un gène de résistance à la puromycine (un don généreux du Dr Michael R. Daws) (14). Les amorces CD107 ont été conçues sur la base d’une séquence d’ADNc CD107a (LAMP1) de rat (GenBank: NM_012857). Amorce avant: 5′ – GCCCCAGCACTGTTCGAGGT-3′; Amorce inverse : 5′- GTTGTTACCGTCCTGTACACACT-3′. Un peptide leader anionique de la trypsine-1 (MSALLILALVGAAVA) a été utilisé dans le vecteur d’expression, et la région transmembranaire CD107 originale a été remplacée par un fragment transmembranaire CD8 pour faciliter l’expression de surface élevée. Une étiquette-DRAPEAU (DYKDDDDK) a été ligaturée à la borne N de la protéine CD107 pour rendre l’expression de surface détectable. Toutes les séquences insérées et le cadre de lecture ouvert dans la construction finale du plasmide chimérique ont été examinés et confirmés par séquençage de l’ADN de Sanger.
Transfection de la ZEB.36 cellules avec du Plasmide pMX-CD107a
Des cellules 293T ont été ensemencées dans une plaque de culture cellulaire à 6 puits avec 4 ml de milieu RPMI 1640, transfectées avec 7,5 µl de réactif FuGENE6 (Roche, protocole du fabricant) et incubées à 37 ° C avec 5% de CO2. Le réactif FuGENE6 a été pré-dilué avec Opti-MEM (Gibco) et mélangé avec 1,5 µg de plasmide pMX-CD107a et 1 µg de plasmide d’emballage rétroviral spécifique au rongeur pCL-ECO (Addgene #12371). Vingt-quatre heures après la transfection, le surnageant a été décanté et remplacé par un milieu RPMI1640 à 2% de FBS et transféré à 32°C pour la production de rétroviraux. Quarante-huit heures plus tard, le surnageant a été récolté et filtré avec un filtre Filtropur S de 0,2 µm (Sarstedt) et enregistré à -80°C pour la transduction rétrovirale.
Les 105 BWZ.36 cellules ont été ensemencées par puits dans une plaque de culture cellulaire à 24 puits (Corning) et cultivées avec du milieu RPMI1640 frais avec 10% de FBS, pendant la nuit. Le surnageant a été éliminé et du RPMI1640 contenant 10% de FBS, 16 µg de polybrène (à une concentration finale de 8 µg/ml) et 1,5 ml de surnageant rétroviral ont été ajoutés et centrifugés à 32°C à 2400 tr/min pendant 2 h. Les cellules ont ensuite été incubées à 32°C pendant 1 h après quoi le surnageant a été éliminé et remplacé par du milieu RPMI1640 frais à 10% de FBS et cultivées pendant 3 jours, à 37°C avec 5% de CO2 (au jour 2, un milieu complet à 1 ng/ml de puromycine a pu être utilisé). Les transfectants BWZ.CD107a-FLAG élargis ont été examinés pour l’expression de surface de l’étiquette-DRAPEAU, puis ont été utilisés pour l’immunisation ou le dépistage des anticorps.
Génération de CD107A Exprimant des Transfectants
Le plasmide CD107a de rat chimérique a été transfecté dans des cellules CHO. Brièvement, les cellules CHO ont été cultivées en milieu RPMI1640 complet (cRPMI; milieu RPMI1640 avec 10% de FBS, Pyruvate de Na de 1 mm, 2-mercaptoéthanol de 50 µm) jusqu’à ce qu’elles atteignent 30% de confluence. Le plasmide de 2,5 µg a été mélangé à 7,5 µl de réactif Fugène 6 (Roche) et ajouté goutte à goutte sur les cellules. Deux jours après, les cellules CHO ont été détachées avec du milieu RPMI1640 additionné d’EDTA de 2 mm et ont été ensemencées dans des plaques de culture de cellules à fond plat à 96 puits (25 cellules/puits) avec du milieu de sélection (cRPMI additionné de puromycine à 20 µg/ml) pour le clonage de transfectants stables. Après 10 à 12 jours de culture, les clones adultes ont été dépistés avec un anticorps anti-DRAPEAU (M2). L’un des clones exprimant le niveau de surface le plus élevé de FLAG et de CD107a a été utilisé pour les vaccinations.
Immunisation et fusion cellulaire
Les hamsters arméniens consanguins mâles âgés de 3 à 10 semaines ont été immunisés par injections intrapéritonéales (i.p.) avec 2 × 106 cellules DRAPEAU CHO.CD107a une fois par semaine pendant 3 semaines. Un boost avec 4 × 106 cellules BWZ.CD107a-FLAG transfectées de manière stable a été administré i.p. 32 jours après la première immunisation et les sérums ont été analysés pour la coloration de surface à la fois du CHO.CD107a-FLAG et du BWZ.CD107a – transfectants de DRAPEAU. Deux des trois animaux étaient positifs, et 3 jours après la stimulation, des cellules de la rate ont été récoltées et regroupées chez les deux animaux, dont l’un présentait une splénomégalie. Environ 2,0 × 108 cellules de rate et 1,4 × 108 cellules de myélome NS0 ont été lavées trois fois dans du DMEM avec des additifs (pyruvate de sodium de 1 mm, 2-mercaptoéthanol de 0,05 mm et antibiotique / antimycotique) et centrifugées à 90 g pendant 10 min. En maintenant le tout à 37 °C à partir de ce point, la pastille a été dissoute en tapotant le tube et du polyéthylène glycol 1500 (Roche) pré-réchauffé a été ajouté goutte à goutte en remuant doucement pendant 1 min. Trois millilitres de DMEM avec additifs ont été ajoutés progressivement pendant les 3 minutes suivantes en finissant avec 7 ml supplémentaires avant d’être centrifugés à 500 g. Le culot a été lavé par rinçage soigneux (pas de remise en suspension) avec du DMEM avec additifs et 20% de FBS (DMEM-20) et cultivé pendant une nuit. Les cellules ont été récoltées le lendemain et 100 ml de DMEM-20 avec 2× hypoxanthine–aminoptérine–thymidine (SIGMA) et 10% de supplément de clonage d’hybridomes (HCS) (PAA) ont été ajoutés. La suspension cellulaire a été transférée sur des plaques à 96 puits. Après 12 jours, des surnageants provenant de clones en croissance ont été testés par cytométrie en flux pour la coloration des antigènes de surface présents sur BWZ.CD107a-FLAG et CHO.CD107a-FLAG, mais pas sur BWZ.36 cellules transfectées avec des antigènes marqués d’un DRAPEAU non pertinents en tant que témoins négatifs. Les 9 des 12 clones positifs produisant des anticorps spécifiques ont ensuite été sous-clonés à l’aide de DMEM-20 additionné d’hypoxanthine-thymidine et de HCS. Un seul clone (SIM1) a encore produit des anticorps après le sous-clonage et celui-ci a encore été sous-cloné une fois de plus. Des anticorps IgG de hamster spécifiques au CD107a ont été détectés par des IgG de hamster anti-arménien FITC (Jackson Immunoresearch). L’anti-CD107a de l’hybridome SIM1 a été purifié par la protéine HiTrap G HP (GE Healthcare, Life Sciences) et conjugué FITC selon les procédures standard ou Alexa488 conjugué selon le protocole du fabricant.
Génération de Cellules effectrices
Des suspensions unicellulaires ont été préparées à partir de la rate. Les lymphocytes ont été isolés à l’aide d’un gradient de Lymphoprep, puis courus sur une colonne de laine de nylon pour éliminer les cellules B et les macrophages. Pour la génération de cellules NK activées par l’IL-2 (LAK), les cellules restantes ont été cultivées pendant une nuit dans l’IL-2. Le lendemain, les cellules non adhérentes ont été éliminées par lavage au PBS et les cellules NK adhérentes ont été maintenues dans du RPMI additionné d’IL-2, de FBS inactivé à la chaleur à 10%, de Streptomycine / pénicilline à 1%, de pyruvate de sodium à 1 mm et de 2-mercaptoéthanol à 50 µM. Les cellules ont été cultivées pendant 8 à 10 jours. Pour la génération de cellules NK enrichies ou de cellules T et NK triées, les cellules ont été enrichies par sélection négative après l’étape de laine de nylon. Pour l’enrichissement des cellules NK, les Dynabeads IgG pan-souris (Invitrogen Dynal) ont été enrobés d’anticorps contre les macrophages (OX41), les lymphocytes T (R73 et OX19) et les lymphocytes B (OX12 et OX33). Pour l’enrichissement des lymphocytes T, les Dynabeads d’IgG pan-souris ont été colorés avec des anticorps contre les macrophages (OX41) et les lymphocytes B (OX12 et OX33). Les cellules ont été enrichies par deux étapes de sélection négative avec des billes colorées pendant 30 min à 4°C. Les cellules NK enrichies avaient une pureté d’environ 50 à 60% et ont été utilisées pour des études de dégranulation. Les cellules T enrichies (pureté de 79 à 85%) ont été triées pour les cellules TCR+ à l’aide d’un Aria FACS (BD Biosciences).
Essais de dégranulation
Pour mesurer la réponse de dégranulation par coloration avec un anti-rat CD107a (SIM1) pendant la stimulation des cellules cibles, des effecteurs NK et des cellules cibles YAC ont été incubés, à un rapport de 1 à 1 de 3 × 105 cellules / puits (sauf indication contraire) dans des milieux contenant le mAb SIM1, les autres anticorps anti-CD107a disponibles dans le commerce, ou un contrôle d’isotype. Pour mesurer la réponse de dégranulation à la stimulation par anticorps des cellules NK, nous avons utilisé des plaques à fond plat à 96 puits recouvertes de concentrations variables d’anti-NKp46 (Wen23), d’anti-NKR-P1A (3.2.3) et d’un contrôle isotype IgG1 de souris (TIB96). Le lendemain, les plaques ont été lavées avec du PBS et bloquées avec du cRPMI avant ajout de 3 × 105 cellules NK enrichies en suspension dans du cRPMI contenant du SIM1 par puits. Pour mesurer la dégranulation des cellules T, elles ont été triées et cultivées en cRPMI avec de l’IL-2 pendant 2-3 jours. Les plaques à fond plat à 96 puits ont été recouvertes pendant la nuit d’anticorps contre CD3 (IF4), CD2 (OX34) ou un contrôle d’isotype IgM (MM-30). Environ 3 × 105 cellules T ont été ajoutées par puits dans des cRPMI contenant SIM1. Tous les tests ont été incubés pendant 4 h. Golgistop a été ajouté pendant les 3 dernières heures d’incubation pour éviter la dégradation du CD107a internalisé. Les cellules ont ensuite été lavées et colorées avec des anticorps dirigés contre les récepteurs de surface appropriés et analysées à l’aide du FACS Canto ou du LSR II (BD Biosciences).
Dosage de la libération de chrome
Cellules cibles YAC-1 (5 × 106 cellules/ ml cRPMI) avec ajout de 3.7 MBq51Cr ont été incubés à 37°C pendant 1 h sous agitation toutes les 15 min. Les cellules ont ensuite été lavées trois fois avec du PBS avec 2% de FBS et remises en suspension à 1 × 105 cellules / ml en cRPMI. Les cellules effectrices de LAK et les cellules cibles ont été plaquées aux rapports spécifiés dans un volume final de 200 µl. Les cellules ont été centrifugées et incubées pendant 4 h à 37°C. La libération spécifique de 51Cr a été mesurée à l’aide du Cobra auto-gamma (Packard).
Résultats
Pour créer un anticorps contre CD107a, nous avons créé un vecteur d’expression contenant la région membranaire extracellulaire de CD107A de rat, la région transmembranaire de CD8 de rat, et un drapeau-tag 3′ terminal pour détecter l’expression de surface (Figure 1A). Le vecteur a été transfecté en cellules CHO et en BWZ.36 Lignées de lymphocytes T et criblées pour l’expression de CD107a à l’aide d’un anticorps anti-FLAG (M2) (Figure 1B). Des cellules CHO transfectées de manière stable de CD107a ont été injectées à des hamsters consanguins arméniens une fois par semaine pendant 3 semaines avec un coup de pouce final des cellules BWZ transfectées de manière stable de CD107a 3 jours avant la fusion avec la lignée cellulaire du myélome NS0. Les surnageants des différents clones ont été testés pour leur spécificité vis-à-vis de BWZ.CD107a-FLAG, mais pas de BWZ marqué par un DRAPEAU non pertinent.36 transfectants. On a constaté qu’un clone, SIM1, se liait spécifiquement au CD107A exprimant le transfectant, mais pas au témoin transfecté d’INDICATEUR (figure 1C).

Figure 1. Génération d’un anticorps monoclonal anti-rat CD107a (SIM1). (A) Carte vectorielle schématique du vecteur d’expression pMX avec le peptide leader, l’étiquette-DRAPEAU, l’insert CD107a et le domaine transmembranaire de CD8. (B) Ovaire de hamster chinois transfecté de manière stable et BWZ.36 cellules ont été testées pour l’expression à la surface cellulaire du CD107a marqué par un DRAPEAU à l’aide d’un anticorps anti-DRAPEAU (M2) (histogrammes ombrés). Le témoin négatif est un anticorps secondaire seul (histogramme transparent). (C) Les cellules BWZ transfectées avec un DRAPEAU CD107a ou un antigène non pertinent (DRAPEAU NKR-P1F) ont été colorées avec du sérum témoin de hamster, du surnageant SIM1 ou un anticorps anti-DRAPEAU (M2).
Le clone SIM1 a été testé en parallèle avec deux anticorps CD107a disponibles dans le commerce, qui pourraient potentiellement réagir de manière croisée avec le CD107a de rat en cytométrie en flux. Les clones d’anticorps testés étaient H4A3 d’AbCam (qui réagit de manière croisée avec l’homme, le rat, la souris et les primates en cytométrie en flux) et le clone d’anticorps LS-C8580 de LifeSpan BioSciences (qui réagit de manière croisée avec le CD107a de souris, d’humains et de rats en immunohistochimie et en Western blots selon le site Web du fabricant). Notre clone d’anticorps SIM1 a identifié des cellules dégranulatrices en présence de cellules cibles et a montré peu de coloration de fond en l’absence de cibles (figure du panneau supérieur 2A). Le clone H4A3 a coloré le pourcentage le plus élevé de cellules NK après stimulation de la cellule cible (panneau central). Cependant, il y avait également un niveau élevé de coloration de fond en l’absence de cellules cibles, indiquant une liaison non spécifique. Des niveaux de dégranulation très faibles, le cas échéant, ont été mesurés par le clone mAb LS-C8580 (panneau inférieur). La spécificité de ces anticorps a été confirmée par une coloration positive du transfectant BWZ.CD107a-FLAG, mais pas du BWZ.NKR-P1F – Contrôle du DRAPEAU (Figure 2B). Le clone d’anticorps H4A3, dont il a été démontré qu’il se liait au CD107a humain (16), n’a pas taché les cellules BWZ transfectées au CD107A de rat, ce qui indique qu’il n’y a pas de réaction croisée avec le CD107A de rat. Le clone anti-souris CD107A ID48 n’a pas non plus taché le transfectant CD107a de rat. Le LS-C8580 non conjugué, en revanche, a montré une coloration spécifique des cellules transfectées CD107a (données non représentées). Cependant, le clone LS-C8580 n’est disponible que sous forme d’anticorps non conjugués qui ne convient pas aux études de dégranulation. Les tentatives répétées dans notre laboratoire de conjuguer LS-C8580 à Alexa488 n’ont malheureusement pas fourni de conjugués de coloration forte, bien que la petite taille de l’échantillon et la concentration de LS-C8580 puissent être la cause de la mauvaise conjugaison. Le LS-C8580 conjugué montre une coloration réduite mais spécifique des cellules transfectées de CD107a (Figure 2B), mais comme le montre la figure 2A, nous n’avons pas été en mesure de détecter les cellules dégranulatrices lors d’essais fonctionnels avec ce conjugué. En conclusion, le mAb SIM1 colore spécifiquement les cellules NK de rat dégranulant après stimulation avec des cellules cibles.

Figure 2. SIM1 mesure la dégranulation des cellules T tueuses naturelles (NK) et CD8. (A) Le pourcentage de cellules dégranulatrices a été mesuré à l’aide des anticorps anti-CD107a SIM1, H4A3 et LS-C8580, avec ou sans cellules cibles YAC-1 comme stimulus. Une expérience représentative de quatre est représentée (B). Coloration de la lignée cellulaire BWZ.CD107a-FLAG avec des clones d’anticorps SIM1, H4A3, LS-C8580 ou ID48. BWZ.36 cellules transfectées avec un antigène marqué par un indicateur non pertinent (BWZ.NKR-P1G-FLAG) a été inclus comme témoin négatif, (C) les cellules NK enrichies ont été stimulées avec un anti-NKp46 lié à la plaque, un anti-NKR-P1A ou un IgG1 de souris comme contrôle d’isotype, et SIM1 a été utilisé pour mesurer le pourcentage de cellules dégranulatrices. Les cellules NKp46+ (Wen23) ou NKR-P1Abright (3.2.3) ont été activées. (D) Les cellules TCR+ ont été triées (pureté 99%) et cultivées dans de l’IL-2 pendant 2 à 3 jours. Les cellules ont ensuite été stimulées avec un contrôle d’isotype d’anti-CD3 et d’anti-CD2 lié à la plaque ou d’IgM de souris pour l’anti-CD3. Le panneau inférieur montre une stimulation avec anti-CD3 et anti-CD2 et une coloration avec un contrôle isotype SIM1 (polyclonal IgG de hamster FITC). Les cellules T ont été triées à l’aide d’anticorps R73-Alexa647 et 3.2.3-PB, agissant sur les cellules R73+/3.2.3−. Les données présentées proviennent d’une expérience représentative de trois expériences indépendantes distinctes.
La stimulation directe de l’activation des récepteurs NK par des anticorps liés à la plaque est une autre méthode puissante pour induire la dégranulation. Pour tester le clone SIM1 dans ce test fonctionnel, nous avons incubé des cellules NK enrichies sur des plaques recouvertes d’anticorps dirigés contre les récepteurs activateurs NKp46 et NKR-P1A (Figure 2C). En tant que témoin négatif, les plaques ont été recouvertes d’un témoin isotype IgG1 de souris. La coloration avec l’anticorps SIM1 a permis d’identifier 25,5 ou 44% de cellules dégranulatrices après stimulation des cellules NK dans des plaques revêtues de 5 µg/ml d’anti-NKp46 ou d’anti-NKR-P1A respectivement. Le pourcentage de cellules dégranulatrices augmente encore lorsque les plaques sont enrobées d’une concentration plus élevée d’anticorps stimulants (10 µg/ml). Aucune dégranulation n’a été induite dans les puits recouverts du témoin isotype IgG1 de souris.
Nous avons clairement vu une dégranulation dans les cellules NK stimulées avec des cellules cibles ou avec des anticorps contre les récepteurs d’activation en utilisant notre anticorps SIM1. Nous voulions également le confirmer dans les lymphocytes T cytotoxiques. Les cellules T ont été triées à partir de cellules de la rate et cultivées dans l’IL-2 pendant 2-3 jours. Les lymphocytes T ont ensuite été stimulés avec des anti-CD3 et des anti-CD2 liés à la plaque (Figure 2D). La dégranulation a été mesurée à partir de cellules T CD8+ en culture lorsqu’elles étaient stimulées par des anti-CD3 et des anti-CD2 aux deux jours 2 et 3. Aucune dégranulation n’a été mesurée à partir de lymphocytes T CD4 non cytotoxiques, ou après stimulation avec un anticorps contrôle isotype, démontrant davantage la spécificité de notre anticorps SIM1.
Les cellules tueuses activées par la lymphokine (LAK) sont créées en cultivant des cellules NK dans l’IL-2 pendant 7 à 10 jours et sont couramment utilisées comme cellules effectrices très puissantes dans les tests de libération de chrome pour étudier la cytotoxicité et devraient donc pouvoir générer des niveaux élevés de dégranulation. Pour mesurer la dégranulation des cellules LAK, nous avons initialement utilisé un 1:1 rapport de l’effecteur aux cibles mais trouvé des niveaux de dégranulation étonnamment bas (données non illustrées). Cependant, en effectuant un titrage pour trouver des rapports effecteurs / cibles optimaux, nous avons constaté que des niveaux croissants de dégranulation pouvaient être atteints lorsque les rapports effecteurs / cibles étaient inférieurs à 1 (figure 3A). Le rapport optimal pour les essais de dégranulation contraste donc avec les essais de cytotoxicité où le niveau de cytotoxicité augmente avec des rapports effecteur/cible plus élevés (figure 3B).
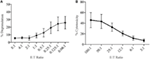
Figure 3. Effecteur faible:les ratios cibles sont importants pour assurer une sensibilité adéquate dans les tests de dégranulation avec des cellules NK de rat. (A) Dégranulation de cellules LAK cultivées 8 à 10 jours dans l’IL-2 contre des cibles YAC-1 à différents rapports effecteur/ cible. (B) La cytotoxicité de LAK cultivée en IL-2 contre des cellules cibles YAC-1 a été confirmée avec le test de libération de chrome terminé les jours 8 à 10. Tous les graphiques sont cumulatifs de trois expériences distinctes ou plus avec des barres montrant SD.
Discussion
Dans le test initial de SIM1 et des différents anticorps CD107a commerciaux dans les tests de dégranulation chez le rat, nous avons choisi une petite gamme de rapports effecteurs / cibles avec une inclinaison vers plus de cellules effectrices que de cibles sur la base de la littérature actuelle (12, 16, 17). Les rapports effecteur/cellule cible peuvent varier d’un papier à l’autre, mais des études antérieures qui titraient les rapports effecteur/cible ont montré que la dégranulation optimale des cellules NK de souris atteignait un rapport de 4,5: 1 avec les cellules cibles YAC-1 (18) et les cellules NK humaines tuaient mieux les cellules K562 à un rapport de 5: 1 ou 10:1 (12). Cependant, en utilisant une plus grande gamme de rapports effecteur / cible, nous montrons que la dégranulation à l’aide de cellules LAK de rat était plus efficacement induite lors de l’utilisation de quatre cibles ou plus par cellule effectrice. Cette différence dans le rapport effecteur/ cible optimal entre le rat et d’autres espèces pourrait être due au type de cellules cibles utilisées, car les titrages du rapport effecteur/ cible humain et souris dans les études susmentionnées utilisaient des cellules cibles provenant de la même espèce. Les cellules effectrices peuvent être plus sensibles aux cellules cibles de la même espèce et ont donc besoin de moins de cellules cibles pour être activées. La lignée cellulaire YAC-1 utilisée dans notre étude est un lymphome à lymphocytes T de souris, qui est la norme depuis de nombreuses années pour stimuler la cytotoxicité des cellules NK de rat. Nous ne pouvons exclure que l’utilisation d’une cellule cible de rat entraînerait une stimulation plus forte des cellules NK et, par la suite, moins de cellules cibles pourraient être nécessaires pour induire la dégranulation.
Il ressort également de cette étude que les rapports effecteur/cible utilisés pour les tests de cytotoxicité ne sont pas bien corrélés avec les rapports nécessaires pour mesurer la réponse optimale de dégranulation dans les cellules effectrices. Ce n’est pas surprenant car la lecture de ces deux tests est différente, la cytotoxicité mesurant la mort cellulaire cible et la dégranulation mesurant la réponse NK aux cibles.
En conclusion, nous avons soulevé un anticorps contre le rat CD107a (SIM1) et caractérisé sa capacité à détecter la dégranulation dans les lymphocytes cytotoxiques chez le rat. Nous avons montré que SIM1 est spécifique aux cellules dégranulatrices, et grâce à l’optimisation du protocole de dégranulation, nous avons déterminé que l’utilisation de rapports effecteurs: cellules cibles inférieurs à 1:4 assure une stimulation optimale des cellules LAK. Le développement de l’anti-rat CD107a (SIM1) permet une meilleure analyse et caractérisation des réponses cytotoxiques des lymphocytes de rat et sera un outil précieux dans les nombreux modèles de maladies du rat.
Déclaration d’éthique
L’étude est approuvée par la National Animal Research Authority (FDU), Norvège (numéro de permis: ID-1698).
Contributions de l’auteur
AS a été responsable de l’analyse d’expression, des tests fonctionnels et de la rédaction du manuscrit. K-ZD a effectué le clonage d’ADNc et la génération de transfectants. JTV a participé à la planification et à la supervision du projet, ainsi qu’à la rédaction du manuscrit. LK a été responsable des vaccinations, de la technologie des hybridomes, de la rédaction du manuscrit et de la supervision du projet.
Déclaration sur les conflits d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Remerciements
Les auteurs remercient Ulla Heggelund et Stine Martinsen pour leur assistance technique en laboratoire, ainsi que le personnel de l’animalerie du Département de médecine comparée du Rikshospitalet, Hôpital universitaire d’Oslo, pour leur aide en matière de vaccination. Merci à Marit Inngjerdingen pour les discussions scientifiques.
Financement
La recherche a été financée par l’Université d’Oslo, la Santé régionale du Sud-Est de la Norvège (2009104), et Legatet til Henrik Homans Minde.
1. Orange JS. Formation et fonction de la synapse immunologique des cellules NK lytiques. Nat Rev Immunol (2008) 8(9):713-25. doi:10.1038/nri2381
Résumé publié/Texte intégral croisé/Google Scholar
2. Metkar SS, Marchioretto M, Antonini V, Lunelli L, Wang B, Gilbert RJ, et al. Perforin oligomers form arcs in cellular membranes: a locus for intracellular delivery of granzymes. Cell Death Differ (2015) 22(1):74–85. doi:10.1038/cdd.2014.110
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Masson D, Tschopp J. Isolation of a lytic, pore-forming protein (perforin) from cytolytic T-lymphocytes. J Biol Chem (1985) 260(16):9069–72.
PubMed Abstract | Google Scholar
4. Thiery J, Keefe D, Boulant S, Boucrot E, Walch M, Martinvalet D, et al. Les pores de la perforine dans la membrane endosomale déclenchent la libération de granzyme B endocyté dans le cytosol des cellules cibles. Nat Immunol (2011) 12(8):770-7. doi: 10.1038/ni.2050
Résumé publié|Texte intégral croisé|Google Scholar
5. Voskoboinik I, Whisstock JC, Trapani JA. Perforine et granzymes: fonction, dysfonctionnement et pathologie humaine. Nat Rev Immunol (2015) 15(6):388-400. doi: 10.1038/nri3839
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Chowdhury D, Lieberman J. Death by a thousand cuts: granzyme pathways of programmed cell death. Annu Rev Immunol (2008) 26:389–420. doi:10.1146/annurev.immunol.26.021607.090404
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Lopez JA, Brennan AJ, Whisstock JC, Voskoboinik I, Trapani JA. Protecting a serial killer: pathways for perforin trafficking and self-defence ensure sequential target cell death. Trends Immunol (2012) 33(8):406–12. doi:10.1016/j.it.2012.04.001
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Peters PJ, Borst J, Oorschot V, Fukuda M, Krahenbuhl O, Tschopp J, et al. Cytotoxic T lymphocyte granules are secretory lysosomes, containing both perforin and granzymes. J Exp Med (1991) 173(5):1099–109. doi:10.1084/jem.173.5.1099
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Betts MR, Brenchley JM, Price DA, De Rosa SC, Douek DC, Roederer M, et al. Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation. J Immunol Methods (2003) 281(1–2):65–78. doi:10.1016/S0022-1759(03)00265-5
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Krzewski K, Gil-Krzewska A, Nguyen V, Peruzzi G, Coligan JE. LAMP1/CD107a is required for efficient perforin delivery to lytic granules and NK-cell cytotoxicity. Blood (2013) 121(23):4672–83. doi:10.1182/blood-2012-08-453738
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Cohnen A, Chiang SC, Stojanovic A, Schmidt H, Claus M, Saftig P, et al. Surface CD107a/LAMP-1 protects natural killer cells from degranulation-associated damage. Blood (2013) 122(8):1411–8. doi:10.1182/blood-2012-07-441832
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Alter G, Malenfant JM, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity. J Immunol Methods (2004) 294(1–2):15–22. doi:10.1016/j.jim.2004.08.008
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Nestvold JM, Omdal BK, Dai KZ, Martens A, Benestad HB, Vaage JT, et al. Une deuxième transplantation prophylactique de moelle osseuse non appariée au CMH protège contre la leucémie myéloïde aiguë (BNML) du rat sans maladie mortelle du greffon contre l’hôte. Transplantation (2008) 85(1):102-11. doi:10.1097/01.tp.0000296856.53493.1 f
Résumé publié |Texte intégral croisé|Google Scholar
14. Onishi M, Kinoshita S, Morikawa Y, Shibuya A, Phillips J, Lanier LL, et al. Applications du clonage d’expression à médiation rétrovirale. Exp Hematol (1996) 24(2):324–9.
PubMed Abstract | Google Scholar
15. Sanderson S, Shastri N. LacZ inducible, antigen/MHC-specific T cell hybrids. Int Immunol (1994) 6(3):369–76. doi:10.1093/intimm/6.3.369
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Murugin VV, Zuikova IN, Murugina NE, Shulzhenko AE, Pinegin BV, Pashenkov MV. Dégranulation réduite des cellules NK chez les patients présentant un herpès fréquemment récurrent. Vaccin Clin Immunol (2011) 18(9):1410-5. doi: 10.1128 / CVI.05084-11
Résumé publié/Texte intégral croisé/Google Scholar
17. Bryceson YT, Fauriat C, Nunes JM, Wood SM, Björkström NK, Long EO, et al. Analyse fonctionnelle des cellules NK humaines par cytométrie en flux. Méthodes Mol Biol (2010) 612:335-52. doi: 10.1007/978-1-60761-362-6_23
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Vahlne G, Becker S, Brodin P, Johansson MH. IFN-gamma production and degranulation are differentially regulated in response to stimulation in murine natural killer cells. Scand J Immunol (2008) 67(1):1–11. doi:10.1111/j.1365-3083.2007.02026.x
PubMed Abstract | CrossRef Full Text | Google Scholar
