
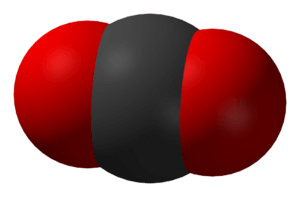
Le dioxyde de carbone (CO2) est un composé chimique. C’est un gaz à température ambiante. Il est composé d’un atome de carbone et de deux atomes d’oxygène. Les personnes et les animaux libèrent du dioxyde de carbone lorsqu’ils expirent. De plus, chaque fois que quelque chose d’organique est brûlé (ou qu’un feu est allumé), il produit du dioxyde de carbone. Les plantes utilisent du dioxyde de carbone pour fabriquer des aliments. Ce processus s’appelle la photosynthèse. Les propriétés du dioxyde de carbone ont été étudiées par le scientifique écossais Joseph Black dans les années 1750.
Le dioxyde de carbone est un gaz à effet de serre. Les gaz à effet de serre emprisonnent l’énergie thermique. Les gaz à effet de serre modifient le climat et la météo sur notre planète, la Terre. C’est ce qu’on appelle le changement climatique. Les gaz à effet de serre sont une cause du réchauffement climatique, de l’augmentation de la température de surface de la Terre.
Rôle biologique
Le dioxyde de carbone est un produit final des organismes qui obtiennent de l’énergie en décomposant les sucres, les graisses et les acides aminés avec de l’oxygène dans le cadre de leur métabolisme. C’est un processus connu sous le nom de respiration cellulaire. Cela inclut toutes les plantes, les animaux, de nombreux champignons et certaines bactéries. Chez les animaux supérieurs, le dioxyde de carbone se déplace dans le sang des tissus du corps vers les poumons où il est expiré. Les plantes absorbent le dioxyde de carbone de l’atmosphère pour l’utiliser dans la photosynthèse.
Glace carbonique
La glace carbonique, ou dioxyde de carbone solide, est l’état solide du gaz CO2 en dessous de -109,3 °F (-78,5 °C). La glace carbonique ne se produit pas naturellement sur terre mais est fabriquée par l’homme. Il est incolore. Les gens utilisent de la glace carbonique pour rendre les choses froides et pour rendre les boissons pétillantes, tuer les gophers et congeler les verrues. La vapeur de glace carbonique provoque l’étouffement et éventuellement la mort. La prudence et l’assistance professionnelle sont recommandées chaque fois que de la glace carbonique est utilisée.

À la pression habituelle, elle ne fond pas d’un solide à un liquide mais passe directement d’un solide à un gaz. C’est ce qu’on appelle la sublimation. Il passera directement d’un solide à un gaz à n’importe quelle température supérieure à des températures extrêmement froides. La glace carbonique se sublime à température normale de l’air. La glace carbonique exposée à l’air normal dégage du gaz carbonique qui n’a pas de couleur. Le dioxyde de carbone peut être liquéfié à une pression supérieure à 5,1 atmosphères.
Le gaz carbonique qui se dégage de la glace carbonique est si froid que lorsqu’il se mélange à l’air, il refroidit la vapeur d’eau dans l’air en buée, ce qui ressemble à une épaisse fumée blanche. Il est souvent utilisé au théâtre pour créer l’apparence de brouillard ou de fumée.
Isolation et production
Les chimistes peuvent obtenir du dioxyde de carbone à partir de l’air de refroidissement. Ils appellent cela la distillation de l’air. Cette méthode est inefficace car une grande quantité d’air doit être réfrigérée pour extraire une petite quantité de CO2. Les chimistes peuvent également utiliser plusieurs réactions chimiques différentes pour séparer le dioxyde de carbone. Le dioxyde de carbone est produit dans les réactions entre la plupart des acides et la plupart des carbonates métalliques. Par exemple, la réaction entre l’acide chlorhydrique et le carbonate de calcium (calcaire ou craie) produit du dioxyde de carbone :
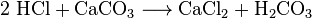
L’acide carbonique (H2CO3) se décompose ensuite en eau et en CO2. De telles réactions provoquent une formation de mousse ou de bulles, ou les deux. Dans l’industrie, de telles réactions sont utilisées à plusieurs reprises pour neutraliser les flux acides résiduaires.
La chaux vive (CaO), un produit chimique largement utilisé, peut être fabriquée en calcaire chauffant à environ 850 ° C. Cette réaction produit également du CO2:
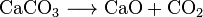
Le dioxyde de carbone est également produit dans la combustion de tous les combustibles contenant du carbone, tels que le méthane (gaz naturel), les distillats de pétrole (essence, diesel, kérosène, propane), le charbon ou le bois. Dans la plupart des cas, de l’eau est également libérée. Par exemple, la réaction chimique entre le méthane et l’oxygène est la suivante:
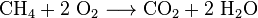
Le dioxyde de carbone est fabriqué dans des aciéries. Le fer est réduit de ses oxydes avec du coke dans un haut fourneau, produisant de la fonte brute et du dioxyde de carbone:

La levure métabolise le sucre pour produire du dioxyde de carbone et de l’éthanol, également appelé alcool, dans la production de vins, de bières et d’autres spiritueux, mais aussi dans la production de bioéthanol:
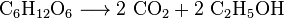
Tous les organismes aérobies produisent du CO2 lorsqu’ils oxydent les glucides, les acides gras et les protéines dans les mitochondries des cellules. Le grand nombre de réactions impliquées sont extrêmement complexes et ne sont pas décrites facilement. (Ils comprennent la respiration cellulaire, la respiration anaérobie et la photosynthèse). Les photoautotrophes (plantes, cyanobactéries) utilisent une autre réaction: les plantes absorbent le CO2 de l’air et, avec l’eau, le réagissent pour former des hydrates de carbone:
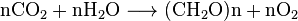
Le dioxyde de carbone est soluble dans l’eau, dans lequel il interagit spontanément entre le CO2 et H2CO3 (acide carbonique). Les concentrations relatives de CO2, H2CO3 et des formes déprotonées HCO−
3 (bicarbonate) et CO2−
3 (carbonate) dépendent de l’acidité (pH). Dans l’eau neutre ou légèrement alcaline (pH > 6,5), la forme bicarbonate prédomine (> 50%) devenant la plus répandue (> 95%) au pH de l’eau de mer, tandis que dans l’eau très alcaline (pH> 10.4) la forme prédominante (> 50%) est le carbonate. Les formes bicarbonate et carbonate sont très solubles. Ainsi, l’eau de mer équilibrée dans l’air (légèrement alcaline avec un pH typique = 8,2-8,5) contient environ 120 mg de bicarbonate par litre.
Production industrielle
Le dioxyde de carbone industriel est produit principalement à partir de six procédés:
- En capturant des sources naturelles de dioxyde de carbone où il est produit par l’action de l’eau acidifiée sur le calcaire ou la dolomie.
- En tant que sous-produit des usines de production d’hydrogène, où le méthane est converti en CO2;
- À partir de la combustion de combustibles fossiles ou de bois;
- Comme sous-produit de la fermentation du sucre dans le brassage de la bière, du whisky et d’autres boissons alcoolisées;
- De la décomposition thermique du calcaire, CaCO3, dans la fabrication de la chaux (oxyde de calcium, CaO);
Réaction chimique
Le dioxyde de carbone peut être créé avec une simple réaction chimique:
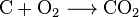 carbon + oxygen → carbon dioxide
carbon + oxygen → carbon dioxide
Images for kids
-

Crystal structure of dry ice
-

Pellets of « dry ice », a common form of solid carbon dioxide
-

Carbon dioxide bubbles in a soft drink.
-

Dry ice used to preserve grapes after harvest.
-

Use of a CO2 fire extinguisher.
-

A carbon dioxide laser.
-

CO2 in Earth’s atmosphere if half of global-warming emissions are not absorbed.(NASA computer simulation).
-

Coquille de ptérapodes dissoute dans l’eau de mer ajustée à une chimie de l’océan projetée pour l’année 2100.

Aperçu de la photosynthèse et de la respiration. Le dioxyde de carbone (à droite), avec l’eau, forme de l’oxygène et des composés organiques (à gauche) par photosynthèse, qui peuvent être respirés dans l’eau et (CO2).

Des niveaux croissants de CO2 menaçaient les astronautes d’Apollo 13 qui devaient adapter des cartouches du module de commande pour alimenter l’épurateur de dioxyde de carbone dans le module lunaire, qu’ils utilisaient comme canot de sauvetage.

CO2 concentration meter using a nondispersive infrared sensor
