Introduction de l’inhibiteur du cycle cellulaire
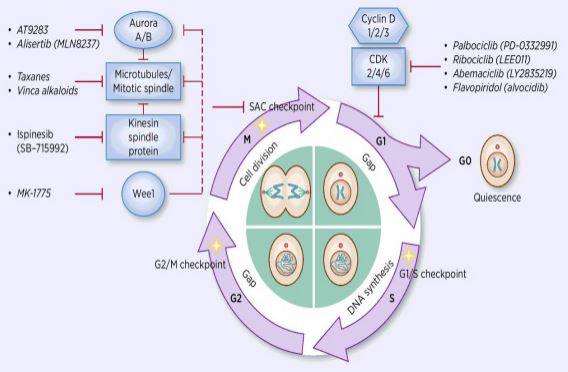
Le processus de régulation du cycle cellulaire consiste en l’activation ou l’inactivation de divers facteurs de régulation sous la surveillance de points de contrôle, initiant ainsi le processus de réplication de l’ADN cellulaire et de division en deux cellules filles. Parmi de nombreux régulateurs du cycle cellulaire, la kinase dépendante de la cycline (CDK) est au cœur, et c’est un système de réseau qui régule le cycle cellulaire avec des inhibiteurs de la cycline et de la kinase dépendante de la cycline (ICC). Les CDK sont une classe de sérine / thréonine kinases, et actuellement, 13 espèces sont trouvées, y compris CDK1 ~ 13, qui jouent un rôle dans la régulation du cycle cellulaire des CDK et la régulation transcriptionnelle des CDK. La régulation du cycle cellulaire est en fait la régulation des points de contrôle, les points de régulation G1/S étant les plus importants. Lorsque le cycle cellulaire est stimulé par des signaux externes tels que des facteurs de croissance, la sous-unité catalytique CDK4 / CDK6 se lie à la sous-unité régulatrice CyclinD, et les résidus CDKs sont activés par phosphorylation / déphosphorylation. Après activation des CDK, la protéine Rb est phosphorylée. Le gène rb, également connu sous le nom de gène du rétinoblastome, est le premier gène suppresseur de tumeur cloné et sa capacité à former un complexe avec des facteurs de transcription (tels que E2F) après la perte de la phosphorylation de la protéine. L’E2F joue un rôle important dans la régulation du cycle cellulaire et induit l’expression de la CyclinE et du CDK2 et forme un complexe CyclinE / CDK2, qui phosphorylera davantage la protéine Rb et libérera complètement l’E2F. Par la suite, l’E2F pénètre dans le noyau pour activer une série de cycles cellulaires en phase S. Dans la phase tardive de la réplication de l’ADN pendant la phase S, CDK2 est activé par la cyclinE, qui inactive le facteur de transcription E2F dans le temps, empêchant l’apoptose causée par l’E2F activé de manière persistante. Les statistiques de recherche montrent que plus de 90% des cancers humains présentent des mutations dans des gènes apparentés dans les voies CDK, Cycline, CKI et Rb, la CDK et sa sous-unité de régulation correspondante étant la cycline la plus fréquemment dysfonctionnelle. De plus, les fluctuations du cycle cellulaire favorisent la résistance à la chimiothérapie et réduisent les effets de la chimiothérapie. Par conséquent, la régulation de l’activité CDK / Cycline, qui restaure le cycle cellulaire normal, est l’une des stratégies de traitement des tumeurs.
Les inhibiteurs du cycle cellulaire sont maintenant utilisés cliniquement
Les chercheurs se sont concentrés sur la recherche de différents types d’inhibiteurs de CDK et de cyclines comme médicaments anticancéreux de pointe. Actuellement, les inhibiteurs de CDK sont principalement divisés en endogènes et exogènes. La plus grande classe d’inhibiteurs de petites molécules endogènes est les protéines de faible poids moléculaire, qui sont classées en deux grandes catégories en fonction des différences de fonctions structurelles, et une classe est appelée la double famille spécifique INK4, y compris p15, p16, p18, p19, qui inhibe la famille de protéines. La protéine dépendante inhibitrice de la kinase associée à CyclinD se lie au CDK4 libre correspondant, bloquant ainsi la liaison de CDK4 au cyclinD correspondant pour former un complexe dimère catalytique. L’autre classe s’appelle la famille Kip, y compris P21, P27, P57. Cette famille de protéines peut former un trimère avec un complexe dimérique composé de cycline E/CDK2 et de cyclinE/CDK1, en bloquant le centre catalytiquement actif du dimère. L’inhibition de ces inhibiteurs endogènes, lorsqu’elle est associée au complexe kinase, régule spécifiquement son activité, régulant ainsi précisément la transformation de la cellule de la phase G1 en phase S. Des études ont montré que l’apparition et le développement de tumeurs multiples sont associés à une diminution de l’expression des CDK / cyclines ou à une diminution de l’expression d’inhibiteurs endogènes, tels que la délétion de P16, qui a une relation avec le développement du mélanome, du cancer du poumon, du cancer du sein et du cancer colorectal. La délétion de la protéine P27 est fréquente dans le cancer du sein, le cancer de la prostate, le cancer du côlon et le cancer gastro-intestinal. Par conséquent, la délétion d’un inhibiteur endogène de CDKs ou d’une mutation génétique est une référence importante pour le diagnostic tumoral. Les inhibiteurs de petites molécules endogènes constituent également une classe d’ARN non codants importants découverts ces dernières années. Les régions du site cible se lient les unes aux autres pour dégrader rapidement et efficacement l’ARNm ou inhiber la traduction de la protéine, contrôlant la protéine à un niveau inférieur ou optimal et nécessitant des activités vitales. Plus de 10 microARN ont été découverts impliqués dans la régulation du cycle cellulaire. Parmi eux, miR1-2 et miR3-4 ciblent CDK4, respectivement, et le cycle cellulaire est arrêté dans la phase G1, ce qui inhibe la prolifération des cellules tumorales; miR-22 cible les cellules CDK6. Le cycle stagne dans la phase G1, ce qui induit une sénescence dans les cellules cancéreuses du sein. Dans différents processus biologiques, ces MIARN régulent la progression du cycle cellulaire en ciblant E2F, CDK, Cycline, P21, P27, ADN polymérase alpha, etc. favoriser ou bloquer les régulateurs clés du cycle cellulaire. Les inhibiteurs exogènes comprennent les acides nucléiques antisens, les anticorps, les petites interférences d’ARN interférant (ARNSI) et les composés à petites molécules. Les composés à petites molécules constituent la classe la plus importante d’inhibiteurs exogènes de CDK. Ces dernières années, alors que la compréhension de la structure cristalline permet aux gens de mener des études de simulation moléculaire, des percées ont été faites dans la conception et le développement d’études hautement efficaces et sélectives sur les inhibiteurs chimiques des CDK. On peut dire que de tels composés ont de nouveaux membres chaque jour. À l’heure actuelle, les inhibiteurs de la CDK à petites molécules peuvent être divisés en 13 catégories suivantes: Roscovitine et Olomouc, Pyrimidines (PD-033299), Flavonoïdes (Flavopiridols), Thiazoles (SNS03), anthracène et ses dérivés (SU951), pipéridone (Paullones), imidazopyridine, pyrazolopyridine (AZ703), pyrazines (AT751), butyrolactone – 1 (butyrolactone-1), scorpionine (UCN-01) et deux autres espèces. Treize inhibiteurs de petites molécules sont entrés dans des essais cliniques. Ce sont tous des produits chimiques à petites molécules d’hétérocycles planes qui rivalisent avec l’ATP pour se lier au site de liaison de l’ATP de la kinase CDK. Des expériences in vivo ont montré que CYC202 présente une bonne résistance aux médicaments et une bonne activité physiologique orale et a des effets inhibiteurs évidents sur les tumeurs solides chez des souris nues inoculées par le cancer du côlon humain et des cellules cancéreuses utérines. Dans les études de phase Ib, 10 patients atteints de cancers de l’ovaire prenaient CYC pendant plus de 20 mois, sans augmentation des tumeurs ni effets secondaires graves liés au traitement, parmi lesquels la tumeur d’un patient a diminué de plus de 30%, et certains patients traités depuis plus d’un an ont un état stable. Les études cliniques de phase II ont montré que CYC202 seul a un effet légèrement plus faible et est efficace en association avec d’autres médicaments chimiothérapeutiques. Des essais cliniques de phase IIb de CYC202 en association avec la capécitabine pour le traitement du cancer du sein, associés à la 2,2-difluorodésoxycytidine ou au cisplatine pour le traitement du cancer du poumon et du carcinome nasopharyngé sont également en cours. Le développement et l’application de la technologie d’interférence par ARN à petites molécules ont permis d’étudier l’expression génique de molécules cibles d’intervention spécifiques, et de nombreux scientifiques ont commencé à intervenir dans la synthèse de CDK / Cycline au niveau génétique. Limaet al. l’ARNsi ciblant la CyclinE transfectée en Hep3B, HepG2, SNU449 (surexpression de la CyclinE) et HuH7 (surexprimée de la CyclinE) a révélé que l’expression de la CyclinE était réduite de 90% dans les cellules. La synthèse de l’ADN est considérablement réduite et les cellules subissent une apoptose. Galimberti et coll. l’ARNsi transfecté ciblant la CyclinE, CDK2 et CDK1 dans les cellules cancéreuses du poumon de souris HOP-62, H-522 et H-23, respectivement, et a révélé que la CyclinE / CDK2 peut induire l’apoptose et inhiber la prolifération des cellules cancéreuses du poumon. La diminution de l’expression de CDK1 causée par l’interférence de l’ARNsi CDK1 ne provoque que l’arrêt de la phase cellulaire et ralentit la prolifération cellulaire; tandis que la co-interférence de l’ARNsi CDK1 et CDK2 entraîne une diminution simultanée de l’expression de CDK1 et CDK2, provoquant une résistance dans les phases du cycle cellulaire S et G2 / M. La stagnation a également induit l’apoptose des cellules. Cao Yinfang et d’autres transfections réussies du vecteur d’expression recombinant de l’ARNsi CDK2 / CyclinE dans les cellules HepG2 ont montré que l’expression de l’ARNm CDK2 et de la CyclinE diminuait de manière significative, que le cycle cellulaire était arrêté en phase S, que les cellules de la phase G1 augmentaient de manière significative, que l’activité de la caspase-3 était améliorée, que les cellules HepG2 subissaient une apoptose et que les changements du cycle cellulaire étaient compatibles avec une diminution de la prolifération des cellules hepg2sin vitro après transfection.
Fonction de l’inhibiteur du cycle cellulaire
Avec l’approfondissement de la compréhension du rôle important de la régulation du cycle cellulaire dans la formation de tumeurs et l’apoptose, la régulation du cycle cellulaire a été étudiée plus avant dans la résistance à la chimiothérapie tumorale. Les kinases dépendantes des cyclines (Cdk), qui jouent un rôle dans le moteur cellulaire au cours du cycle cellulaire, sont des cibles idéales pour la thérapie tumorale. La plupart des cellules cancéreuses ont une activation, une surexpression du gène du cycle de division cellulaire (cdk) et des défauts de la fonction des CDKIs. L’inhibiteur de CDK exerce une action de rupture qui inhibe le cycle cellulaire. Ces dernières années, les ICDC sont devenues un point culminant majeur de la thérapie contre le cancer, qui inhibe l’activité des ICDC dans le cycle cellulaire. Une série d’études cliniques ont également montré qu’une seule application peut avoir des effets modérés. Cependant, en combinaison avec des médicaments chimiothérapeutiques cytotoxiques traditionnels, les ICDC peuvent améliorer de manière significative l’effet antitumoral des médicaments chimiothérapeutiques traditionnels. Par conséquent, la recherche sur les effets anticancéreux des médicaments CDKIs et d’autres médicaments chimiothérapeutiques est devenue un point chaud dans le traitement actuel de la résistance tumorale.
Référence
- Bendris N, Lemmers B, Blanchard J M. Cycle cellulaire, dynamique du cytosquelette et au-delà: les nombreuses fonctions des cyclines et des inhibiteurs de CDK. Cycle cellulaire. 2015, 14(12):1786-1798.
- Pitts T M, Davis S L, Eckhardt S G, et al. Ciblage des kinases nucléaires dans le cancer: développement d’inhibiteurs de kinases du cycle cellulaire. Pharmacologie & Thérapeutique. 2014, 142(2):258-269.
- Stone A, Sutherland R L, Musgrove E A. Inhibiteurs des kinases du cycle cellulaire: progrès récents et perspectives d’avenir en tant que thérapies anticancéreuses. Crit Rev Oncog. 2012, 17(2):175-198.
- Xu W, Mcarthur G. Régulation du cycle cellulaire et mélanome. Rapports Actuels sur l’oncologie. 2016, 18(6):34.
- Malumbres M, Barbacid M. Cycle cellulaire, CDKs et cancer: un paradigme en évolution. La nature Examine le cancer. 2009, 9(3):153-166.
