Électronégativité et polarité des liaisons
Bien que nous ayons défini la liaison covalente comme un partage d’électrons, les électrons d’une liaison covalente ne sont pas toujours partagés également par les deux atomes liés. À moins que la liaison ne relie deux atomes du même élément, il y aura toujours un atome qui attire les électrons dans la liaison plus fortement que l’autre atome, comme le montre la figure 4.3 « Liaisons covalentes polaires contre Non polaires ». Lorsqu’un tel déséquilibre se produit, il en résulte une accumulation d’une charge négative (appelée charge négative partielle et désignée δ-) d’un côté de la liaison et d’une charge positive (désignée δ +) de l’autre côté de la liaison. Une liaison covalente qui a un partage inégal d’électrons, comme dans la partie (b) de la Figure 4.3 « Liaisons covalentes polaires versus Non polaires », est appelée liaison covalente polaireune liaison covalente avec une distribution d’électrons déséquilibrée à travers la liaison.. Une liaison covalente qui a un partage égal d’électrons (partie (a) de la figure 4.3 « Liaisons covalentes polaires versus Non polaires ») est appelée liaison covalente non polaireune liaison covalente avec une distribution d’électrons équilibrée à travers la liaison..
Figure 4.3 Liaisons covalentes polaires versus non polaires
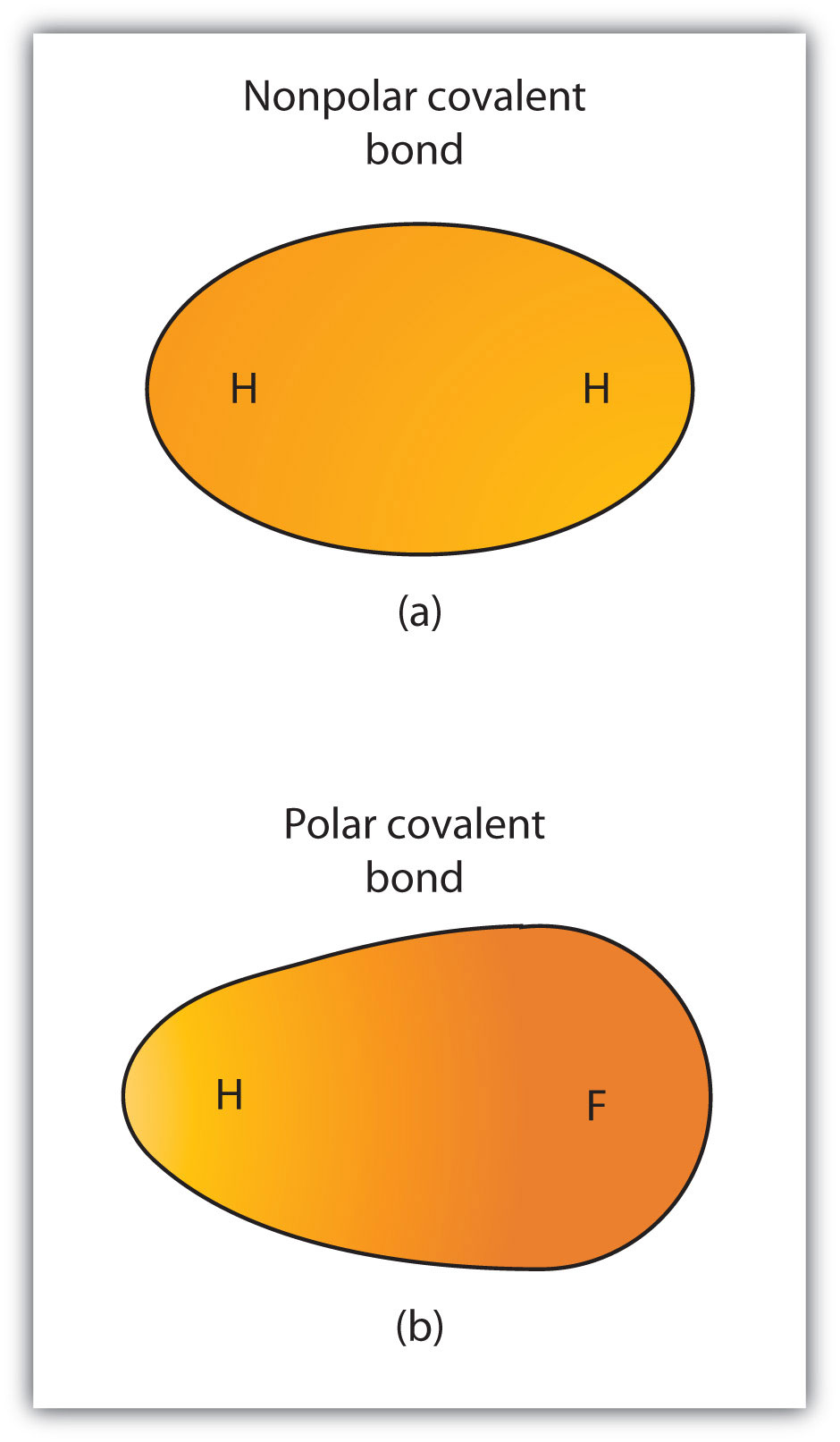
(a)Les électrons de la liaison covalente sont également partagés par les deux atomes d’hydrogène. Il s’agit d’une liaison covalente non polaire. (b) L’atome de fluor attire les électrons dans la liaison plus que l’atome d’hydrogène, ce qui entraîne un déséquilibre dans la distribution des électrons. C’est une liaison covalente polaire.
Toute liaison covalente entre des atomes de différents éléments est une liaison polaire, mais le degré de polarité varie considérablement. Certaines liaisons entre différents éléments ne sont que peu polaires, tandis que d’autres sont fortement polaires. Les liaisons ioniques peuvent être considérées comme la polarité ultime, les électrons étant transférés plutôt que partagés. Pour juger de la polarité relative d’une liaison covalente, les chimistes utilisent l’électronégativitéune mesure relative de la force avec laquelle un atome attire les électrons lorsqu’il forme une liaison covalente., qui est une mesure relative de la force avec laquelle un atome attire les électrons lorsqu’il forme une liaison covalente. Il existe différentes échelles numériques pour évaluer l’électronégativité. La figure 4.4 « Électronégativités de divers éléments » montre l’une des plus populaires — l’échelle de Pauling. La polarité d’une liaison covalente peut être jugée en déterminant la différence des électronégativités des deux atomes faisant la liaison. Plus la différence d’électronégativités est grande, plus le déséquilibre du partage d’électrons dans la liaison est important. Bien qu’il n’y ait pas de règles strictes, la règle générale est que si la différence d’électronégativités est inférieure à environ 0,4, la liaison est considérée comme non polaire; si la différence est supérieure à 0,4, la liaison est considérée comme polaire. Si la différence d’électronégativités est suffisamment importante (généralement supérieure à environ 1,8), le composé résultant est considéré comme ionique plutôt que covalent. Une différence d’électronégativité nulle, bien sûr, indique une liaison covalente non polaire.
Figure 4.4 Électronégativités de divers éléments
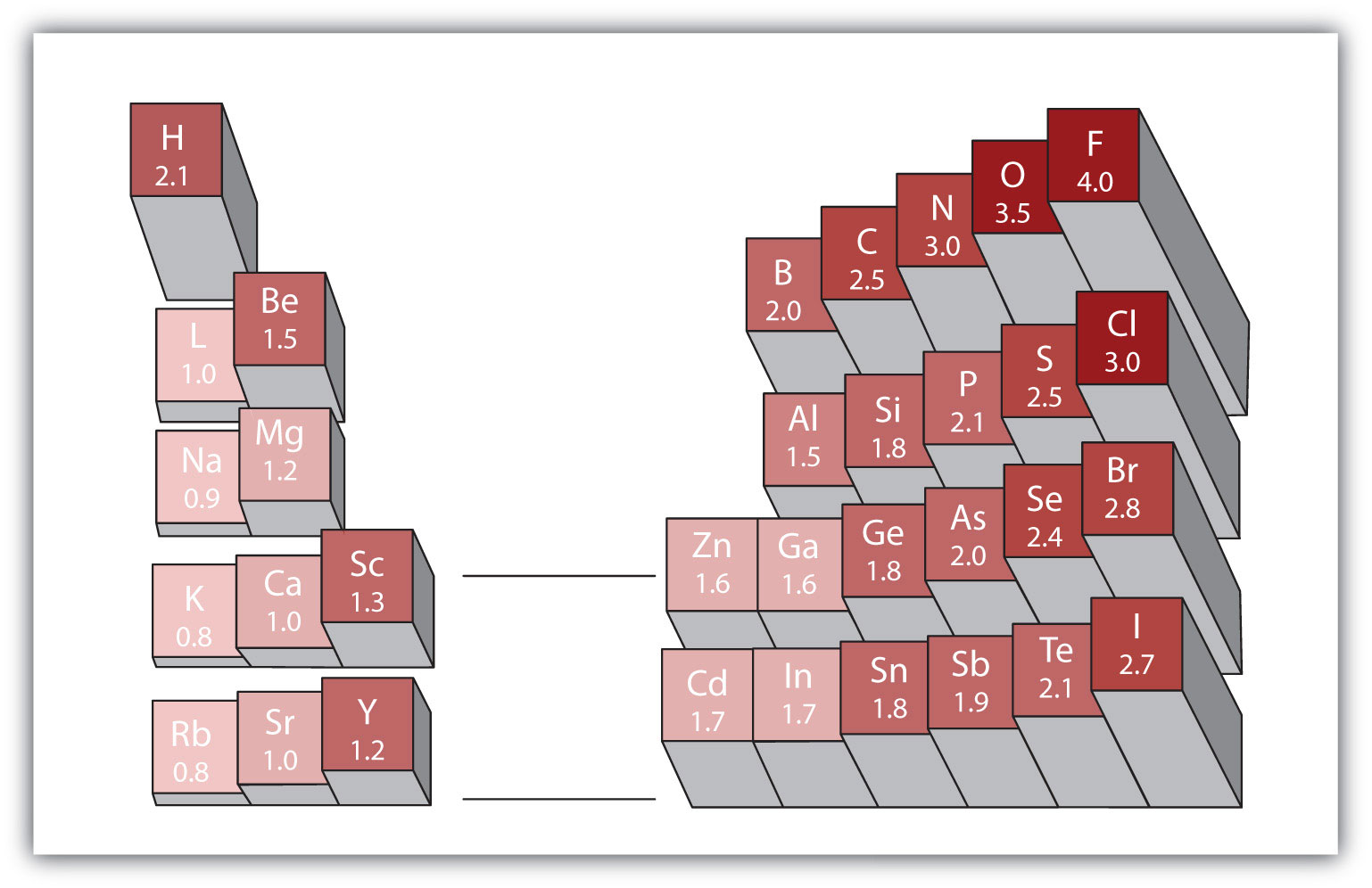
Une échelle populaire pour les électronégativités a la valeur pour les atomes de fluor fixée à 4,0, la valeur la plus élevée.
En regardant de plus près: Linus Pauling
Sans doute le chimiste le plus influent du XXe siècle, Linus Pauling (1901-94) est la seule personne à avoir remporté deux prix Nobel individuels (c’est-à-dire non partagés). Dans les années 1930, Pauling a utilisé de nouvelles théories mathématiques pour énoncer certains principes fondamentaux de la liaison chimique. Son livre de 1939 The Nature of the Chemical Bond est l’un des livres les plus importants jamais publiés en chimie.
En 1935, Pauling s’intéresse aux molécules biologiques et il reçoit le prix Nobel de chimie en 1954 pour ses travaux sur la structure des protéines. (Il était très proche de découvrir la structure en double hélice de l’ADN lorsque James Watson et James Crick ont annoncé leur propre découverte de sa structure en 1953.) Il a ensuite reçu le prix Nobel de la paix en 1962 pour ses efforts visant à interdire les essais d’armes nucléaires.
Dans ses dernières années, Pauling est devenu convaincu que de fortes doses de vitamine C préviendraient les maladies, y compris le rhume. La plupart des recherches cliniques n’ont pas montré de lien, mais Pauling a continué à prendre de fortes doses quotidiennement. Il est décédé en 1994, après avoir passé toute sa vie à établir un héritage scientifique que peu d’hommes auront jamais égalé.

Linus Pauling était l’un des chimistes les plus influents du XXe siècle.
Exemple 6
Décrire la différence d’électronégativité entre chaque paire d’atomes et la polarité résultante (ou type de liaison).
- C et H
- H et H
- Na et Cl
- O et H
La solution
- Le carbone a une électronégativité de 2,5, tandis que la valeur pour l’hydrogène est de 2,1. La différence est de 0,3, ce qui est plutôt faible. La liaison C-H est donc considérée comme non polaire.
- Les deux atomes d’hydrogène ont la même valeur d’électronégativité – 2,1. La différence est nulle, donc la liaison est non polaire.
- L’électronégativité du sodium est de 0,9, tandis que celle du chlore est de 3,0. La différence est de 2,1, ce qui est assez élevé, et le sodium et le chlore forment donc un composé ionique.
- Avec 2,1 pour l’hydrogène et 3,5 pour l’oxygène, la différence d’électronégativité est de 1,4. On s’attendrait à une liaison très polaire, mais pas si polaire que la liaison O–H soit considérée comme ionique.
Exercice de renforcement des compétences
-
C et O
-
K et Br
-
N et N
-
Cs et F
Décrivez la différence d’électronégativité entre chaque paire d’atomes et la polarité (ou le type de liaison) qui en résulte.
Lorsque les liaisons d’une molécule sont polaire, la molécule dans son ensemble peut afficher une répartition inégale de la charge, en fonction de l’orientation des liaisons individuelles. Par exemple, l’orientation des deux liaisons O–H dans une molécule d’eau (Figure 4.5 « Propriétés physiques et polarité ») est pliée: une extrémité de la molécule a une charge positive partielle et l’autre extrémité une charge négative partielle. En bref, la molécule elle-même est polaire. La polarité de l’eau a un impact énorme sur ses propriétés physiques et chimiques. (Par exemple, le point d’ébullition de l’eau est élevé pour une si petite molécule et est dû au fait que les molécules polaires s’attirent fortement.) En revanche, alors que les deux liaisons C = O dans le dioxyde de carbone sont polaires, elles se trouvent directement en face l’une de l’autre et annulent ainsi les effets de l’autre. Ainsi, les molécules de dioxyde de carbone sont globalement apolaires. Ce manque de polarité influence certaines propriétés du dioxyde de carbone. (Par exemple, le dioxyde de carbone devient un gaz à -77 ° C, soit près de 200 ° de moins que la température à laquelle l’eau bout.)
Figure 4.5 Propriétés physiques et polarité

Les propriétés physiques de l’eau et du dioxyde de carbone sont affectées par leurs polarités.
Exercices de revue de concept
-
Quel est le nom de la distance entre deux atomes dans une liaison covalente?
-
Qu’indique l’électronégativité d’un atome ?
-
Quel type de liaison se forme entre deux atomes si la différence d’électronégativités est faible? Moyen ? Grand?
Réponses
-
longueur de liaison
-
L’électronégativité est une mesure qualitative de la quantité d’électrons qu’un atome attire dans une liaison covalente.
-
non polaire; polaire; ionique
Principaux points à retenir
- Les liaisons covalentes entre différents atomes ont des longueurs de liaison différentes.
- Les liaisons covalentes peuvent être polaires ou non polaires, selon la différence d’électronégativité entre les atomes impliqués.
Exercices
-
Qui est plus long – une liaison C-H ou une liaison C–O? (Voir le Tableau 4.2 » Longueurs approximatives de certaines Liaisons simples « .)
-
Qui est plus court – une liaison N-H ou une liaison C–H? (Voir le Tableau 4.2 » Longueurs approximatives de certaines Liaisons simples « .)
-
Un nanomètre est de 10 à 9 m. En utilisant les données du Tableau 4.2 « Longueurs de liaison approximatives de Certaines Liaisons simples » et du Tableau 4.3 « Comparaison des longueurs de liaison pour des liaisons simples et multiples », déterminez la longueur de chaque liaison en nanomètres.
- une liaison C–O
- une liaison C=O
- une liaison H–N
- une liaison C≡N
-
Un angstrom (Å) est défini comme étant de 10 à 10 m. En utilisant le Tableau 4.2 « Longueurs Approximatives de Certaines Liaisons simples » et le Tableau 4.3 « Comparaison des Longueurs de Liaisons pour des Liaisons simples et multiples », déterminez la longueur de chaque liaison en angstroms.
- une liaison C–C
- une liaison C =C
- une liaison N≡N
- une liaison H–O
-
Reportez-vous à l’exercice 3. Pourquoi l’unité nanométrique est-elle utile comme unité d’expression des longueurs de liaison ?
-
Reportez-vous à l’exercice 4. Pourquoi l’unité angstrom est-elle utile comme unité pour exprimer les longueurs de liaison?
-
En utilisant la figure 4.4 « Électronégativités de divers éléments », déterminez quel atome de chaque paire a l’électronégativité la plus élevée.
- H ou C
- O ou Br
- Na ou Rb
- I ou Cl
-
En utilisant la figure 4.4 « Électronégativités de divers éléments », déterminez quel atome de chaque paire a l’électronégativité inférieure.
- Mg ou O
- S ou F
- Al ou Ga
- O ou I
-
Les électrons seront-ils partagés de manière égale ou inégale entre chaque liaison covalente? Si inégalement, à quel atome les électrons sont-ils plus fortement attirés?
- une liaison C-O
- une liaison F-F
- une liaison S-N
- une liaison I-Cl
-
Les électrons seront-ils partagés de manière égale ou inégale entre chaque liaison covalente? Si inégalement, à quel atome les électrons sont-ils plus fortement attirés?
- une liaison C–C
- une liaison S-Cl
- une liaison O-H
- une liaison H–H
Réponses
-
Une liaison C–O est plus longue.
-
- 0,143 nm
- 0,120 nm
- 0,100 nm
- 0.116 nm
-
Les longueurs de liaison réelles sont très petites, de sorte que l’unité nanométrique rend l’expression de la longueur plus facile à comprendre.
-
- C
- O
- Na
- Cl
-
- inégalement vers le O
- également
- inégalement vers le N
- inégalement vers le Cl
