La première approche pour développer des antagonistes cannabinoïdes à la fin des années 1980 a été de modifier la structure du THC, mais les résultats ont été décevants. Au début des années 1990, une nouvelle famille d’agonistes cannabinoïdes a été découverte à partir du médicament AINS (anti-inflammatoire non stéroïdien) pravadoline, ce qui a conduit à la découverte d’antagonistes de l’aminoalkyl indole avec un succès limité. Comme la recherche basée sur la structure des agonistes était décevante, il n’était pas surprenant que le premier antagoniste cannabinoïde puissant et sélectif appartienne à une toute nouvelle famille chimique. En 1994, le premier antagoniste sélectif des cannabinoïdes, SR141716 (rimonabant), a été introduit par Sanofi appartenant à une famille de 1,5-diarylpyrazoles.
RimonabantEdit



Le rimonabant, également connu sous le nom systématique, est un antagoniste des récepteurs CB1 du 1,5-diarylpyrazole (Figure 2). Le rimonabant n’est pas seulement un ligand puissant et hautement sélectif du récepteur CB1, mais il est également actif par voie orale et antagonise la plupart des effets des agonistes cannabinoïdes, tels que le THC, in vitro et in vivo. Le rimonabant a montré une efficacité clinique claire pour le traitement de l’obésité.
BindingEdit
La liaison d’un ligand agoniste au récepteur CB1 provoque un changement conformationnel et conduit à l’état actif du récepteur qui est responsable de la transduction du signal. Cependant, il existe un mécanisme supplémentaire qui peut conduire à l’état actif en l’absence de ligand. Comme de nombreux autres RCPG, le récepteur CB1 affiche un haut niveau d’activité constitutive et peut ainsi adopter spontanément un état conformationnel actif en l’absence de liaison agoniste, conservant des niveaux basaux élevés de signalisation intracellulaire. Ceci peut s’expliquer par le modèle d’activation des récepteurs à deux états dans lequel les récepteurs sont en équilibre entre deux états, actif et inactif (R* et R). Un agoniste stabilisera l’état actif conduisant à l’activation, un antagoniste neutre se lie également aux états actif et inactif, tandis qu’un agoniste inverse stabilisera préférentiellement l’état inactif (Figure 3).
Il a été rapporté dans de nombreux cas que le rimonabant se comporte comme un agoniste inverse plutôt que comme un antagoniste neutre et il est probable qu’il se lie préférentiellement à l’état inactif du CB1, diminuant ainsi l’activation de la voie de signalisation. L’interaction de liaison clé est une liaison hydrogène formée entre le groupe carbonyle du rimonabant et le résidu Lys192 du récepteur CB1. Cette liaison stabilise le pont de sel Lys192-Asp366 de l’extrémité intracellulaire des hélices transmembranaires 3 et 6 (Figure 4). Ce pont de sel spécifique est présent à l’état inactif du récepteur mais absent à l’état actif.
À l’état inactif du rimonabant CB1 se lie dans la transmembranaire-3-4-5-6 microdomaine aromatique. La liaison du rimonabant implique des interactions d’empilement aromatiques directes entre son cycle 2,4-dichlorophényle et les résidus Trp279/Phe200/Trp356 d’une part et le cycle para-chlorophényle et les résidus Tyr275/Trp255/Phe278 d’autre part. Le fragment pipéridinyle lipophile s’insère bien dans une cavité formée par les résidus d’acides aminés Val196/Phe170/Leu387 et Met384 (Figure 4).
PharmacophoreEdit
La plupart des antagonistes du CB1 rapportés à ce jour sont des analogues proches ou des isostères du rimonabant. Un modèle général de pharmacophore agoniste inverse CB1 peut être extrait des caractéristiques communes de ces analogues, les diarylpyrazoles (Figure 4). Ce pharmacophore contient un noyau cyclique, C, (par exemple pyrazole dans le rimonabant) substitué par deux parties aromatiques, A et B. Une unité acceptrice de liaison hydrogène, D, relie C à une partie lipophile cyclique, E. Dans certains cas, l’unité E se connecte directement à C. Sur la figure 4, le rimonabant est utilisé à titre d’exemple. Le motif A représente un groupe 4-chlorophényle et le motif B un cycle 2,4-dichlorophényle. L’unité C est le cycle pyrazole central et l’unité D représente le groupe carbonyle qui sert d’accepteur de liaison hydrogène. L’unité E représente un fragment aminopipéridinyle lipophile.
Relations structure-activitémodifier
Une liaison optimale au récepteur CB1 nécessite un cycle phényle para-substitué en position 5 du pyrazole. Le 5-substituant du pyrazole est impliqué dans la reconnaissance et l’antagonisme des récepteurs. Le para-substituant du cycle phényle pourrait être le chlore, le brome ou l’iode, mais il a été montré qu’une chaîne alkyle pouvait également être tolérée. La numérotation du cycle pyrazole central est illustrée à la figure 2.
Un cycle phényle 2,4-dichloro-substitué en position pyrazole 1 est préféré pour l’affinité ainsi que pour l’activité. Il a été montré que des halogènes supplémentaires sur ce cycle phénylique diminuent l’affinité.
Il est également favorable d’avoir une substitution de cycle au niveau du groupe 3-carboxamide, comme le groupe 1-pipéridinyle dans le rimonabant. Le remplacement du substituant amino-pipéridinyle par des alkylamides, des éthers, des cétones, des alcools ou des alcanes a surtout entraîné une diminution de l’affinité. Le remplacement du pipéridinyle par un pentyle ou une chaîne heptyle confère aux composés des propriétés agonistiques. Sur la base de ces résultats, il a été conclu que la position 3 du pyrazole semble être impliquée dans l’agonisme, tandis que les positions 1, 4, 5 semblent être impliquées dans l’antagonisme.
La recherche a montré que l’absence d’oxygène carboxamide entraîne une diminution de l’affinité. De plus, la présence d’oxygène carboxamide contribue à conférer les propriétés agonistes inverses, alors que les analogues dépourvus de cet oxygène se révèlent être des antagonistes neutres. Ces résultats soutiennent l’hypothèse selon laquelle l’oxygène carboxamide forme une liaison hydrogène avec le résidu Lys192 au niveau du récepteur CB1.
Dérivés du diarylpyrazole
Des analogues du SR141716 (rimonabant) ont récemment été décrits par plusieurs groupes, conduisant à une bonne compréhension de la relation structure-activité (DAS) au sein de ce groupe chimique. Alors que la plupart des composés décrits sont moins puissants que SR141716, deux d’entre eux méritent d’être mentionnés, SR147778 et AM251, bien que les deux puissent également agir au niveau des récepteurs opioïdes mu.
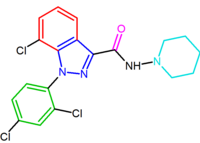
Le SR147778 (surinabant), un antagoniste de deuxième génération, a une durée d’action plus longue que le rimonabant et une activité orale accrue. Cette durée d’action accrue est probablement due à la présence du groupe éthyle le plus stable métaboliquement à la position 4 de son cycle pyrazole. Un autre changement est le remplacement du substituant chlore 5-phényle par du brome.
Le dérivé du diarylpyrazole, AM251, a été décrit où le substituant chlore a été remplacé par de l’iode en position para du cycle 5-phényle. Ce dérivé semblait être plus puissant et sélectif que le rimonabant.
21 analogues possédant soit un amide d’alkyle, soit un hydrazide d’alkyle de longueurs variant en position 3 ont été synthétisés. Il a été observé que l’affinité augmente avec l’augmentation de la longueur de la chaîne carbonée jusqu’à cinq carbones. De plus, les analogues d’amide présentaient une affinité plus élevée que les analogues d’hydrazide. Cependant, aucun de ces analogues ne possédait une affinité significativement plus grande que le rimonabant, mais néanmoins, ils étaient légèrement plus sélectifs que le rimonabant pour le récepteur CB1 par rapport au récepteur CB2.
Plusieurs tentatives ont été faites pour augmenter l’affinité des dérivés du diarylpyrazole en rigidifiant la structure du rimonabant. En termes de modèle pharmacophore général, les unités A, B et/ou C sont reliées par des liaisons supplémentaires conduisant à des molécules rigides. Par exemple, le pyrazole polycyclique condensé NESS-0327 a montré 5000 fois plus d’affinité pour le récepteur CB1 que le rimonabant. Cependant, ce composé possède une faible biodisponibilité centrale.
Un autre composé, le dérivé indazole O-1248, peut être considéré comme un analogue du rimonabant dans lequel son groupe 5-aryle est fusionné à la fraction pyrazole. Cependant, cette modification structurelle a entraîné une diminution de 67 fois de l’affinité du récepteur CB1.
Ces dérivés diarylpyrazole du rimonabant sont résumés dans le tableau 1.
 |
 |
| SR147778 | AM251 |
 |
 |
| NESS-0327 | O-1248 |
Other derivativesEdit
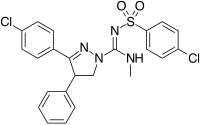
Structurally different from the 1,5-diarylpyrazoles are the chemical series of the 3,4-diarylpyrazolines. Dans cette série se trouve le SLV-319 (ibipinabant), un puissant antagoniste de CB1 qui est environ 1000 fois plus sélectif pour CB1 par rapport à CB2 et affiche une activité in vivo similaire au rimonabant.
Une autre approche utilisée pour développer des analogues du rimonabant consistait à remplacer le cycle pyrazole central par un autre hétérocycle. Un exemple de cette approche sont les 4,5-diarylimidazoles et les 1,5-diarylpyrrole-3-carboxamides.
Un grand nombre de dérivés bicycliques fusionnés du diaryl-pyrazole et des imidazoles ont été rapportés. Un exemple de ceux-ci est un dérivé de purine où un cycle pyrimidine est fusionné à un cycle imidazole. L’otenabant (CP-945,598) est un exemple de dérivé bicyclique fusionné développé par Pfizer.
Plusieurs groupes de recherche ont étudié les bioisostéroïdes pyrazoliques à cycle à six chaînons. Par exemple, un dérivé de la 2,3-diarylpyridine s’est avéré être un agoniste inverse CB1 puissant et sélectif. La structure de ce composé démontre la possibilité que la partie amide du rimonabant puisse être divisée en une fonctionnalité lipophile (benzyloxy) et polaire (nitrile). D’autres analogues de cycle à six chaînons sont par example les pyrimidines et les pyrazines.
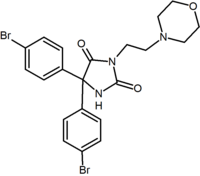
En plus des analogues du cycle à cinq et six chaînons, il existe d’autres dérivés cycliques tels que les azétidines. Un exemple est le dérivé de méthylsulfonamide azétidine qui possède un groupe 1,1-diaryle imitant la fraction 1,5-diaryle des diarylpyrazoles. Le groupe sulfonyle sert d’accepteur de liaison hydrogène. Le groupe 1,1-diaryle est également présent dans des dérivés tels que les benzodioxoles et les hydantoïnes.
Des analogues acycliques ont également été rapportés. Ces analogues contiennent un motif 1,2-diaryle qui correspond aux substituants 1,5-diaryle du rimonabant. Un exemple d’analogue acyclique est le taranabant (MK-0364) développé par Merck.
Les représentants de ces analogues sont résumés dans le tableau 2.
 |
 |
 |
|
| Type of derivative |
3,4-Diarylpyrazoline (Ibipinabant) | 4,5-Diarylimidazole | 1,5-Diarylpyrrole-3-carboxamides |
 |
 |
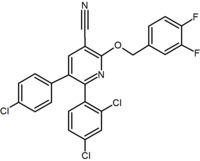 |
|
| Type of derivative |
Purine (pyrimidine ring fused to an imidazole ring) |
Purine derivative (Otenabant) | 2,3-Diarylpyridine |
 |
 |
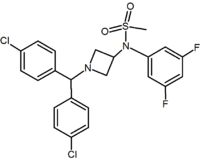 |
|
| Type of derivative |
Pyrimidine | Pyrazine | Methylsulfonamide azetidine |
 |
 |
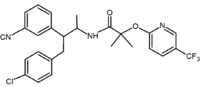 |
|
| Type de dérivé | Benzodioxole | Hydantoïne | Dérivé acyclique (Taranabant) |
Anticorps anti-récepteur CB1DIT
Des anticorps contre le récepteur CB1 ont été développés et introduits en utilisation clinique en Russie. Ils comprennent brizantin (russe: Бризантин®) et dietressa (russe: Диетресса®). Brizantin est indiqué pour le traitement du sevrage nicotinique et du sevrage tabagique et dietressa est indiqué pour la perte de poids. Dietressa est disponible en vente libre en Russie.
