Les complexes de transfert de charge présentent des transitions de transfert de charge dans lesquelles l’absorption déclenche le transfert d’un électron du donneur à l’accepteur.
Lorsque l’iode est dissous dans des solutions de solvants donneurs, la couleur pourpre frappante de l’iode moléculaire est remplacée par une couleur jaune-brun. En effet, les complexes de transfert de charge comme ceux formés par \(I_2\) peuvent absorber la lumière d’une manière que ni le donneur ni l’accepteur ne peuvent eux-mêmes. Plus précisément, les complexes à transfert de charge présentent des bandes de transfert de charge (bandes CT) dans leurs spectres d’absorption. Dans la transition de transfert de charge, le transfert partiel initial de charge de la base de Lewis donneuse à l’acide de Lewis accepteur dans le complexe de transfert de charge est poussé plus loin par photoexcitation.
\
La nature de ces transitions de transfert de charge est vue à partir de la description orbitale de la liaison pour les complexes de transfert de charge d’iode. Lorsqu’un complexe donneur-I2 se forme, la formation d’orbitales de liaison et d’anti-liaison donneur-I2 entraîne un déplacement de la transition \(I2 \sigma\rightarrow \sigma *\) vers une énergie plus élevée a la formation d’une nouvelle bande de transfert de charge associée à l’excitation d’un électron de l’orbitale amine-I2\(\sigma\) largement centrée sur l’amine-I2\ (\sigma *\) vers l’orbitale amine-I2 \ (\sigma *\) largement centrée sur l’I2.
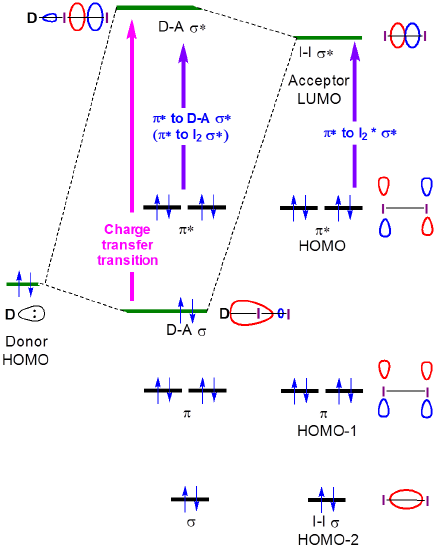
Figure 6.4.2.\(\PageIndex {2}\). Interactions orbitales frontalières qui provoquent des changements dans les spectres d’absorption de l’iode lorsqu’il forme un complexe de transfert de charge avec un donneur de base de Lewis.
Des solutions d’I2 en mélanges avec des bases de Lewis telles que des amines et dans des solvants donneurs chargent clairement des bandes de transfert. Plusieurs de ces spectres sont donnés à la figure 6.4.2.3.
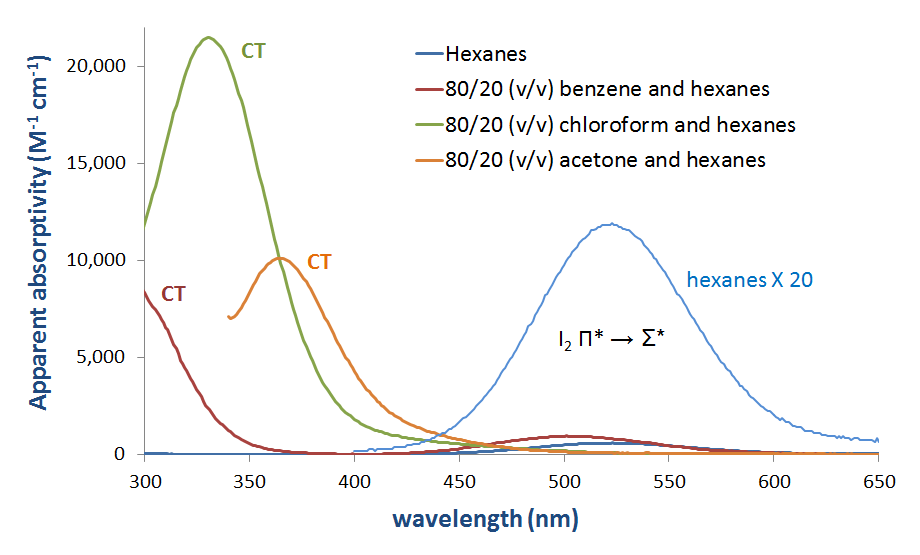
Figure 6.4.2.\(\PageIndex {3}\). Spectre d’absorption de l’iode moléculaire (I2) dans divers solvants montrant l’apparition d’une bande CT dans les solvants donneurs.*
En principe, les énergies des transitions de transfert de charge et de \(I_2~\pi*~\rightarrow~D-A~\sigma*\) augmentent toutes deux avec la force du donneur, comme le montre la figure 6.4.2.4.
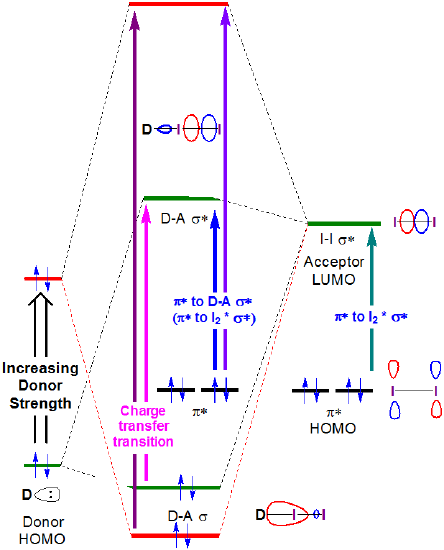
Figure 6.4.2.\(\PageIndex {4}\). Changement attendu des énergies orbitales frontalières associées à la formation du complexe accepteur de donneur I2 lorsque l’énergie HOMO du donneur est augmentée.
Comme on peut le voir à la figure 6.4.2. on peut s’attendre à ce que l’énergie de la bande de transfert de charge augmente à mesure que l’HOMO donneur augmente en énergie pour se rapprocher en énergie de l’accepteur LUMO. Bien qu’il faille être prudent lors de l’interprétation des spectres de la phase de solution de I2, cette attente est confirmée par une analyse rapide et qualitative des spectres de la figure 6.4.2.3. L’énergie de transition CT se déplace vers des longueurs d’onde plus basses (et donc une énergie plus élevée) lorsque l’énergie orbitale atomique occupée la plus élevée pour l’atome donneur augmente en passant de l’acétone (oxygène, -15,85 eV) au chloroforme (chlore, -13,67eV) et enfin au benzène (carbone, -10.66 eV).**
Les bandes de transfert de charge en chimie des métaux de transition
Les transitions de transfert de charge sont responsables de la couleur intense de nombreux complexes de métaux de transition. Dans ces cas, cependant, la faible interaction de base de Lewis-acide implique une donation et une acceptation incomplètes d’électrons dans une liaison \(p\pi-d\pi\) (ou \(p\pi-d\pi *\)) entre un métal et un ligand. Les bandes de transfert de charge dans les spectres d’absorption de ces complexes impliquent le transfert d’électrons entre le métal et le ligand. En particulier, les bandes de transfert de charge métal-ligand (MLCT ou CTTL)
- impliquent le transfert d’un électron d’une orbitale métallique d remplie ou partiellement remplie vers une orbitale de type ligand \(\pi *\).

- Les bandes de transfert de charge de ligand sur métal (LMCT ou CTTL) impliquent le transfert d’un électron d’un ligand rempli ou partiellement rempli orbtial vers une orbitale d métallique.

- Des bandes de transfert de charge métal sur métal peuvent être observées dans certains complexes bimétalliques. Cependant, ceux-ci ne sont généralement considérés que comme un transfert d’électrons plutôt que comme un changement du statut d’une interaction acide-base de Lewis.
Parce que les bandes de transfert de charge de ligand métallique impliquent un transfert d’électrons intermoléculaire entre le métal et le ligand pour générer un état rédox à haute énergie, l’état excité CT est à la fois un meilleur oxydant et un meilleur réducteur que l’état fondamental. Par conséquent, il y a eu d’intenses recherches sur le développement de complexes métalliques dont les états excités de transfert de charge sont de puissants oxydants et réducteurs dans l’espoir qu’ils puissent conduire l’oxydation et la réduction photocatalytiques des substrats.
* L’absorptivité apparente de I2 dans les hexanes a été calculée à partir du spectre d’absorption de 215 µM I2 dans les hexanes. Toutes les autres absorptivités apparentes ont été calculées à partir des spectres d’absorption de solutions de 44 µM dans I2.
** Les positions de bande ne sont pas les énergies de bande CT et les énergies HOMO données sont des niveaux d’énergie atomique et ne correspondent pas nécessairement à l’HOMO du donneur en solution. Pour cette raison et d’autres simplifications, cette analyse n’est pas destinée à remplacer une analyse informatique rigoureuse des facteurs à l’origine des positions de bande CT.
1. Meyerstein, D.; Treinin, A., Complexes de transfert de charge d’iode et d’anions inorganiques en solution. Transactions de la Société Faraday 1963, 59 (0), 1114-1120.
2. Baskar, A. J. A.; Rajpurohit, A. S.; Panneerselvam, M.; Jaccobb, M.; RoopSingh, D.; Kannappan, V., Analyse expérimentale et théorique de l’effet des substituants sur les complexes de transfert de charge de l’iode et de certains alkylbenzènes en solution de n-hexane à 303K. Collections de données chimiques 2017, 7-8, 80-92.
