Objectifs d’apprentissage
- Écrivez la formule chimique d’un composé ionique simple.
- Reconnaître les ions polyatomiques dans les formules chimiques.
Nous avons déjà rencontré des formules chimiques pour des composés ioniques simples. Une formule chimique est une liste concise des éléments d’un composé et des rapports de ces éléments. Pour mieux comprendre ce que signifie une formule chimique, nous devons considérer comment un composé ionique est construit à partir de ses ions.
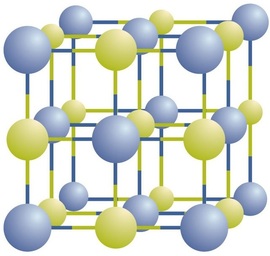
Les composés ioniques existent sous forme d’ions positifs et négatifs alternés dans des réseaux tridimensionnels réguliers appelés cristaux (Figure\(\PageIndex{1}\)). Comme vous pouvez le voir, il n’y a pas de « particules » individuelles \(\ce{NaCl}\) dans le tableau; à la place, il y a un réseau continu d’ions sodium et chlorure alternés. Cependant, nous pouvons utiliser le rapport des ions sodium aux ions chlorure, exprimé en nombres entiers les plus bas possibles, comme moyen de décrire le composé. Dans le cas du chlorure de sodium, le rapport des ions sodium aux ions chlorure, exprimé en nombres entiers les plus faibles, est de 1:1, nous utilisons donc \(\ce{NaCl}\) (un symbole \ (\ce{Na}\) et un symbole \(\ce{Cl}\)) pour représenter le composé. Ainsi, \(\ce{NaCl}\) est la formule chimique du chlorure de sodium, qui est une manière concise de décrire le nombre relatif d’ions différents dans le composé. Un échantillon macroscopique est composé de myriades de paires de NaCl; chaque paire individuelle appelée unité de formule. Bien qu’il soit commode de penser que les cristaux \(\ce{NaCl}\) sont composés d’unités individuelles \(\ce{NaCl}\), la figure \(\PageIndex{1}\) montre qu’aucun ion unique n’est exclusivement associé à un autre ion unique. Chaque ion est entouré d’ions de charge opposée.
La formule d’un composé ionique suit plusieurs conventions. Tout d’abord, le cation est écrit avant l’anion. Étant donné que la plupart des métaux forment des cations et que la plupart des non-métaux forment des anions, les formules énumèrent généralement le métal en premier, puis le non-métal. Deuxièmement, les charges ne sont pas écrites dans une formule. Rappelez-vous que dans un composé ionique, les espèces constitutives sont des ions et non des atomes neutres, même si la formule ne contient pas de charges. Enfin, la formule appropriée pour un composé ionique a toujours une charge nette nulle, ce qui signifie que la charge positive totale doit être égale à la charge négative totale. Pour déterminer la formule appropriée de toute combinaison d’ions, déterminez combien de chaque ion est nécessaire pour équilibrer les charges positives et négatives totales dans le composé.
Cette règle est finalement basée sur le fait que la matière est, dans l’ensemble, électriquement neutre.
Par convention, supposons qu’il n’y ait qu’un seul atome si aucun indice n’est présent. Nous n’utilisons pas 1 comme indice.
Si nous regardons le composé ionique constitué d’ions lithium et d’ions bromure, nous voyons que l’ion lithium a une charge 1 + et l’ion bromure a une charge 1−. Un seul ion de chacun est nécessaire pour équilibrer ces charges. La formule du bromure de lithium est \(\ce{LiBr}\).
Lorsqu’un composé ionique est formé à partir de magnésium et d’oxygène, l’ion magnésium a une charge 2+ et l’atome d’oxygène a une charge 2−. Bien que ces deux ions aient des charges plus élevées que les ions du bromure de lithium, ils s’équilibrent toujours dans un rapport un pour un. Par conséquent, la formule appropriée pour ce composé ionique est \(\ce{MgO}\).
Considérons maintenant le composé ionique formé par le magnésium et le chlore. Un ion magnésium a une charge 2+, tandis qu’un ion chlore a une charge 1:
\
La combinaison d’un ion de chacun n’équilibre pas complètement les charges positives et négatives. La façon la plus simple d’équilibrer ces charges est de supposer la présence de deux ions chlorure pour chaque ion magnésium:
\
Maintenant, les charges positives et négatives sont équilibrées. On pourrait écrire la formule chimique de ce composé ionique comme \(\ce{MgClCl}\), mais la convention est d’utiliser un indice numérique lorsqu’il y a plus d’un ion d’un type donné — \(\ce{MgCl2}\). Cette formule chimique indique qu’il y a un ion magnésium et deux ions chlorure dans cette formule. (Ne lisez pas la partie « Cl2 » de la formule comme une molécule du chlore élémentaire diatomique. Le chlore n’existe pas en tant qu’élément diatomique dans ce composé. Il existe plutôt sous la forme de deux ions chlorure individuels.) Par convention, le rapport entier le plus bas est utilisé dans les formules des composés ioniques. La formule \(\ce{Mg2Cl4}\) a des charges équilibrées avec les ions dans un rapport 1: 2, mais ce n’est pas le rapport en nombre entier le plus bas.
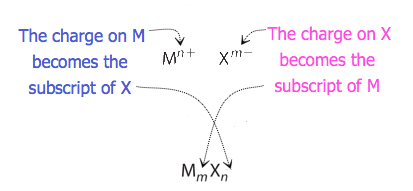
Pour les composés dans lesquels le rapport des ions n’est pas aussi évident, les indices de la formule peuvent être obtenus en croisant les charges: utilisez la valeur absolue de la charge sur un ion comme indice pour l’autre ion. Cette méthode est illustrée schématiquement à la figure 3.3.2.
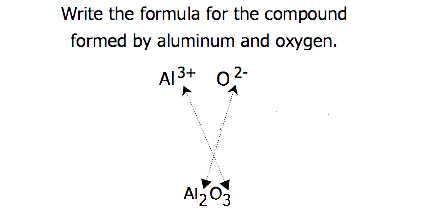
Lors du croisement des charges, il est parfois nécessaire de réduire les indices à leur rapport le plus simple pour écrire la formule empirique. Considérons, par exemple, le composé formé par Pb4+ et O2−. En utilisant les valeurs absolues des charges sur les ions comme indices, on obtient la formule Pb2O4. Cela simplifie à sa formule empirique correcte PbO2. La formule empirique a un ion Pb4+ et deux ions O2−.
Exemple \(\PageIndex{1}\)
Écrivez la formule chimique d’un composé ionique composé de chaque paire d’ions.
- l’ion sodium et l’ion soufre
- l’ion aluminium et l’ion fluorure
- l’ion fer 3+ et l’ion oxygène
Solution
- Pour obtenir un octet de coquille de valence, le sodium forme un ion avec une charge 1+ , tandis que l’ion soufre a une charge 2. Deux ions sodium 1+ sont nécessaires pour équilibrer la charge 2 sur l’ion soufre. Plutôt que d’écrire la formule comme \(\ce{NaNaS}\), nous la raccourcissons par convention en \(\ce{Na2S}\).
- L’ion aluminium a une charge 3+, tandis que l’ion fluorure formé par le fluor a une charge 1. Trois ions 1-fluor sont nécessaires pour équilibrer la charge 3 + sur l’ion aluminium. Cette combinaison est écrite comme \(\ce{AlF3}\).
- Le fer peut former deux ions possibles, mais l’ion avec une charge 3+ est spécifié ici. L’atome d’oxygène a une charge 2 sous forme d’ion. Pour équilibrer les charges positives et négatives, nous nous tournons vers le multiple 6 le moins commun: deux ions fer 3 + donneront 6 +, tandis que trois ions 2—oxygène donneront 6−, équilibrant ainsi les charges positives et négatives globales. Ainsi, la formule de ce composé ionique est \(\ce{Fe2O3}\). Vous pouvez également utiliser la méthode des frais de passage illustrée à la figure 3.3.2.
Exercice \(\PageIndex{1}\)
Écrivez la formule chimique d’un composé ionique composé de chaque paire d’ions.
- l’ion calcium et l’ion oxygène
- l’ion cuivre 2+ et l’ion soufre
- l’ion cuivre 1+ et l’ion soufre
Réponse a:
CaO
Réponse b:
CuS
Réponse c:
Cu2S
Ions polyatomiques
Certains ions sont constitués de groupes d’atomes liés de manière covalente et ont une charge électrique globale. Parce que ces ions contiennent plus d’un atome, ils sont appelés ions polyatomiques. Les structures, noms et formules de Lewis de certains ions polyatomiques se trouvent dans le tableau 3.3.1.
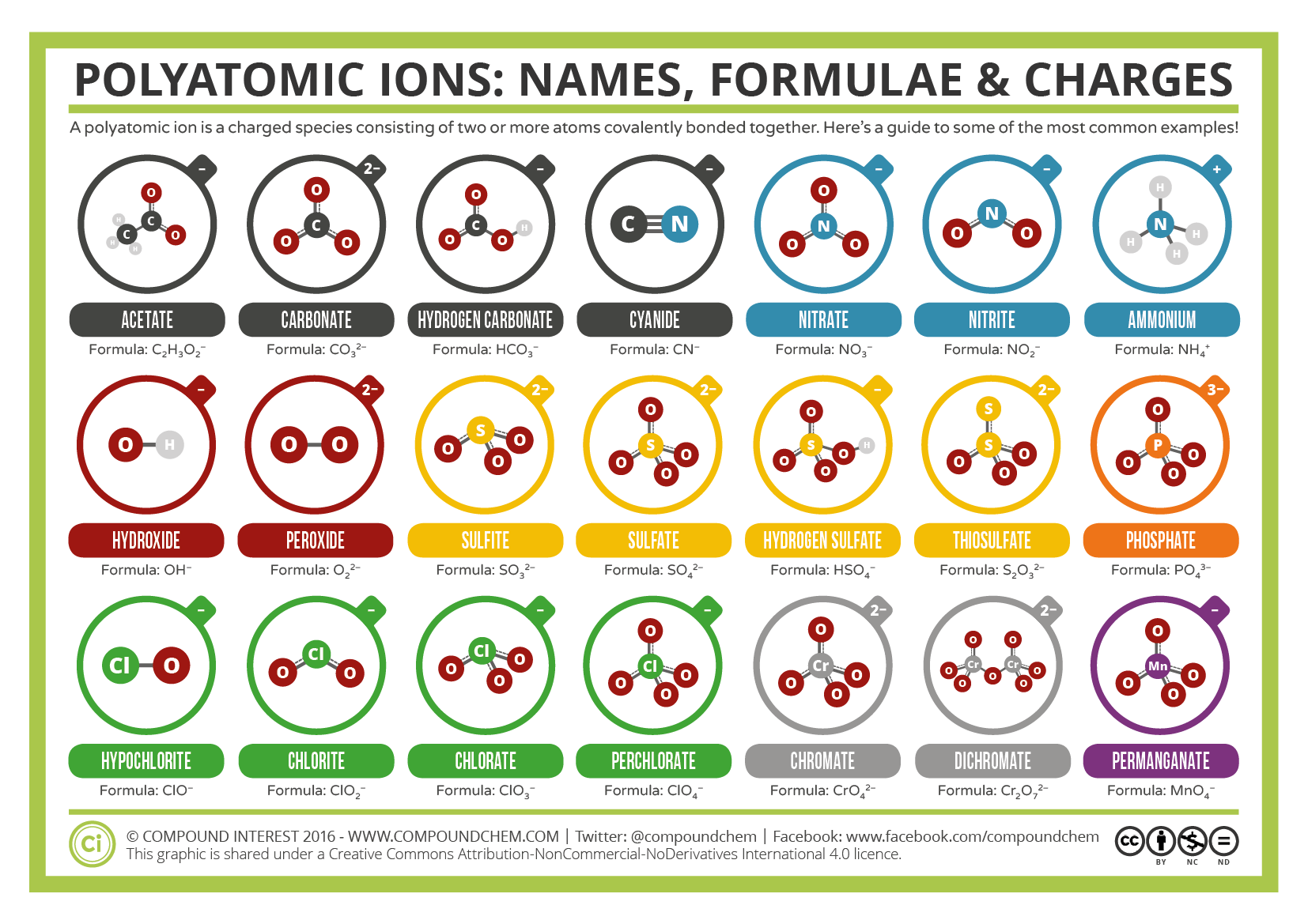
Table\(\PageIndex{1}\):Certains ions polyatomiques
Les ions polyatomiques ont des formules, des noms et des charges définis qui ne peuvent en aucun cas être modifiés. Le tableau \(\PageIndex{2}\) répertorie les noms d’ions et les formules d’ions des ions polyatomiques les plus courants. Par exemple, \(\ce{NO3^{-}}\) est l’ion nitrate; il a un atome d’azote et trois atomes d’oxygène et une charge globale de 1. La figure \(\PageIndex{2}\) répertorie les ions polyatomiques les plus courants.
| Ion Name | Ion Formula |
|---|---|
| ammonium ion | NH4+1 |
| hydroxide ion | OH−1 |
| cyanide ion | CN−1 |
| carbonate ion | CO3−2 |
| bicarbonate or hydrogen carbonate | HCO3− |
| acetate ion | C2H3O2−1 or CH3CO2−1 |
| nitrate ion | NO3−1 |
| nitrite ion | NO2−1 |
| sulfate ion | SO4−2 |
| sulfite ion | SO3−2 |
| phosphate ion | PO4−3 |
| phosphite ion | PO3−3 |
Note that only one polyatomic ion in this Table, the ammonium ion (NH4+1), is a cation. This polyatomic ion contains one nitrogen and four hydrogens that collectively bear a +1 charge. Les ions polyatomiques restants sont tous chargés négativement et sont donc classés comme anions. Cependant, seuls deux d’entre eux, l’ion hydroxyde et l’ion cyanure, sont nommés en utilisant le suffixe « -id » qui indique généralement les particules chargées négativement. Les anions polyatomiques restants, qui contiennent tous de l’oxygène, en combinaison avec un autre non-métal, font partie d’une série dans laquelle le nombre d’oxygène au sein de l’unité polyatomique peut varier. Comme cela a été souligné à plusieurs reprises dans plusieurs sections de ce texte, aucune formule chimique ne devrait partager un nom chimique commun. Un seul suffixe, « -id », est insuffisant pour distinguer les noms des anions dans une série polyatomique connexe. Par conséquent, les suffixes « -ate » et « -te » sont utilisés pour indiquer que les ions polyatomiques correspondants font partie d’une série. De plus, ces suffixes indiquent également le nombre relatif d’oxygènes contenus dans les ions polyatomiques. Notez que tous les ions polyatomiques dont les noms se terminent par « -ate » contiennent un oxygène de plus que les anions polyatomiques dont les noms se terminent par « -te ». »Malheureusement, tout comme le système commun pour nommer les métaux de transition, ces suffixes n’indiquent que le nombre relatif d’oxygènes contenus dans les ions polyatomiques. Par exemple, l’ion nitrate, symbolisé par NO3-1, contient un oxygène de plus que l’ion nitrite, symbolisé par NO2−1. Cependant, l’ion sulfate est symbolisé par SO4-2. Alors que l’ion nitrate et l’ion sulfate partagent un suffixe « -ate », le premier contient trois oxygènes, mais le second en contient quatre. De plus, l’ion nitrate et l’ion sulfite contiennent trois oxygènes, mais ces ions polyatomiques ne partagent pas de suffixe commun. Malheureusement, la nature relative de ces suffixes impose que les combinaisons formule ionique/ nom ionique des ions polyatomiques doivent simplement être mémorisées.
La règle de construction des formules pour les composés ioniques contenant des ions polyatomiques est la même que pour les formules contenant des ions monatomiques (à un atome): les charges positives et négatives doivent s’équilibrer. Si plus d’un ion polyatomique particulier est nécessaire pour équilibrer la charge, la formule entière de l’ion polyatomique doit être placée entre parenthèses et l’indice numérique est placé en dehors des parenthèses. Il s’agit de montrer que l’indice s’applique à l’ensemble de l’ion polyatomique. Deux exemples sont présentés ci-dessous :

Exemple \(\PageIndex{2}\)
Écrivez la formule chimique d’un composé ionique composé de chaque paire d’ions.
- l’ion potassium et l’ion sulfate
- l’ion calcium et l’ion nitrate
Solution
- Les ions potassium ont une charge de 1+, tandis que les ions sulfate ont une charge de 2−. Nous aurons besoin de deux ions potassium pour équilibrer la charge sur l’ion sulfate, de sorte que la formule chimique appropriée est \(\ce{K_2SO_4}\).
- Les ions calcium ont une charge de 2+, tandis que les ions nitrate ont une charge de 1−. Nous aurons besoin de deux ions nitrate pour équilibrer la charge sur chaque ion calcium. La formule du nitrate doit être placée entre parenthèses. Ainsi, nous écrivons \(\ce{Ca(NO3)2}\) comme formule de ce composé ionique.
Exercice \(\PageIndex{2}\)
Écrivez la formule chimique d’un composé ionique composé de chaque paire d’ions.
- l’ion magnésium et l’ion carbonate
- l’ion aluminium et l’ion acétate
Réponse a:
Mg2+ et CO32-=MgCO3
Réponse b:
Al3+ et C2H3O2-=Al(C2H3O2)3
Reconnaissance des composés ioniques
Il existe deux façons de reconnaître les composés ioniques. Premièrement, les composés entre les éléments métalliques et non métalliques sont généralement ioniques. Par example, CaBr2 contient un élément métallique (calcium, un métal du groupe 2A) et un élément non métallique (brome, un non métallique du groupe 7A). Par conséquent, il s’agit très probablement d’un composé ionique. (En fait, il est ionique.) En revanche, le composé NO2 contient deux éléments non métalliques (azote, du groupe 5A, et oxygène, du groupe 6A). Ce n’est pas un composé ionique; il appartient à la catégorie des composés covalents discutés ailleurs. Notez également que cette combinaison d’azote et d’oxygène n’a pas de charge électrique spécifiée, ce n’est donc pas l’ion nitrite.
Deuxièmement, si vous reconnaissez la formule d’un ion polyatomique dans un composé, le composé est ionique. Par exemple, si vous voyez la formule \(\ce{Ba(NO3)2}\), vous pouvez reconnaître la partie « NO3 » comme l’ion nitrate, \(\rm{NO_3^-}\). (Rappelez-vous que la convention pour écrire des formules pour les composés ioniques est de ne pas inclure la charge ionique.) C’est un indice que l’autre partie de la formule, \(\ce{Ba}\), est en fait l’ion \(\ce{Ba^{2 +}}\), la charge 2+ équilibrant la charge 2 globale des deux ions nitrate. Ainsi, ce composé est également ionique.
Exemple \(\PageIndex{3}\)
Identifiez chaque composé comme ionique ou non ionique.
- \(\ce{Na2O}\)
- \(\ce{PCl3}\)
- \(\ce{NH4Cl}\)
- \(\ce{OF2}\)
Solution
- Le sodium est un métal et l’oxygène un non-métal; par conséquent, \(\ce{Na2O}\) devrait être ionique.
- Le phosphore et le chlore ne sont pas des métaux. Par conséquent, \(\ce{PCl3}\) n’est pas ionique.
- Le \(\ce{NH4}\) dans la formule représente l’ion ammonium, \(\ce{NH4^{+}}\), ce qui indique que ce composé est ionique.
- L’oxygène et le fluor sont des non-métaux. Par conséquent, \(\ce{OF2}\) n’est pas ionique.
Exercice \(\PageIndex{3}\)
Identifiez chaque composé comme ionique ou non ionique.
- \(\ce{N2O}\)
- \(\ce{FeCl3}\)
- \(\ce{(NH4)3PO4}\)
- \(\ce{SOCl2}\)
Réponse a:
non ionique
Réponse b:
ionique
Réponse c:
ionique
Réponse d:
non ionique
En regardant de plus près: Le sang et l’eau de mer
La science reconnaît depuis longtemps que le sang et l’eau de mer ont des compositions similaires. Après tout, les deux liquides contiennent des composés ioniques dissous. La similitude peut être plus qu’une simple coïncidence; de nombreux scientifiques pensent que les premières formes de vie sur Terre sont apparues dans les océans. Un examen plus approfondi montre cependant que le sang et l’eau de mer sont très différents. Une solution à 0,9% de chlorure de sodium se rapproche de la concentration de sel trouvée dans le sang. En revanche, l’eau de mer est principalement une solution de chlorure de sodium à 3%, plus de trois fois la concentration dans le sang. Voici une comparaison des quantités d’ions dans le sang et l’eau de mer:
| Ion | Pour cent dans L’eau de mer | Pourcentage dans le sang |
|---|---|---|
| Na+ | 2.36 | 0.322 |
| Cl− | 1.94 | 0.366 |
| Mg2+ | 0.13 | 0.002 |
| SO42− | 0.09 | — |
| K+ | 0.04 | 0.016 |
| Ca2+ | 0.04 | 0.0096 |
| HCO3− | 0.002 | 0.165 |
| HPO42−, H2PO4− | — | 0.01 |
Most ions are more abundant in seawater than they are in blood, with some important exceptions. There are far more hydrogen carbonate ions (\(\ce{HCO3^{−}}\)) in blood than in seawater. Cette différence est significative car l’ion hydrogénocarbonate et certains ions apparentés jouent un rôle crucial dans le contrôle des propriétés acido-basiques du sang. La quantité d’ions hydrogénophosphates — \(\ce{HPO4^{2-}} \) et \(\ce{H2PO4^{-}} \) – dans l’eau de mer est très faible, mais ils sont présents en quantités plus élevées dans le sang, où ils affectent également les propriétés acido-basiques. Une autre différence notable est que le sang ne contient pas de quantités significatives de l’ion sulfate (\(\ce {SO4^{2−}}\)), mais cet ion est présent dans l’eau de mer.
Principaux points à retenir
- Les formules chimiques appropriées pour les composés ioniques équilibrent la charge positive totale avec la charge négative totale.
- Des groupes d’atomes avec une charge globale, appelés ions polyatomiques, existent également.
EXERCICES
-
Quelles informations contient la formule d’un composé ionique?
-
Pourquoi les formules chimiques de certains composés ioniques contiennent-elles des indices, alors que d’autres non?
3. Écrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- Mg2+ et I−
- Na+ et O2−
4. Écrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- Na+ et Br−
- Mg2+ et Br−
- Mg2+ et S2-
5. Écrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- K+ et Cl-
- Mg2+ et Cl-
- Mg2+ et Se2-
6. Écrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- Na+ et N3-
- Mg2+ et N3-
- Al3+ et S2-
7. Écrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- Li+ et N3-
- Mg2+ et P3-
- Li+ et P3-
8. Écrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- Fe3+ et Br−
- Fe2+ et Br−
- Au3+ et S2−
- Au+ et S2−
9. Écrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- Cr3+ et O2−
- Cr2+ et O2−
- Pb2+ et Cl−
- Pb4+ et Cl−
10. Écrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- Cr3+ et NO3−
- Fe2+ et PO43−
- Ca2+ et CrO42−
- Al3+ et OH−
11. Écrivez la formule chimique du composé ionique formé par chaque paire d’ions.
- NH4+ et NO3−
- H+ et Cr2O72−
- Cu+ et CO32−
- Na+ et HCO3−
12. Pour chaque paire d’éléments, déterminez la charge de leurs ions et écrivez la formule appropriée pour le composé ionique résultant entre eux.
- Ba et S
- Cs et I
13. Pour chaque paire d’éléments, déterminez la charge de leurs ions et écrivez la formule appropriée pour le composé ionique résultant entre eux.
- K et S
- Sc et Br
14. Quels composés prédiseriez-vous être ioniques?
- Li2O
- (NH4)2O
- CO2
- FeSO3
- C6H6
- C2H6O
15. Quels composés prédiseriez-vous être ioniques?
- Ba(OH)2
- CH2O
- NH2CONH2
- (NH4)2CrO4
- C8H18
- NH3
Réponses
1. le rapport de chaque type d’ion dans le composé
2. Parfois, plus d’un ion est nécessaire pour équilibrer la charge sur l’autre ion dans un composé ionique.
- MgI2
- Na2O
- NaBr
- MgBr2
- MGS
- KCL
- MgCl2
- mgse
- na3n
- mg3n2
- al2s3
- li3n
- mg3p2
- li3p
- febr3
- febr2
- au2s3
- au2s
- Cr2O3
- CRO
- PbCl2
- PbCl4
- Cr(No3)3
- Fe3(PO4)2
- CaCrO4
- Al(OH)3
- NH4NO3
- h2cr2o7
- cu2co3
- NaHCO3
- Ba2+, S2−, bas
- cs+, i−, CSI
- K+, S2−, K2s
- SC3+, br−, scbr3
- Ionique
- non Ionique
- non Ionique
- non Ionique
- non Ionique
- non Ionique
- non ionique
- div>
- ionique
non ionique non ionique - ionique
non ionique non ionique
- ionique
li>
