13.5D: La biotine est une coenzyme porteuse de CO2
Rappel de la section 6.5B que de nombreuses enzymes dépendent de l’assistance de coenzymes, qui sont de petites molécules organiques (par rapport aux protéines) qui se lient de manière covalente ou non- de manière covalente – dans le site actif d’une enzyme et l’aider à catalyser sa réaction. La S-adénosylméthionine (SAM, section 9.1A) et l’ATP (section 10.2) sont deux exemples que nous avons rencontrés jusqu’à présent, et nous en verrons plusieurs autres dans les chapitres à venir. Bien que la rubisco (décrite dans la partie B de cette section) soit une exception, la plupart des enzymes qui catalysent les réactions de carboxylation dépendent d’une coenzyme appelée biotine, qui sert de transporteur temporaire de dioxyde de carbone.
La pyruvate carboxylase, l’enzyme catalysant la première étape de la voie gluconeogensis, est un bon exemple de réaction de carboxylation dépendante de la biotine. Notez que le CO2 dans cette réaction est dérivé du bicarbonate, contrairement à la réaction de Rubisco dans laquelle le CO2 est « fixé » directement de l’atmosphère.

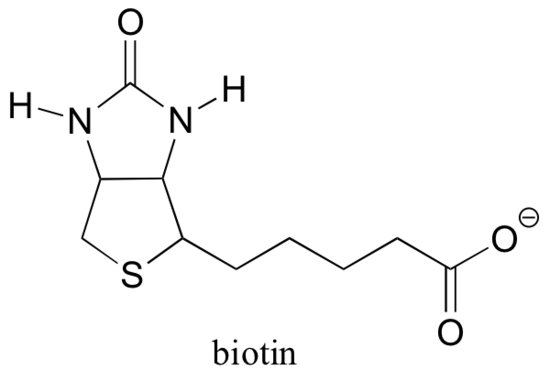
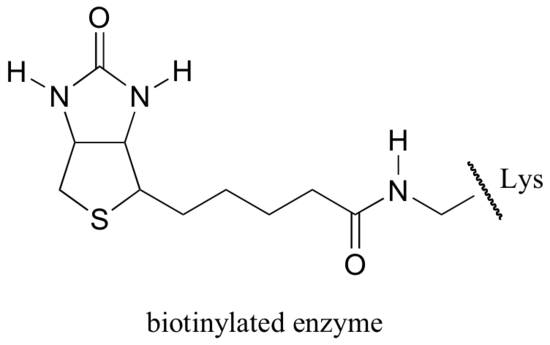
La biotine est fixée de manière covalente à l’enzyme par une liaison amide à une lysine de site actif.
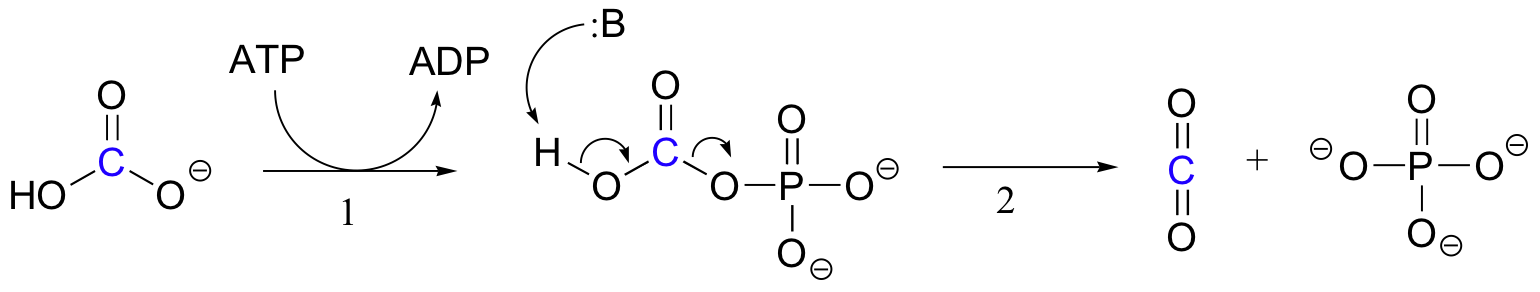
Le mécanisme exact par lequel les réactions de carboxylation dépendantes de la biotine fonctionnent n’est toujours pas complètement compris, mais ce qui suit est une image probable. Tout d’abord, l’ion bicarbonate est phosphorylé par l’ATP (étape 1, voir section 10.2), et est donc activé pour la décarboxylation, ce qui génère du CO2 libre (étape 2).
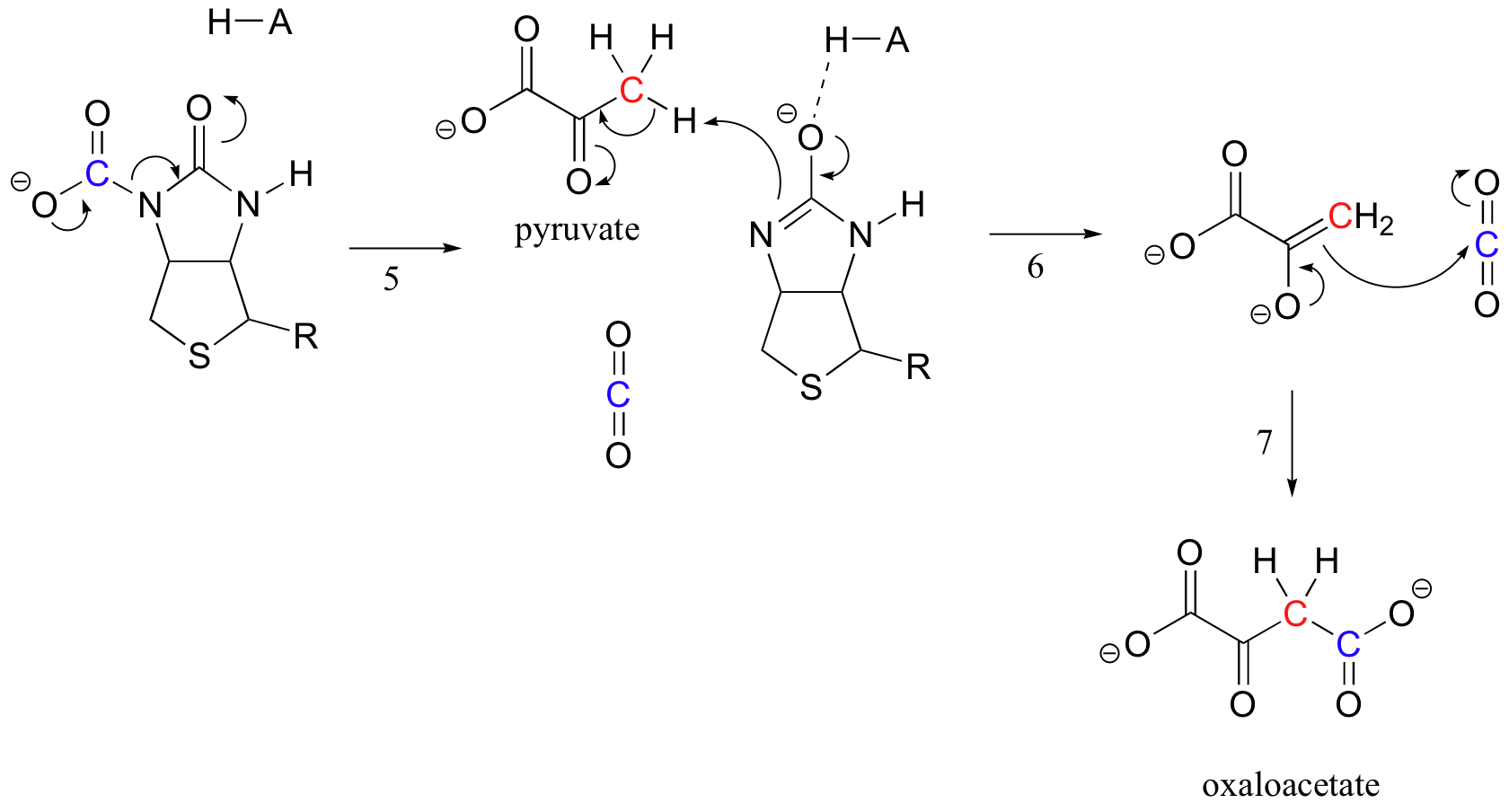
Le travail de la biotine consiste à conserver la molécule de dioxyde de carbone jusqu’à ce que le pyruvate entre dans le site actif. La carboxylation de la biotine implique la déprotonation de l’azote amide pour former un intermédiaire de type énolate (les amides de l’étape 3 ont un pKa d’environ 17, ce qui est abaissé par la présence d’un acide actif près de l’oxygène). Cette étape est suivie d’une attaque de l’azote nucléophile sur le dioxyde de carbone pour former une enzyme carboxybiotinylée (étape 4).
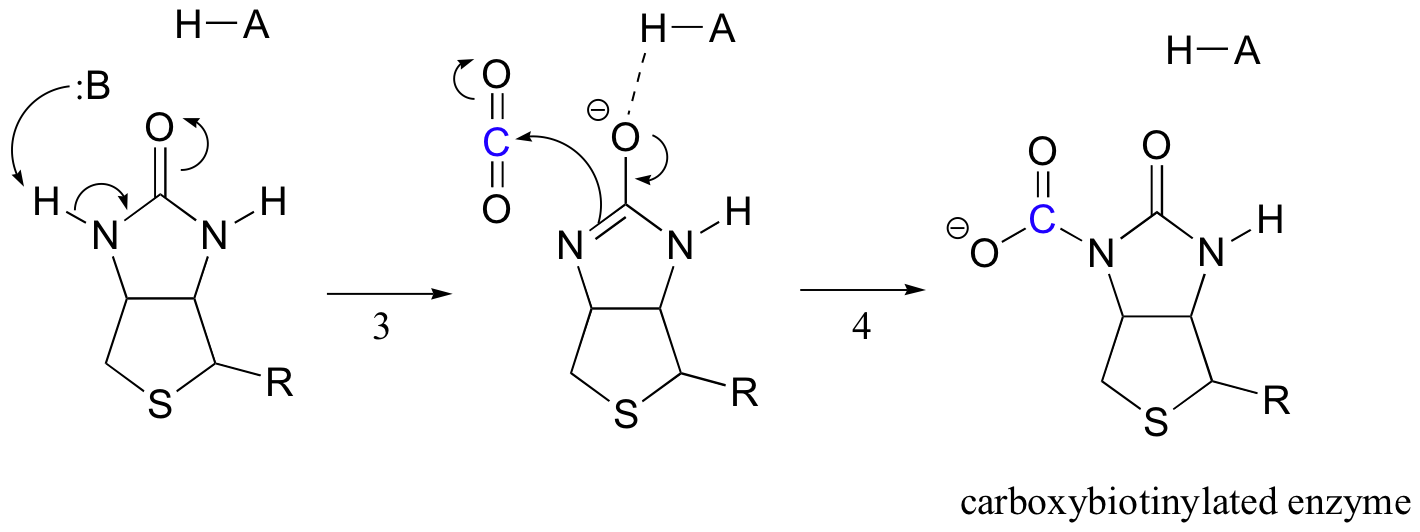
Lorsqu’une molécule de pyruvate se lie, le réarrangement de l’architecture du site actif fait que l’étape précédente va en sens inverse (étape 5), libérant le CO2 et générant une base de biotine pour déprotoner le carbone alpha de pyruvate afin qu’il puisse se condenser, de manière aldolique, avec du CO2 pour former de l’oxaloacétate (étapes 6-7).
Si vous avez étudié la biochimie, vous avez peut-être entendu parler de la biotine dans un contexte quelque peu différent de ce qui est discuté dans cette section. Une protéine appelée avidine, présente en abondance dans le blanc d’œuf, se lie de manière non covalente et extrêmement serrée à la biotine (en fait, l’avidine-biotine est la paire de liaison protéine-ligand la plus serrée connue de la science). Les biochimistes utilisent souvent cette propriété en liant de manière covalente une biomolécule d’intérêt à la biotine. Les espèces « biotinylées » peuvent ensuite être facilement isolées d’un mélange complexe en faisant passer le mélange dans une « colonne d’affinité » enrobée d’avidine.
