Il existe un certain nombre de façons dont une cellule peut se déplacer d’un point de l’espace à un autre. Dans un milieu liquide, cette méthode peut être une sorte de nage, utilisant un mouvement ciliaire ou flagellaire pour propulser la cellule. Sur des surfaces solides, ces mécanismes ne fonctionneront clairement pas efficacement et la cellule subit un processus de rampement. Dans cette section, nous commençons par une discussion sur le mouvement ciliaire / flagellaire, puis considérons les exigences plus compliquées du rampement cellulaire.
Les cils et les flagelles, qui diffèrent principalement par leur longueur plutôt que par leur construction, sont des organites à base de microtubules qui se déplacent avec un mouvement de va-et-vient. Cela se traduit par « ramer » par les cils relativement courts, mais dans les flagelles plus longs, la flexibilité de la structure fait que le mouvement de va-et-vient se propage sous forme d’onde, de sorte que le mouvement flagellaire est plus ondulé ou en forme de coup de fouet (considérez ce qui se passe lorsque vous remuez rapidement un tuyau d’arrosage d’un côté à l’autre par rapport à un morceau court du même tuyau). Le noyau de l’une ou l’autre structure s’appelle l’axonème, qui est composé de 9 doublets de microtubules reliés entre eux par des protéines motrices de dynéine ciliaires, et entourant un noyau central de deux microtubules séparés.
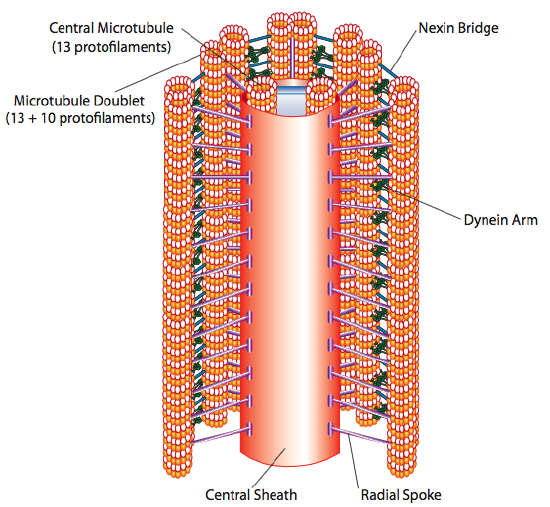
C’est ce qu’on appelle la formation « 9+2 », bien que les neuf doublets ne soient pas les mêmes que les deux microtubules centraux. Le tubule A est un 13-protofilaments complets, mais le tubule B qui y est fusionné ne contient que 10 protofilaments. Chacun des microtubules centraux est constitué de 13 protofilaments complets. L’axonème 9 + 2 étend la longueur du cil ou du flagelle de la pointe jusqu’à ce qu’il atteigne la base, et se connecte au corps cellulaire à travers un corps basal, qui est composé de 9 triplets de microtubules disposés en un canon court, un peu comme les centrioles dont ils sont dérivés.
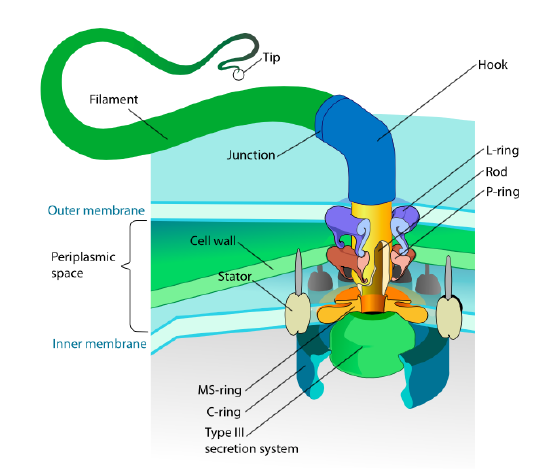
Cette section ne concerne que les eucaryotes. Certains procaryotes ont également des appendices mobiles appelés flagelles, mais leur structure et leur mécanisme sont complètement différents. Les flagelles eux-mêmes sont de longs polymères hélicoïdaux de la protéine flagelline, et la base des fibres de flagelline est reliée à une protéine moteur de rotation, pas à un moteur de traduction. Ce moteur (Figure \(\PageIndex{18}\)) utilise des ions (H+ ou Na+ selon les espèces) en descendant un gradient électrochimique pour fournir l’énergie nécessaire pour tourner jusqu’à 100000 tours par minute. On pense que la rotation est entraînée par des changements conformationnels dans l’anneau du stator, niché dans la membrane cellulaire.
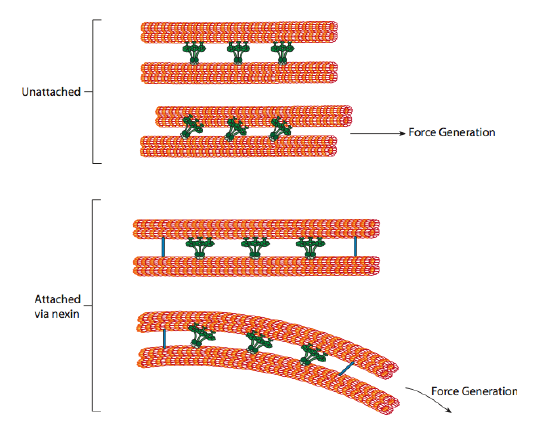
Les dynéines ciliaires fournissent la capacité motrice, mais il existe également deux autres protéines de liaison dans l’axonème. Il y a des nexins qui joignent le tube A d’un doublet au tube B de son doublet adjacent, reliant ainsi la bague extérieure. Et, il y a des rayons radiaux qui s’étendent du tube A de chaque doublet à la paire centrale de microtubules au cœur de l’axonème. Aucun de ceux-ci n’a d’activité motrice. Cependant, ils sont essentiels au mouvement des cils et des flagelles car ils aident à transformer un mouvement de glissement en mouvement de flexion. Lorsque la dynéine ciliaire (très similaire aux dynéines cytoplasmiques mais à trois têtes au lieu de deux) est engagée, elle lie un microtubule A d’un côté, un microtubule B du doublet adjacent et se déplace l’un par rapport à l’autre. Une ligne de ces dynéines se déplaçant de concert glisserait ainsi un doublet par rapport à l’autre, si (et c’est un grand « si ») les deux doublets avaient une totale liberté de mouvement. Cependant, puisque les doublets sont interconnectés par les protéines nexin, ce qui se passe lorsqu’un doublet tente de glisser, c’est qu’il plie la structure connectée à la place (Figure \(\PageIndex{17}\)). Cette courbure explique le mouvement d’aviron des cils, qui sont relativement courts, ainsi que le mouvement de fouettage des longs flagelles, qui propagent le mouvement de flexion vers le bas de l’axonème.
Bien que nous considérions le mouvement ciliaire et flagellaire comme des méthodes de propulsion d’une cellule, telles que la nage flagellaire du sperme vers un ovule, il existe également un certain nombre d’endroits importants dans lesquels la cellule est stationnaire et les cils sont utilisés pour déplacer le liquide au-delà de la cellule. En fait, il existe des cellules avec des cils dans la plupart des principaux organes du corps. Plusieurs dyskinésies ciliaires ont été rapportées, dont la plus importante, la dyskinésie ciliaire primitive (PCD), qui comprend le syndrome de Kartagener (KS), est due à une mutation du gène DNAI1, qui code pour une sous-unité (chaîne intermédiaire 1) de la dynéine axonémale (ciliaire). Le PCD est caractérisé par une détresse respiratoire due à une infection récurrente, et le diagnostic de KS est posé s’il existe également un situs inversus, une condition dans laquelle l’asymétrie normale gauche-droite du corps (par exemple estomac à gauche, foie à droite) est inversée. Le premier symptôme est dû à l’inactivité des nombreux cils des cellules épithéliales dans les poumons. Leur fonction normale est de maintenir le mucus dans la voie respiratoire constamment en mouvement. Normalement, le mucus aide à garder les poumons humides pour faciliter le fonctionnement, mais si le mucus devient stationnaire, il devient un terrain fertile pour les bactéries, en plus de devenir un irritant et un obstacle à un échange gazeux approprié.
Situs inversus est une malformation intéressante car elle survient au cours du développement embryonnaire et ne touche que 50% des patients atteints de PCD car l’altération de la fonction ciliaire entraîne une randomisation de l’asymétrie gauche-droite, et non une inversion. En termes très simples, au début du développement embryonnaire, l’asymétrie gauche-droite est due en partie au mouvement des signaux moléculaires vers la gauche à travers le nœud embryonnaire. Ce flux est causé par le battement coordonné des cils, donc quand ils ne fonctionnent pas, le flux est perturbé et la randomisation se produit.
D’autres symptômes des patients atteints de PCD soulignent également le travail des cils et des flagelles dans le corps. L’infertilité masculine est fréquente en raison du sperme immotile. L’infertilité féminine, bien que moins fréquente, peut également survenir, en raison d’un dysfonctionnement des cils de l’oviducte et de la trompe de Fallope qui déplacent normalement l’ovule de l’ovaire à l’utérus. Fait intéressant, il existe également une faible association d’hydrocéphalie interne (remplissage excessif des ventricules du cerveau avec du liquide céphalo-rachidien, provoquant leur élargissement qui comprime le tissu cérébral autour d’eux) avec le PCD. Cela est probablement dû à un dysfonctionnement des cils dans les cellules épendymaires tapissant les ventricules, et qui aident à faire circuler le LCR, mais ne sont apparemment pas complètement nécessaires. Étant donné que l’écoulement en vrac du LCR serait principalement dû au changement de la systole / diastole de la pression artérielle dans le cerveau, certains émettent l’hypothèse que les cils pourraient être impliqués principalement dans l’ow par certains des canaux les plus serrés du cerveau.
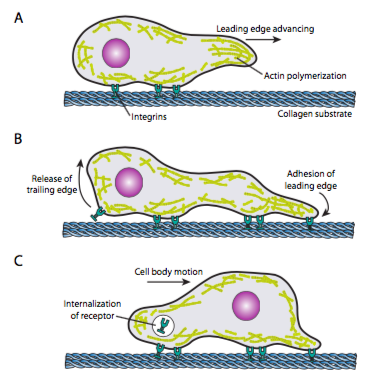
L’exploration cellulaire (Figure\(\PageIndex{19}\)) nécessite le réarrangement coordonné du réseau de microfilaments de bord d’attaque, s’étendant (par polymérisation et filaments glissants) puis formant des adhérences au nouveau point le plus avancé. Cela peut prendre la forme de filopodes ou de lamellipodes, et souvent les deux simultanément. Les filopodes sont des projections longues et très minces avec des faisceaux centraux de microfilaments parallèles et de fortes concentrations de récepteurs de surface cellulaire. Leur but est principalement de sentir l’environnement. Les lamellipodes s’étendent souvent entre deux lopodes et sont plus un large volant qu’un doigt. Intérieurement, l’actine se forme plus en mailles qu’en faisceaux, et le bord plus large permet de faire plus d’adhérences au substrat. Le réseau de microfilaments se réorganise ensuite, ouvrant cette fois un espace dans le cytoplasme qui sert de canal pour le mouvement des microtubules vers l’avant de la cellule. Cela met le réseau de transport en place pour aider à faire avancer le matériel en vrac intracellulaire. Au fur et à mesure que cela se produit, les anciennes adhérences à l’extrémité arrière de la cellule sont libérées. Cette libération peut se faire par deux mécanismes primaires: l’endocytose du récepteur ou la désactivation du récepteur par changement de signalisation / conformation. Bien sûr, cette simplification excessive dément les complexités de la coordination et du contrôle de toutes ces actions pour accomplir le mouvement dirigé d’une cellule.
Un modèle de génération de force de microfilaments, le modèle à rochet brownien élastique (Mogilner et Oster, 1996), propose qu’en raison du mouvement brownien de la membrane cellulaire résultant d’une fluctuation thermique continue d’une minute, les filaments d’actine qui poussent vers les bords de la membrane sont fléchis à des degrés divers. Si le flex est suffisamment grand, un nouveau monomère d’actine peut s’insérer entre la membrane et la pointe du filament, et lorsque le filament maintenant plus long fléchit en arrière, il peut exercer une plus grande poussée sur la membrane. Évidemment, un seul filament ne génère pas beaucoup de force, mais l’extension coordonnée de nombreux filaments peut pousser la membrane vers l’avant.
Une fois qu’une cellule reçoit un signal pour se déplacer, la réponse cytosquelettique initiale consiste à polymériser l’actine, en construisant plus de microfilaments à incorporer dans le bord d’attaque. Selon le signal (attrayant ou répulsif), la polymérisation peut se produire du même côté ou de l’autre de la cellule à partir du point d’activation du récepteur du signal. De manière significative, la polymérisation de la nouvelle f-actine seule peut générer une force suffisante pour faire avancer la membrane, même sans intervention des moteurs à myosine! Les modèles de génération de force sont débattus, mais commencent généralement par l’incorporation d’une nouvelle actine g dans un filament à son extrémité, c’est-à-dire à l’interface filament-membrane. Même si cela peut être techniquement suffisant, dans une cellule vivante, les myosines sont impliquées et aident à pousser et à organiser les filaments de manière directionnelle afin de mettre en place le nouveau bord d’attaque. De plus, certains filaments et réseaux doivent être rapidement coupés, et de nouvelles connexions doivent être établies, à la fois entre les filaments et entre les filaments et d’autres protéines telles que des molécules d’adhésion ou des microtubules.
Comment la polymérisation et le réarrangement de l’actine sont-ils contrôlés ? Les récepteurs qui signalent la locomotion cellulaire peuvent initier des voies quelque peu différentes, mais beaucoup partagent certains points communs en activant un ou plusieurs membres de la famille Ras des petites GTPases. Ces molécules de signalisation, telles que Rac, Rho et cdc42 peuvent être activées par les tyrosines kinases des récepteurs (voir voies d’activation RTK-Ras, chap. 14). Chacun d’entre eux a un rôle légèrement différent dans la motilité cellulaire: l’activation de cdc42 conduit à la formation de filopodes, Rac active une voie qui comprend l’Arp2 / 3 et la cofiline vers la formation de lamellipodes, et Rho active la myosine II pour contrôler l’adhésion focale et la formation de fibres de stress. Un type différent de cascade de récepteurs, la cascade de signalisation de la protéine G (également chapitre 14), peut conduire à l’activation de la PLC et au clivage ultérieur de PIP2 et à l’augmentation du Ca2 + cytosolique. Ces changements, comme indiqué précédemment, peuvent également activer la myosine II, ainsi que les enzymes de remodelage gelsoline, cofiline et profiline. Cela décompose les structures d’actine existantes pour rendre la cellule plus fluide, tout en contribuant à plus de g-actine pour former le nouveau cytosquelette de bord d’attaque.
Des expériences in vitro montrent qu’à mesure que la membrane avance, de nouveaux contacts adhésifs sont établis à travers des molécules d’adhésion ou des récepteurs qui lient le substrat (souvent, les lames ou les boîtes de culture cellulaire sont recouvertes de collagène, de filaminine ou d’autres protéines de la matrice extracellulaire). Les contacts recrutent alors des éléments cytosquelettiques pour une plus grande stabilité pour former une adhérence focale (Figure\(\PageIndex{20}\)). Cependant, la formation d’adhérences focales semble être un artefact de la culture cellulaire, et il n’est pas clair si les types d’adhérences qui se forment in vivo recrutent les mêmes types de composants cytosquelettiques.
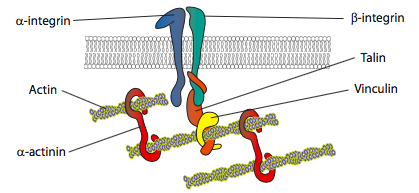
La troisième étape de la locomotion cellulaire est le mouvement massif du contenu cellulaire vers l’avant. Les mécanismes de cette phase ne sont pas clairs, mais il existe des preuves qu’en utilisant des liens entre le cytosquelette d’actine au bord d’attaque et les parties avant du cytosquelette des microtubules, les microtubules sont réarrangés pour former une voie de transport efficace pour le mouvement en vrac. Un autre aspect de cela peut être un effet de « corrallage » par les réseaux d’actine, qui ouvrent directionnellement de l’espace vers le bord d’attaque. Les microtubules pénètrent alors plus facilement dans cet espace que de travailler à travers une maille d’actine serrée, forçant l’écoulement dans la bonne direction.
Une grande partie des travaux sur les interactions microtubules-actine dans la motilité cellulaire a été réalisée par des recherches sur le cône de croissance neuronale, parfois appelé cellule en laisse, car il agit presque indépendamment comme une cellule rampante, à la recherche de la voie appropriée pour conduire son axone du corps cellulaire à sa connexion synaptique appropriée (A.W. Schaefer et al, Dev. Cellule 15:146-62, 2008).
Enfin, la cellule doit défaire ses anciennes adhérences sur le bord de fuite. Cela peut se produire de différentes manières. In vitro, des cellules rampantes se sont arrachées du substrat, laissant derrière elles de minuscules morceaux de membrane et des protéines d’adhésion associées au cours du processus. La force générée est supposée provenir des fibres de contrainte actine-myosine provenant des adhérences focales les plus avancées. Cependant, il existe des mécanismes moins destructeurs disponibles pour les cellules. Dans certains cas, l’adhésivité du récepteur cellulaire pour le substrat extracellulaire peut être régulée intérieurement, peut-être par phosphorylation ou déphosphorylation d’un récepteur. Une autre possibilité est l’endocytose du récepteur, en le retirant de la surface cellulaire. Il pourrait simplement se recycler jusqu’au bord d’attaque où il est nécessaire (c’est-à-dire la transcytose), ou s’il n’est plus nécessaire ou endommagé, il peut être décomposé en un lysosome.
